Виктоза шприц ручка: Виктоза инструкция по применению: показания, противопоказания, побочное действие – описание Victoza р-р д/п/к введения 6 мг/1 мл: картридж в шприц-ручке 3 мл 1, 2 или 3 шт. (24403)
Виктоза раствор для инъекций 6 мг/мл картридж вложенный в шприц-ручку 3 мл №2
Препарат Виктоза применяют для лечения недостаточно контролируемого сахарного диабета II типа у взрослых как дополнение к диете и физическим упражнениям:
- в качестве монотерапии, когда применение метформина считается нецелесообразным из-за непереносимости или противопоказаниях;
- в комбинации с другими средствами для лечения диабета.
Состав
Действующее вещество: liraglutide;
1 мл раствора содержит 6 мг лираглутида – аналога человеческого глюкагоноподобного пептида-1 (ГПП-1), произведенного с помощью технологии рекомбинантной ДНК в Saccharomyces cerevisiae. Одна предварительно заполнена шприц-ручка содержит 18 мг лираглутид в 3 мл;
Вспомогательные вещества: натрия фосфат дигидрат, пропиленгликоль, фенол, натрия гидроксид, кислота соляная, вода для инъекций.
Противопоказания
Повышенная чувствительность к активному веществу или другим компонентам препарата, которые указаны в списке вспомогательных веществ.
Способ применения
Виктозу нельзя вводить внутривенно или внутримышечно.
Препарат Виктоза вводят 1 раз в сутки в любое время независимо от приема пищи. Его можно ввести подкожно в область передней брюшной стенки, бедра или плеча. Место и время инъекций можно менять без коррекции дозы. Однако желательно вводить препарат Виктоза примерно в одно и то же наиболее удобное время дня.
Дополнительные рекомендации по введению представлены в инструкции по использованию шприц-ручки для препарата Виктоза.
Особенности применения
Беременные
Не применяется.
Дети
Не применяется.
Водители
Пациентам следует рекомендовать принять меры по профилактике возникновения гипогликемии в период управления транспортным средством или другим механизмом, в частности при применении препарата Виктоза одновременно с сульфонилмочевины или инсулином.
Передозировка
В клинических исследованиях и сообщениях, поступивших после вывода лекарственного средства Виктоза на рынок, отмечены случаи превышения рекомендуемой поддерживающей дозы до 40 раз (72 мг).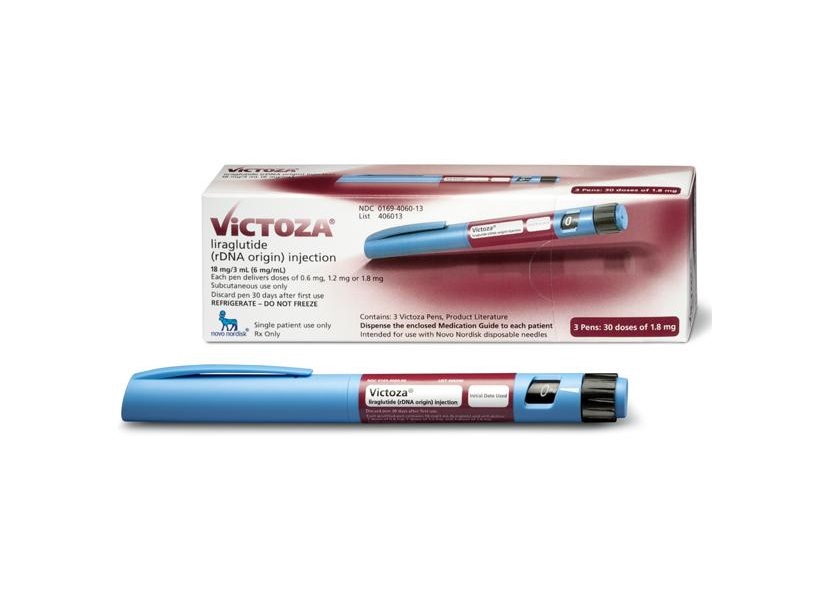 В общем пациенты сообщали о сильной тошноте, рвоте и диарее, но никто из пациентов не сообщал о тяжелой гипогликемии. Все больные выздоровели без осложнений.
В общем пациенты сообщали о сильной тошноте, рвоте и диарее, но никто из пациентов не сообщал о тяжелой гипогликемии. Все больные выздоровели без осложнений.
Побочные эффекты
Наиболее частыми побочными эффектами в течение клинических исследований были расстройства органов пищеварения, среди которых очень часто встречались тошнота и диарея, часто – рвота, запор, боль в животе и диспепсия. В начале лечения желудочно-кишечные расстройства встречаются чаще, однако при продолжении лечения их выраженность в течение нескольких дней или недель обычно снижается. Также часто отмечались головная боль и назофарингит.
Взаимодействие
Инсулин. У больных со стабилизированным сахарным диабетом II типа при одновременном введении инсулина детемира (5 ЕД/кг) и лираглютиду (1,8 мг) не наблюдалось признаков фармакокинетического и фармакодинамического взаимодействия.
Условия хранения
Хранить в недоступном для детей месте.
Хранить в холодильнике (2°С – 8°С) подальше от морозильной камеры. Не замораживать.
Не замораживать.
После первого применения хранить при температуре ниже 30°С или в холодильнике
(2°С – 8°С). Не замораживать.
Для предотвращения воздействия света хранить шприц-ручку с закрытым колпачком.
Срок годности – 30 месяцев.
Виктоза, 6 мг/мл, раствор для подкожного введения, 3 мл, 2 шт.
Механизм действия
Лираглутид представляет собой аналог человеческого ГПП-1, произведенный методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae, имеющий 97% гомологичности с человеческим ГПП-1, который связывается и активирует рецепторы ГПП-1 у человека. Рецептор ГПП-1 служит мишенью для нативного ГПП-1 — эндогенного гормона инкретина, вызывающего стимуляцию глюкозозависимой секреции инсулина в бета-клетках поджелудочной железы. В отличие от нативного ГПП-1, фармакокинетический и фармакодинамический профили лираглутида позволяют вводить его пациентам 1 раз в сутки.
Профиль длительного действия лираглутида при п/к инъекции обеспечивается тремя механизмами: самоассоциацией, в результате которой происходит замедленное всасывание препарата; связыванием с альбумином и более высоким уровнем ферментативной стабильности по отношению к ДПП-4 и ферменту нейтральной эндопептидазы (НЭП), за счет чего обеспечивается длительный T1/2 препарата из плазмы. Действие лираглутида осуществляется за счет взаимодействия со специфическими рецепторами ГПП-1, в результате чего повышается уровень цАМФ. Под действием лираглутида происходит глюкозозависимая стимуляция секреции инсулина и улучшение функции бета-клеток поджелудочной железы. Одновременно лираглутид подавляет излишне высокую глюкозозависимую секрецию глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. С другой стороны, во время гипогликемии лираглутид снижает секрецию инсулина, но не подавляет секрецию глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка. Лираглутид снижает массу тела и уменьшает жировую ткань при помощи механизмов, вызывающих уменьшение чувства голода и снижение расхода энергии.
Действие лираглутида осуществляется за счет взаимодействия со специфическими рецепторами ГПП-1, в результате чего повышается уровень цАМФ. Под действием лираглутида происходит глюкозозависимая стимуляция секреции инсулина и улучшение функции бета-клеток поджелудочной железы. Одновременно лираглутид подавляет излишне высокую глюкозозависимую секрецию глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. С другой стороны, во время гипогликемии лираглутид снижает секрецию инсулина, но не подавляет секрецию глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка. Лираглутид снижает массу тела и уменьшает жировую ткань при помощи механизмов, вызывающих уменьшение чувства голода и снижение расхода энергии.
ГПП-1 является физиологическим регулятором аппетита и потребления калорий, а рецепторы ГПП-1 расположены в нескольких областях головного мозга, участвующих в процессах регуляции аппетита.
В исследованиях на животных периферическое введение лираглутида приводило к захвату препарата в специфических областях головного мозга, включая гипоталамус, где лираглутид посредством специфической активации рецепторов ГПП-1 усиливал сигналы насыщения и ослаблял сигналы голода, тем самым приводя к уменьшению массы тела.
Исследования на экспериментальных животных моделях с предиабетом показали, что лираглутид замедляет развитие сахарного диабета. Диагностика in vitro показала, что лираглутид является мощным фактором специфической стимуляции пролиферации бета-клеток поджелудочной железы и предупреждает гибель бета-клеток (апоптоз), индуцируемую цитокинами и свободными жирными кислотами. In vivo лираглутид повышает биосинтез инсулина и увеличивает массу бета-клеток у экспериментальных животных моделей с сахарным диабетом. Когда концентрация глюкозы нормализуется, лираглутид перестает увеличивать массу бета-клеток поджелудочной железы.
Препарат Виктоза® обладает длительным 24-часовым действием и улучшает гликемический контроль путем снижения концентрации глюкозы крови натощак и после еды у пациентов с сахарным диабетом типа 2.
Глюкозозависимая секреция инсулина. При возрастании концентрации глюкозы в крови лираглутид увеличивает секрецию инсулина. При применении поэтапной инфузии глюкозы секреция инсулина после введения однократной дозы препарата Виктоза® пациентам с сахарным диабетом типа 2 возрастает до уровня, сопоставимого с таковым у здоровых субъектов (рис. 1).
Рисунок 1. Средняя скорость секреции инсулина (ССИ) в сравнении с концентрацией глюкозы после введения однократной дозы 7,5 мкг/кг (»0,66 мг) или плацебо у пациентов с сахарным диабетом типа 2 (N=10) и у не получавших терапию здоровых субъектов (N=10) во время поэтапной инфузии глюкозы (исследование 2063)
Функция бета-клеток поджелудочной железы. Препарат Виктоза® улучшает функцию бета-клеток поджелудочной железы, что подтверждается первой и второй фазой инсулинового ответа и максимальной секреторной активностью бета-клеток. Фармакодинамические исследования пациентов с сахарным диабетом типа 2 показали восстановление первой фазы секреции инсулина (в/в введение инсулина), улучшение второй фазы секреции инсулина (гипергликемический клэмп-тест) и максимальную секреторную активность инсулина (тест стимуляции аргинином).
В ходе 52-недельной терапии препаратом Виктоза® произошло улучшение функции бета-клеток поджелудочной железы, что подтверждается оценкой гомеостатической модели функции бета-клеток поджелудочной железы (НОМА-индекс) и соотношением инсулина к проинсулину.
Секреция глюкагона. Препарат Виктоза®, стимулируя секрецию инсулина и подавляя секрецию глюкагона, уменьшает концентрацию глюкозы в крови. Препарат Виктоза® не подавляет глюкагоновый ответ на низкую концентрацию глюкозы. Кроме того, на фоне лираглутида наблюдается более низкая выработка эндогенной глюкозы.
Опорожнение желудка. Лираглутид вызывает небольшую задержку опорожнения желудка, что приводит к снижению интенсивности поступления постпрандиальной глюкозы в кровь.
Масса, состав тела и расход энергии. У субъектов с повышенной массой тела, включенных в долгосрочные клинические исследования препарата Виктоза®, последний вызывал значительное снижение массы тела. Сканирование при помощи методов КТ и двухэнергетической рентгеновской абсорбциометрии (ДЭРА) показало, что потеря массы тела произошла в первую очередь из-за потери жировой ткани пациентов. Эти результаты объясняются тем, что во время терапии препаратом Виктоза® у пациентов снижаются ощущение голода и расход энергии.
Сканирование при помощи методов КТ и двухэнергетической рентгеновской абсорбциометрии (ДЭРА) показало, что потеря массы тела произошла в первую очередь из-за потери жировой ткани пациентов. Эти результаты объясняются тем, что во время терапии препаратом Виктоза® у пациентов снижаются ощущение голода и расход энергии.
Электрофизиология сердца (ЭФс). Действие препарата Виктоза® на процесс реполяризации в сердце было протестировано в исследовании ЭФс. Применение препарата Виктоза® в равновесной концентрации в ежедневной дозе до 1,8 мг не продуцирует удлинение скорректированного интервала QT.
Клиническая эффективность. 3992 пациента с диабетом типа 2 были рандомизированы в 5 двойных слепых клинических исследований по безопасности и эффективности, осуществленных в целях оценки влияния препарата Виктоза® на гликемический контроль. Терапия препаратом Виктоза® вызывает клинически и статистически значимое улучшение показателя HbA1с, концентрации глюкозы натощак и постпрандиальной глюкозы по сравнению с плацебо.
Эти исследования включали 3978 получивших терапию пациентов (2501 пациент получал терапию препаратом Виктоза®), 53,7% мужчин и 46,3% женщин, у 797 пациентов (508 получили терапию препаратом Виктоза®) возраст составил ≥65 лет, у 113 пациентов (66 получили терапию препаратом Виктоза®) возраст составил ≥75 лет.
Гликемический контроль. Препарат Виктоза® в виде монотерапии в течение 52 нед вызывает статистически значимое (p<0,0014) и продолжительное снижение показателя HbA1с по сравнению с этим же показателем у пациентов, получающих терапию глимепиридом. При этом отмеченное снижение HbA1с ниже уровня 7% сохраняется на протяжении 12 мес (рис. 2).
Рисунок 2. Уровень HbA1с составил менее 7% и сохранялся на протяжении 12 мес при назначении препарата Виктоза® пациентам, ранее получавшим терапию в виде диеты и физических нагрузок (исследование 1573)
У пациентов с HbA1с выше уровня 9,5% в исходной точке исследования данный показатель снизился на 2,1% на фоне монотерапии препаратом Виктоза®, в то время как у пациентов, участвующих в комбинированных клинических исследованиях препарата Виктоза®, средний уровень HbA1с снизился на 1,1–2,5%.
Препарат Виктоза® в течение 26-недельной комбинированной терапии с метформином, препаратами сульфонилмочевины или метформином и тиазолидиндионом вызывает статистически значимое (р<0,0001) и продолжительное снижение уровня НbА1с по сравнению с таковым у пациентов, получающих плацебо.
У пациентов, не достигших адекватного гликемического контроля на терапии препаратом Виктоза® и метформином, добавление инсулина детемир обеспечило бóльшую эффективность по сравнению с терапией препаратом Виктоза® и метформином после 26 нед лечения (снижение уровня HbA1с на 0,52%).
Было доказано, что эффективность препарата Виктоза® в дозе 0,6 мг в комбинации с препаратами сульфонилмочевины или метформином превосходит плацебо, но в то же время является более низкой по сравнению с дозировками 1,2 и 1,8 мг.
Соотношение пациентов, достигших снижения уровня HbA1с. На фоне монотерапии препаратом Виктоза® в течение 52-недельного исследования число пациентов, достигших уровня НbА1с <7%, статистически значимо выросло (р≤0,0007) по сравнению с числом пациентов, получающих глимепирид. На 26-й нед применения препарата Виктоза® в сочетании с метформином, препаратами производных сульфонилмочевины или комбинацией метформина с тиазолидиндионами число пациентов, достигших уровня НbА1с ≤6,5%, статистически значимо выросло (р≤0,0001) по отношению к числу пациентов, которые получали терапию гипогликемическими препаратами без добавления препарата Виктоза®.
На 26-й нед применения препарата Виктоза® в сочетании с метформином, препаратами производных сульфонилмочевины или комбинацией метформина с тиазолидиндионами число пациентов, достигших уровня НbА1с ≤6,5%, статистически значимо выросло (р≤0,0001) по отношению к числу пациентов, которые получали терапию гипогликемическими препаратами без добавления препарата Виктоза®.
В группах пациентов, не достигших адекватного гликемического контроля на терапии препаратом Виктоза® и метформином, процентное соотношение пациентов, достигших целевого уровня HbA1с (<7 и ≤6,5%) было значительно выше при терапии инсулин детемир + лираглутид 1,8 мг + метформин по сравнению с терапией лираглутид 1,8 мг + метформин (р≤0,0001/р=0,0016).
В ходе 26-недельного исследования комбинированного применения препарата Виктоза® удалось достичь показателя НbА1с <7% у большего числа пациентов, получавших препарат в виде комбинированной терапии, по сравнению с числом пациентов, получавших его в виде монотерапии.
Пациенты с нарушением функции почек. В двойном слепом исследовании эффективности и безопасности препарата Виктоза® 1,8 мг по сравнению с плацебо в качестве дополнения к инсулину и/или пероральным сахароснижающим препаратам у пациентов с сахарным диабетом типа 2 и нарушением функции почек умеренной степени препарат Виктоза® был более эффективен в снижении уровня HbA1с через 26 нед (-1,05% в сравнении с -0,38%, р<0,0001). У значимо большего количества пациентов было достигнуто значение HbA1с меньше 7% при применении препарата Виктоза® по сравнению с применением плацебо (52,8% в сравнении с 19,5%; р<0,0001). У пациентов, получавших препарат Виктоза®, было отмечено статистически значимое снижение массы тела по сравнению с пациентами, получавшими плацебо (-2,41 кг в сравнении с -1,09 кг, р=0,0052). Риск развития эпизодов гипогликемии между двумя группами терапии был сопоставим. Профиль безопасности препарата Виктоза® был, в целом, аналогичен отмеченному в других исследованиях препарата Виктоза®.
Уровень гликемии натощак. Концентрация глюкозы натощак снизилась на 13–43,5 мг% (0,72–2,42 ммоль/л) на фоне приема препарата Виктоза® как в виде монотерапии, так и в комбинации с одним или двумя пероральными гипогликемическими средствами. Это снижение наблюдалось уже в течение первых двух недель лечения.
Постпрандиальный уровень гликемии. При применении препарата Виктоза® наблюдалось снижение концентрации постпрандиальной глюкозы после каждого из трех ежедневных приемов пищи на 31–49 мг% (1,68–2,71 ммоль/л).
Масса тела. 52-недельная монотерапия препаратом Виктоза® ассоциировалась с устойчивым снижением массы тела.
На протяжении всего периода клинического исследования устойчивое снижение массы тела также ассоциировалось с применением препарата Виктоза® в комбинации с метформином и в сочетании с комбинациями метформина с производными сульфонилмочевины или метформина с тиазолидиндионом.
Снижение массы тела у пациентов, получающих препарат Виктоза® в комбинации с метформином, также наблюдалось после добавления инсулина детемир.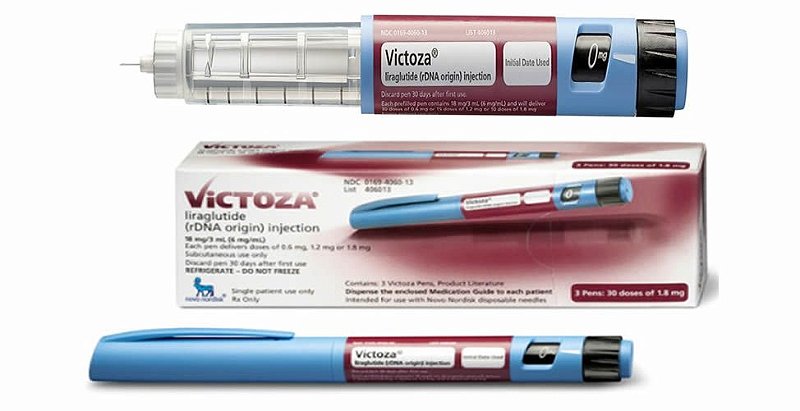
Наибольшее снижение массы тела наблюдалось у пациентов, имевших в исходной точке исследования повышенный ИМТ.
Монотерапия препаратом Виктоза® в течение 52 нед вызвала уменьшение среднего объема талии на 3–3,6 см.
Снижение массы тела наблюдалось у всех пациентов, получавших терапию препаратом Виктоза®, независимо от того, испытывали они или нет побочную реакцию в виде тошноты.
Препарат Виктоза® в составе комбинированной терапии с метформином снизил объем подкожно-жировой клетчатки на 13–17%.
Неалкогольный стеатогепатоз. Лираглутид уменьшает выраженность стеатогепатоза у пациентов с сахарным диабетом типа 2.
Иммуногенность. Учитывая возможность иммуногенного влияния белковых и пептидных лекарственных препаратов, применение препарата Виктоза® у пациентов может привести к образованию антител к лираглутиду. Образование антител отмечается в среднем у 8,6% пациентов. Образование антител не приводит к снижению эффективности препарата Виктоза®.
Оценка влияния на ССС. Долгосрочные клинические исследования показали, что препарат Виктоза® снижает показатели сАД в среднем на 2,3–6,7 мм рт. ст. в первые 2 нед лечения. Препарат Виктоза® понижал частоту развития метаболического синдрома в соответствии с определением III доклада группы экспертов по лечению взрослых (АТРIII). Снижение сАД происходило до снижения массы тела.
В ретроспективном анализе серьезных нежелательных явлений со стороны ССС (смерть по причине сердечно-сосудистой патологии, инфаркт миокарда, инсульт) по данным всех долгосрочных исследований и исследований средней продолжительности II и III фазы (продолжительностью от 26 до 100 нед), включавших 5607 пациентов (3651 пациент получал препарат Виктоза®), было продемонстрировано отсутствие увеличения сердечно-сосудистого риска (отношение коэффициентов заболеваемости 0,75 (95% ДИ 0,35; 1,63) в отношении комбинированной конечной точки при применении препарата Виктоза® в отличии от всех препаратов сравнения (метформин, глимепирид, росиглитазон, инсулин гларгин, плацебо). Пациенты с высоким сердечно-сосудистым риском были исключены из исследований, и частота серьезных сердечно-сосудистых явлений в исследованиях была низкой (6,02 на 1000 пациенто-лет у получавших препарат Виктоза® пациентов и 10,45 — у пациентов, получавших все препараты сравнения), что препятствует получению однозначных выводов.
Пациенты с высоким сердечно-сосудистым риском были исключены из исследований, и частота серьезных сердечно-сосудистых явлений в исследованиях была низкой (6,02 на 1000 пациенто-лет у получавших препарат Виктоза® пациентов и 10,45 — у пациентов, получавших все препараты сравнения), что препятствует получению однозначных выводов.
Другие клинические данные. В открытом исследовании, в котором проводили сравнение эффективности и безопасности препарата Виктоза® в дозе 1,8 мг и ликсисенатида в дозе 20 мкг у 404 пациентов с неудовлетворительным контролем гликемии на фоне терапии метформином (среднее значение HbA1с 8,4%), препарат Виктоза® более эффективно снижал уровень HbA1с по сравнению с ликсисенатидом через 26 нед терапии (-1,83% в сравнении с -1,21%, р<0,0001). У значительно большего количества пациентов было достигнуто значение HbA1с <7% при применении препарата Виктоза® по сравнению с ликсисенатидом (74,2% в сравнении с 45,5%, р<0,0001), а также целевое значение HbA1с 6,5% или меньше (54,6% в сравнении с 26,2%, р<0,0001). Значительно более выраженное снижение концентрации глюкозы плазмы натощак было достигнуто при применении препарата Виктоза®по сравнению с ликсисенатидом (-2,85 в сравнении с -1,70 ммоль/л, р<0,0001). Снижение массы тела было отмечено в обеих группах терапии (-4,3 кг при применении препарата Виктоза® и -3,7 кг при применении ликсисенатида). Профиль безопасности препарата Виктоза® и ликсисенатида был, в целом, сопоставим. Не было выявлено новой информации по безопасности при применении препарата Виктоза®.
Значительно более выраженное снижение концентрации глюкозы плазмы натощак было достигнуто при применении препарата Виктоза®по сравнению с ликсисенатидом (-2,85 в сравнении с -1,70 ммоль/л, р<0,0001). Снижение массы тела было отмечено в обеих группах терапии (-4,3 кг при применении препарата Виктоза® и -3,7 кг при применении ликсисенатида). Профиль безопасности препарата Виктоза® и ликсисенатида был, в целом, сопоставим. Не было выявлено новой информации по безопасности при применении препарата Виктоза®.
В сравнительном исследовании эффективности и безопасности препарата Виктоза® (в дозах 1,2 и 1,8 мг) и ингибитора ДПП-4 ситаглиптина в дозе 100 мг у пациентов, не достигших адекватного контроля на терапии метформином, после 26 нед лечения доказано лучшее снижение показателя HbA1с при применении препарата Виктоза® в обеих дозах по сравнению с ситаглиптином (-1,24, -1,5% по сравнению с -0,9%, р<0,0001). Значительно большее количество пациентов достигли показателя HbA1с ниже 7% при применении препарата Виктоза® по сравнению с ситаглиптином (43,7 и 56% по сравнению с 22%, р<0,0001). Снижение массы тела у пациентов, получавших препарат Виктоза®, было значительно больше по сравнению с пациентами, получавшими ситаглиптин (-2,9 и -3,4 кг в сравнении с -1 кг, р<0,0001). По сравнению с пациентами, получавшими ситаглиптин, у пациентов, получавших препарат Виктоза®, чаще отмечалась тошнота. Однако тошнота была преходящей.
Значительно большее количество пациентов достигли показателя HbA1с ниже 7% при применении препарата Виктоза® по сравнению с ситаглиптином (43,7 и 56% по сравнению с 22%, р<0,0001). Снижение массы тела у пациентов, получавших препарат Виктоза®, было значительно больше по сравнению с пациентами, получавшими ситаглиптин (-2,9 и -3,4 кг в сравнении с -1 кг, р<0,0001). По сравнению с пациентами, получавшими ситаглиптин, у пациентов, получавших препарат Виктоза®, чаще отмечалась тошнота. Однако тошнота была преходящей.
Частота случаев легкой гипогликемии незначительно отличалась при лечении препаратом Виктоза® и ситаглиптином (0,178 и 0,161 в сравнении с 0,106 случая/пациента в год). Снижение показателя HbA1с и преимущество препарата Виктоза® по сравнению с ситаглиптином, наблюдавшееся после 26 нед лечения препаратом Виктоза® (1,2 и 1,8 мг), сохранялось после 52 нед лечения (-1,29 и -1,51% в сравнении с -0,88%, р<0,0001). После 52 нед применения ситаглиптина пациенты были переведены на препарат Виктоза®, что привело к дополнительному и статистически значимому снижению показателя HbA1с на 78-й нед лечения (0,24 и 0,45%, 95 ДИ: от 0,41 до 0,07 и от -0,67 до 0,23), но контрольная группа пациентов не была доступна.
После 52 нед применения ситаглиптина пациенты были переведены на препарат Виктоза®, что привело к дополнительному и статистически значимому снижению показателя HbA1с на 78-й нед лечения (0,24 и 0,45%, 95 ДИ: от 0,41 до 0,07 и от -0,67 до 0,23), но контрольная группа пациентов не была доступна.
В сравнительном исследовании эффективности и безопасности препарата Виктоза® (в дозе 1,8 мг) и эксенатида (в дозе 10 мкг 2 раза в день) у пациентов, не достигших адекватного контроля на терапии метформином и/или производными сульфонилмочевины, после 26 нед применения препарата Виктоза® отмечено большее снижение показателя HbA1с по сравнению с эксенатидом (-1,12% в сравнении с -0,79%, р<0,0001). Значительно большее количество пациентов достигли показателя HbA1с ниже 7% на терапии препаратом Виктоза® по сравнению с эксенатидом (54,2% по сравнению с 43,4%, р=0,0015). Обе терапии показали среднюю потерю массы тела — приблизительно 3 кг.
Количество пациентов, сообщавших о тошноте, было ниже в группе пациентов, получавших препарат Виктоза®, по сравнению с эксенатидом. Частота случаев легкой гипогликемии была значительно ниже в группе пациентов, получавших препарат Виктоза®, по сравнению с эксенатидом (1,932 в сравнении с 2,6 случая/пациента в год, р=0,01). Через 26 нед применения эксенатида пациенты были переведены на препарат Виктоза®, что привело к дополнительному снижению показателя HbA1с на 40-й нед лечения (-0,32%, р<0,0001), при этом 13% пациентов удалось достичь показателя HbA1с ниже 7%.
Терапия препаратом Виктоза® в течение 52 нед улучшила инсулиночувствительность по сравнению с таковой у препаратов сульфонилмочевины, что было выявлено при помощи гомеостатической модели оценки инсулинорезистентности HOMA-IR.
Информация для фармацевтов | Виктоза® (лираглутид) для инъекций 1,2 мг или 1,8 мг
ПРЕДУПРЕЖДЕНИЕ: РИСК С-КЛЕТОЧНЫХ ОПУХОЛЕЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
- Лираглутид вызывает дозозависимые и зависимые от продолжительности лечения С-клеточные опухоли щитовидной железы при клинически значимом воздействии на крыс и мышей обоих полов.
 Неизвестно, вызывает ли препарат Виктоза ® опухоли щитовидной железы из С-клеток, включая медуллярную карциному щитовидной железы (МРЩЖ), у людей, поскольку значимость индуцированных лираглутидом опухолей щитовидной железы у грызунов для человека не установлена.
Неизвестно, вызывает ли препарат Виктоза ® опухоли щитовидной железы из С-клеток, включая медуллярную карциному щитовидной железы (МРЩЖ), у людей, поскольку значимость индуцированных лираглутидом опухолей щитовидной железы у грызунов для человека не установлена. - Виктоза ® противопоказана пациентам с МРЩЖ в личном или семейном анамнезе и пациентам с синдромом множественной эндокринной неоплазии 2 типа (МЭН 2). Консультируйте пациентов относительно потенциального риска МРЩЖ при использовании Виктозы ® и сообщайте им о симптомах опухолей щитовидной железы (например, новообразование в области шеи, дисфагия, одышка, постоянная охриплость голоса). Рутинный мониторинг уровня кальцитонина в сыворотке или использование УЗИ щитовидной железы не имеет сомнительного значения для раннего выявления МРЩЖ у пациентов, получающих Виктозу 9.0009 ® .
Виктоза ® (лираглутид) для инъекций 1,2 мг или 1,8 мг показан в качестве дополнения к диете и физическим упражнениям для улучшения гликемического контроля у пациентов в возрасте 10 лет и старше с сахарным диабетом 2 типа и для снижения риска серьезных неблагоприятных сердечно-сосудистых событий (сердечно-сосудистых заболеваний).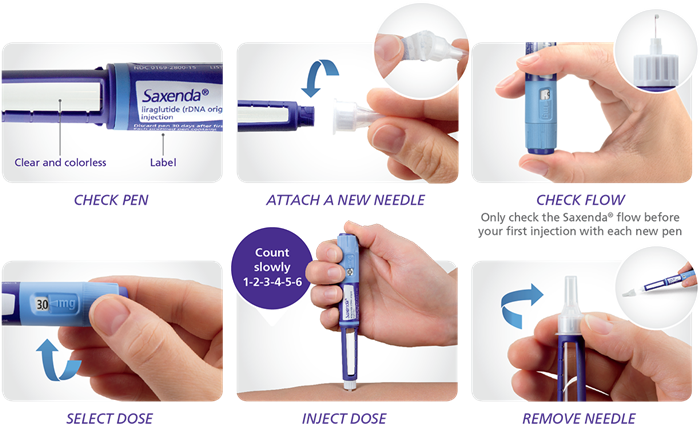 смерть, несмертельный инфаркт миокарда или несмертельный инсульт) у взрослых с сахарным диабетом 2 типа и установленным сердечно-сосудистым заболеванием.
смерть, несмертельный инфаркт миокарда или несмертельный инсульт) у взрослых с сахарным диабетом 2 типа и установленным сердечно-сосудистым заболеванием.
- Виктоза ® не следует применять у пациентов с сахарным диабетом 1 типа.
- Виктоза ® содержит лираглутид и не должен применяться одновременно с другими препаратами, содержащими лираглутид.
Противопоказания
- Виктоза ® противопоказана пациентам с МРЩЖ в личном или семейном анамнезе или пациентам с МЭН 2, а также пациентам с серьезной реакцией гиперчувствительности на лираглутид или к любому из вспомогательных веществ Виктозы ® . При применении препарата Виктоза ® сообщалось о серьезных реакциях гиперчувствительности, включая анафилактические реакции и ангионевротический отек.
Предупреждения и меры предосторожности
- Риск С-клеточных опухолей щитовидной железы: Пациентов следует направить к эндокринологу для дальнейшего обследования, если при измерении уровня кальцитонина в сыворотке обнаруживается его повышение или при физикальном обследовании или визуализации шеи обнаруживаются узлы щитовидной железы.

- Панкреатит: Острый панкреатит, включая фатальный и нефатальный геморрагический или некротизирующий панкреатит, наблюдался у пациентов, получавших Виктозу 9.0009 ® постмаркетинговый. Внимательно обследуйте пациентов на наличие признаков и симптомов панкреатита (постоянные сильные боли в животе, иногда отдающие в спину с рвотой или без нее). При подозрении на панкреатит следует немедленно прекратить прием Виктозы ® и начать соответствующее лечение. Если панкреатит подтвержден, прием Виктозы ® не следует возобновлять.
- Никогда не пользуйтесь шприц-ручкой Victoza ® пациентами, даже если игла заменена. Совместное использование ручки представляет риск передачи патогенов, передающихся через кровь.
- Гипогликемия: Взрослые пациенты, получающие Виктозу ® в сочетании с стимулятором секреции инсулина (например, сульфонилмочевиной) или инсулином, могут иметь повышенный риск гипогликемии, включая тяжелую гипогликемию.

- Почечная недостаточность: В постмаркетинговом периоде сообщалось об острой почечной недостаточности и ухудшении хронической почечной недостаточности, что иногда может потребовать проведения гемодиализа, обычно в связи с тошнотой, рвотой, диареей или обезвоживанием. Соблюдайте осторожность при назначении или повышении дозы препарата Виктоза ® у пациентов с почечной недостаточностью.
- Реакции гиперчувствительности: Поступали постмаркетинговые сообщения о серьезных реакциях гиперчувствительности (например, анафилактических реакциях и ангионевротическом отеке) у пациентов, получавших Виктозу 9.0009 ® . Если возникает реакция гиперчувствительности, прекратите прием Виктозы ® ; лечите быстро в соответствии со стандартом медицинской помощи и наблюдайте, пока признаки и симптомы не исчезнут.
 Не используйте у пациентов с предшествующей реакцией гиперчувствительности на Виктоза ® . При применении других агонистов рецепторов ГПП-1 сообщалось об анафилаксии и ангионевротическом отеке. Соблюдайте осторожность у пациентов с анафилаксией или ангионевротическим отеком в анамнезе при приеме другого агониста рецептора ГПП-1, поскольку неизвестно, будут ли такие пациенты предрасположены к этим реакциям при приеме Виктозы 9.0009 ® .
Не используйте у пациентов с предшествующей реакцией гиперчувствительности на Виктоза ® . При применении других агонистов рецепторов ГПП-1 сообщалось об анафилаксии и ангионевротическом отеке. Соблюдайте осторожность у пациентов с анафилаксией или ангионевротическим отеком в анамнезе при приеме другого агониста рецептора ГПП-1, поскольку неизвестно, будут ли такие пациенты предрасположены к этим реакциям при приеме Виктозы 9.0009 ® . - Острое заболевание желчного пузыря: Острые случаи заболевания желчного пузыря, такие как желчнокаменная болезнь или холецистит, были зарегистрированы в исследованиях агонистов рецепторов GLP-1 и в постмаркетинговых исследованиях. В исследовании LEADER 3,1% пациентов, получавших Виктоза

Побочные реакции
- Наиболее частыми побочными реакциями, о которых сообщалось у ≥5% пациентов, получавших Виктозу ® , и чаще, чем у пациентов, получавших плацебо, были тошнота, диарея, рвота, снижение аппетита, диспепсия и запор. Связанные с иммуногенностью явления, включая крапивницу, чаще встречались у пациентов, получавших Виктозу ® (0,8%), чем у пациентов, получавших препарат сравнения (0,4%), в клинических исследованиях.
Лекарственные взаимодействия
- Виктоза ® вызывает задержку опорожнения желудка и может влиять на всасывание одновременно принимаемых пероральных препаратов. Следует соблюдать осторожность при одновременном применении пероральных препаратов с препаратом Виктоза ® .
- При начале приема препарата Виктоза ® рассмотрите возможность снижения дозы одновременно вводимых средств, стимулирующих секрецию инсулина (таких как препараты сульфонилмочевины) или инсулина, чтобы снизить риск гипогликемии.

Использование в определенных группах населения
- Безопасность и эффективность препарата Виктоза ® у детей младше 10 лет не установлены.
- Victoza ® замедляет опорожнение желудка. Виктоза ® не изучалась у пациентов с ранее существовавшим гастропарезом.
- Виктоза ®
Нажмите здесь, чтобы получить информацию о назначении Victoza ® , включая предупреждение в штучной упаковке.
ПРЕДУПРЕЖДЕНИЕ: РИСК С-КЛЕТОЧНЫХ ОПУХОЛЕЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
- У грызунов семаглутид вызывает дозозависимые и зависимые от продолжительности лечения С-клеточные опухоли щитовидной железы при клинически значимых воздействиях. Неизвестно, вызывает ли Ozempic ® С-клеточные опухоли щитовидной железы, в том числе медуллярную карциному щитовидной железы (MTC), у людей, поскольку значимость индуцированных семаглутидом опухолей щитовидной железы грызунов для человека не установлена.

- Ozempic ® противопоказан пациентам с МРЩЖ в личном или семейном анамнезе и пациентам с синдромом множественной эндокринной неоплазии 2 типа (МЭН 2). Консультировать пациентов относительно потенциального риска для MTC с использованием Ozempic ® и информировать их о симптомах опухолей щитовидной железы (например, масса в шее, дисфагия, одышка, постоянная охриплость). Рутинный мониторинг уровня кальцитонина в сыворотке или использование УЗИ щитовидной железы не имеет сомнительного значения для раннего выявления МРЩЖ у пациентов, получающих Оземпик 9.0009 ® .
Ozempic ® (семаглутид) для инъекций 0,5 мг, 1 мг или 2 мг показан в качестве дополнения к диете и физическим упражнениям для улучшения гликемического контроля у взрослых с сахарным диабетом 2 типа и для снижения риска основных неблагоприятных сердечно-сосудистых (СС) события (смерть от сердечно-сосудистых заболеваний, несмертельный инфаркт миокарда или нефатальный инсульт) у взрослых с сахарным диабетом 2 типа и установленным сердечно-сосудистым заболеванием.
- Применение препарата Ozempic ® у пациентов с панкреатитом в анамнезе не изучалось. Рассмотрите другие противодиабетические методы лечения у пациентов с панкреатитом в анамнезе.
- Ozempic ® не показан для применения у пациентов с сахарным диабетом 1 типа.
Противопоказания
- Оземпик ® противопоказан пациентам с МРЩЖ в личном или семейном анамнезе или пациентам с МЭН 2, а также пациентам с реакцией гиперчувствительности на семаглутид или любое из вспомогательных веществ в Оземпик ® . Сообщалось о серьезных реакциях гиперчувствительности, включая анафилаксию и ангионевротический отек, при приеме Ozempic 9.0009 ® .
Предупреждения и меры предосторожности
- Риск С-клеточных опухолей щитовидной железы: Пациентов следует направить к эндокринологу для дальнейшего обследования, если при измерении уровня кальцитонина в сыворотке обнаруживается его повышение или при физикальном обследовании или визуализации шеи обнаруживаются узлы щитовидной железы.

- Панкреатит: В клинических исследованиях сообщалось об остром и хроническом панкреатите. Внимательно обследуйте пациентов на наличие признаков и симптомов панкреатита (постоянные сильные боли в животе, иногда отдающие в спину с рвотой или без нее). Если подозревается панкреатит, прекратите прием Оземпика 9.0009 ® , и если панкреатит подтвердится, не перезапускать.
- Осложнения диабетической ретинопатии: В 2-летнем исследовании с участием пациентов с диабетом 2 типа и высоким сердечно-сосудистым риском у пациентов, принимавших Ozempic ® , возникало больше случаев осложнений диабетической ретинопатии (3,0%) по сравнению с плацебо (1,8%). . Увеличение абсолютного риска осложнений диабетической ретинопатии было выше среди пациентов с диабетической ретинопатией в анамнезе на исходном уровне, чем среди пациентов без диабетической ретинопатии в анамнезе.
Быстрое улучшение контроля уровня глюкозы связано с временным ухудшением диабетической ретинопатии. Влияние длительного гликемического контроля семаглутидом на осложнения диабетической ретинопатии не изучалось. Пациентов с диабетической ретинопатией в анамнезе следует контролировать на предмет прогрессирования диабетической ретинопатии.
Влияние длительного гликемического контроля семаглутидом на осложнения диабетической ретинопатии не изучалось. Пациентов с диабетической ретинопатией в анамнезе следует контролировать на предмет прогрессирования диабетической ретинопатии. - Никогда не используйте шприц-ручку Ozempic ® совместно с пациентами: шприц-ручки Ozempic ® нельзя использовать совместно с пациентами, даже если игла заменена. Совместное использование ручки представляет собой риск передачи патогенов, передающихся через кровь.
- Гипогликемия: У пациентов, получающих препарат Оземпик® ® в сочетании с стимулятором секреции инсулина (например, сульфонилмочевины) или инсулином, может быть повышен риск гипогликемии, включая тяжелую гипогликемию. Информировать пациентов, принимающих эти сопутствующие препараты, о риске гипогликемии и информировать их о признаках и симптомах гипогликемии.
- Острая почечная недостаточность: Имеются постмаркетинговые сообщения об остром почечном повреждении и ухудшении хронической почечной недостаточности, что иногда может потребовать проведения гемодиализа у пациентов, получавших лечение агонистами рецепторов ГПП-1.
 Некоторые из этих явлений были зарегистрированы у пациентов без известных заболеваний почек. Большинство зарегистрированных явлений произошло у пациентов, которые испытывали тошноту, рвоту, диарею или обезвоживание. Мониторинг почечной функции при начале или повышении дозы Ozempic ® у пациентов с тяжелыми нежелательными желудочно-кишечными реакциями.
Некоторые из этих явлений были зарегистрированы у пациентов без известных заболеваний почек. Большинство зарегистрированных явлений произошло у пациентов, которые испытывали тошноту, рвоту, диарею или обезвоживание. Мониторинг почечной функции при начале или повышении дозы Ozempic ® у пациентов с тяжелыми нежелательными желудочно-кишечными реакциями. - Гиперчувствительность: Серьезные реакции гиперчувствительности (например, анафилаксия, ангионевротический отек) были зарегистрированы у пациентов, принимавших Ozempic ® . Если возникают реакции гиперчувствительности, прекратите использование Ozempic ® ; лечите быстро в соответствии со стандартом медицинской помощи и наблюдайте, пока признаки и симптомы не исчезнут. Следует соблюдать осторожность у пациентов с ангионевротическим отеком или анафилаксией в анамнезе при применении другого агониста рецептора ГПП-1.
- Острое заболевание желчного пузыря: Острые случаи заболевания желчного пузыря, такие как желчнокаменная болезнь или холецистит, были зарегистрированы в исследованиях агонистов рецепторов GLP-1 и в пострегистрационном периоде.
 В плацебо-контролируемых исследованиях сообщалось о желчнокаменной болезни у 1,5% и 0,4% пациентов, получавших Оземпик ® 0,5 мг и 1 мг соответственно, и не сообщалось у пациентов, получавших плацебо. При подозрении на желчнокаменную болезнь показаны исследования желчного пузыря и соответствующее клиническое наблюдение.
В плацебо-контролируемых исследованиях сообщалось о желчнокаменной болезни у 1,5% и 0,4% пациентов, получавших Оземпик ® 0,5 мг и 1 мг соответственно, и не сообщалось у пациентов, получавших плацебо. При подозрении на желчнокаменную болезнь показаны исследования желчного пузыря и соответствующее клиническое наблюдение.
Побочные реакции
- Наиболее распространенными побочными реакциями, зарегистрированными у ≥5% пациентов, получавших Ozempic ® , являются тошнота, рвота, диарея, боль в животе и запор.
Лекарственные взаимодействия
- При начале приема препарата Оземпик ® рассмотрите возможность снижения дозы одновременно вводимых средств, стимулирующих секрецию инсулина (таких как производные сульфонилмочевины) или инсулина, чтобы снизить риск гипогликемии.
- Оземпик ® вызывает задержку опорожнения желудка и может влиять на всасывание одновременно принимаемых пероральных препаратов, поэтому следует соблюдать осторожность.

Использование в определенных группах населения
- Имеются ограниченные данные о применении семаглутида беременными женщинами для информирования о связанном с приемом препарата риске неблагоприятных исходов развития. Прекратите прием препарата Оземпик ® у женщин по крайней мере за 2 месяца до планируемой беременности из-за длительного периода вымывания семаглутида.
Нажмите здесь, чтобы получить информацию о назначении Ozempic ® , включая предупреждение в штучной упаковке.
Как и где вы используете ручку Victoza?
Медицинское заключение Leigh Ann Anderson, PharmD. Последнее обновление: 13 июня 2022 г.
Ключевые моменты
- Ручка Виктоза (лираглутид) — это инъекционный препарат, используемый в дополнение к диете и физическим упражнениям для лечения диабета 2 типа. Его вводят в виде подкожных (под кожу) инъекций один раз в день в любое время суток, независимо от приема пищи.
 Посмотреть развернутые направления здесь.
Посмотреть развернутые направления здесь. - Ручка Виктоза предварительно наполнена лекарством. Вы настраиваете ручку на дозу, которую прописывает ваш врач, прежде чем вводить ее. Вы сами каждый раз прикрепляете новую иглу.
- Общее количество доз в вашей шприц-ручке Victoza будет зависеть от вашей дозы. Ручка Victoza содержит в общей сложности 18 мг Victoza и вводит дозы 0,6 мг, 1,2 мг или 1,8 мг на инъекцию. Ваш врач назначит необходимую дозу.
- Убедитесь, что ваш врач, медсестра или фармацевт показали вам, как правильно пользоваться шприц-ручкой перед первым использованием. Прочтите инструкции, прилагаемые к вашей ручке, каждый раз, когда вы заправляетесь, на случай каких-либо изменений.
Как вводить Виктозу?
Ниже приводится сокращенное краткое руководство по использованию пера. Вы должны читать полную инструкцию по применению производителя каждый раз, когда получаете ручку. Если у вас есть дополнительные вопросы, обратитесь к своему врачу, медсестре или фармацевту.
- Попросите вашего лечащего врача показать вам, как пользоваться шприц-ручкой в первый раз или до тех пор, пока вы не почувствуете себя комфортно. Каждый раз просматривайте полную инструкцию в случае каких-либо изменений.
- Перед каждым использованием мойте руки водой с мылом.
- Подготовьте ручку (см. дальнейшие инструкции). Проверьте шприц-ручку, чтобы убедиться, что жидкое лекарство прозрачное, бесцветное и не содержит частиц. Если нет, не используйте его.
- Протрите резиновую пробку тампоном, смоченным спиртом.
- Прикрепите иглу. Ручка Виктоза должна использоваться с одноразовыми иглами Ново Нордиск. Всегда используйте новую иглу для каждой инъекции и меняйте место инъекции.
- Наберите в шприц-ручке ту дозу, которую вам прописал врач.
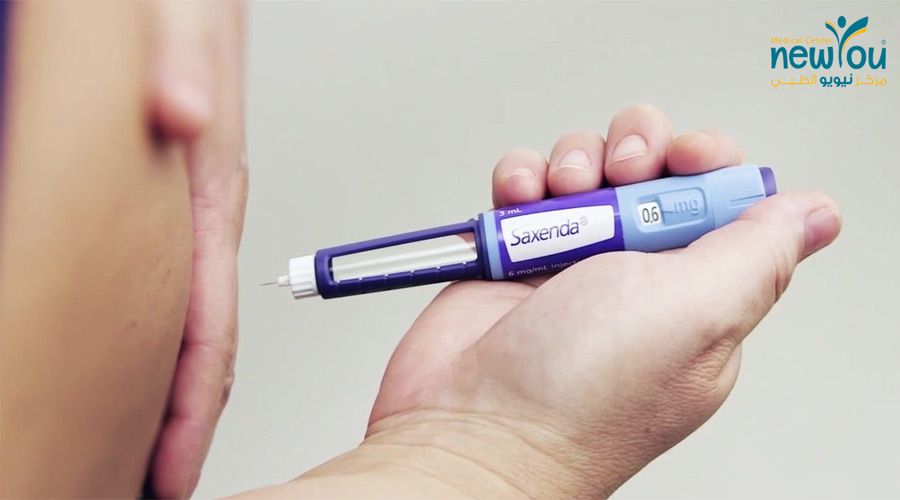
- Введите иглу под кожу в области живота (животной области), бедра или плеча. Не вводите Виктозу в мышцу (внутримышечно) или вену (внутривенно).
- Нажмите на центр кнопки дозирования, чтобы ввести дозу, пока «0 мг» не совпадет с указателем.
 Держите кнопку введения дозы нажатой и держите иглу под кожей в течение 6 секунд, чтобы убедиться, что введена полная доза. Держите большой палец на кнопке инъекции, пока не вытащите иглу из кожи.
Держите кнопку введения дозы нажатой и держите иглу под кожей в течение 6 секунд, чтобы убедиться, что введена полная доза. Держите большой палец на кнопке инъекции, пока не вытащите иглу из кожи. - Извлеките иглу из места инъекции. Если кровь появляется после того, как вы вынули иглу из кожи, слегка надавите, но не трите эту область.
- Извлеките иглу из шприц-ручки и утилизируйте ее в контейнере для острых отходов, одобренном FDA. Не выбрасывайте незакрепленные иглы и ручки вместе с бытовым мусором.
- Храните шприц-ручку без прикрепленной иглы.
Для подготовки ручки
каждый раз, когда вы получаете новую ручку- Символы проверки потока: при первом использовании каждой новой ручки обязательно набирайте символ проверки потока, который выглядит как два тире. Вам нужно сделать это только один раз с каждой новой ручкой. Поворачивайте селектор дозы до тех пор, пока символ проверки потока (–) не совместится с указателем.

- Держите шприц-ручку иглой вверх. Аккуратно постучите по картриджу пальцем несколько раз, чтобы пузырьки воздуха оказались наверху картриджа. Держите иглу направленной вверх и нажимайте кнопку дозирования до тех пор, пока «0 мг» не совпадет с указателем.
- Повторяйте шаги 1 и 2 (при необходимости до 6 раз), пока на кончике иглы не появится капля Виктозы.
- Если вы по-прежнему не видите капли Victoza, используйте новую ручку и свяжитесь с Novo Nordisk по телефону 1-877-484-2869.
Можно ли использовать Виктозу с инсулином?
Да, по назначению врача вы можете сделать инъекцию Виктозы и инсулина в одну и ту же область тела (например, в область желудка), но не рядом друг с другом. Однако НЕ смешивайте инсулин и Виктозу в одной инъекции.
Что делать, если я пропустил инъекцию Виктозы?
Если вы пропустите дозу Виктозы, примите пропущенную дозу при следующей запланированной дозе. Не принимайте 2 дозы Виктозы одновременно.
Другая информация
Не делитесь своей ручкой или иглами с другими людьми из-за риска заражения.
Храните шприц-ручку в холодильнике при температуре от 36ºF до 46ºF (от 2ºC до 8ºC) до первого использования , затем вы можете хранить ее в холодильнике или при комнатной температуре от 59°F до 86°F (от 15°C до 30°C) на срок до 30 дней. Вы можете использовать ручку Victoza до 30 дней после ее использования.
Если у вас есть дополнительные вопросы о шприц-ручке Victoza, позвоните своему врачу, медсестре или фармацевту. Вы также можете связаться с Novo Nordisk, если у вас есть дополнительные вопросы о вашей шприц-ручке Victoza. Вы можете позвонить сертифицированному преподавателю диабета по телефону 1-877-905-1126 с понедельника по пятницу с 8:30 до 18:00 по восточноевропейскому времени.
Эти инструкции не заменяют разговора с вашим поставщиком медицинских услуг о вашем состоянии здоровья или вашем лечении.
Bottom Line
- Victoza представляет собой предварительно заполненную шприц-ручку, используемую в дополнение к диете и физическим упражнениям для лечения диабета 2 типа у пациентов в возрасте 10 лет и старше.
 Он также одобрен для снижения риска серьезных неблагоприятных сердечно-сосудистых событий (таких как сердечный приступ, инсульт или смерть) у взрослых с диабетом 2 типа и сердечными заболеваниями.
Он также одобрен для снижения риска серьезных неблагоприятных сердечно-сосудистых событий (таких как сердечный приступ, инсульт или смерть) у взрослых с диабетом 2 типа и сердечными заболеваниями. - Места для инъекций включают: в кожу в области желудка (живота), бедра или плеча. Не вводите Виктозу в мышцу (внутримышечно) или вену (внутривенно).
- Для инъекции Виктозы необходимо выполнить несколько шагов. Убедитесь, что ваш врач, медсестра или фармацевт показали вам, как пользоваться шприц-ручкой Виктоза перед первой инъекцией.
- Иллюстрированная инструкция производителя находится в каждой упаковке Виктозы. Вы можете следовать этим иллюстрированным инструкциям, чтобы ознакомиться с шагами, необходимыми для введения Виктозы. Если у вас остались вопросы, позвоните своему поставщику медицинских услуг.
Это не вся информация, которую вам необходимо знать о Виктозе для безопасного и эффективного использования. Просмотрите полную информацию о Victoza здесь и обсудите эту информацию со своим врачом или другим поставщиком медицинских услуг.

 Неизвестно, вызывает ли препарат Виктоза ® опухоли щитовидной железы из С-клеток, включая медуллярную карциному щитовидной железы (МРЩЖ), у людей, поскольку значимость индуцированных лираглутидом опухолей щитовидной железы у грызунов для человека не установлена.
Неизвестно, вызывает ли препарат Виктоза ® опухоли щитовидной железы из С-клеток, включая медуллярную карциному щитовидной железы (МРЩЖ), у людей, поскольку значимость индуцированных лираглутидом опухолей щитовидной железы у грызунов для человека не установлена. 
 Не используйте у пациентов с предшествующей реакцией гиперчувствительности на Виктоза ® . При применении других агонистов рецепторов ГПП-1 сообщалось об анафилаксии и ангионевротическом отеке. Соблюдайте осторожность у пациентов с анафилаксией или ангионевротическим отеком в анамнезе при приеме другого агониста рецептора ГПП-1, поскольку неизвестно, будут ли такие пациенты предрасположены к этим реакциям при приеме Виктозы 9.0009 ® .
Не используйте у пациентов с предшествующей реакцией гиперчувствительности на Виктоза ® . При применении других агонистов рецепторов ГПП-1 сообщалось об анафилаксии и ангионевротическом отеке. Соблюдайте осторожность у пациентов с анафилаксией или ангионевротическим отеком в анамнезе при приеме другого агониста рецептора ГПП-1, поскольку неизвестно, будут ли такие пациенты предрасположены к этим реакциям при приеме Виктозы 9.0009 ® .


 Влияние длительного гликемического контроля семаглутидом на осложнения диабетической ретинопатии не изучалось. Пациентов с диабетической ретинопатией в анамнезе следует контролировать на предмет прогрессирования диабетической ретинопатии.
Влияние длительного гликемического контроля семаглутидом на осложнения диабетической ретинопатии не изучалось. Пациентов с диабетической ретинопатией в анамнезе следует контролировать на предмет прогрессирования диабетической ретинопатии. Некоторые из этих явлений были зарегистрированы у пациентов без известных заболеваний почек. Большинство зарегистрированных явлений произошло у пациентов, которые испытывали тошноту, рвоту, диарею или обезвоживание. Мониторинг почечной функции при начале или повышении дозы Ozempic ® у пациентов с тяжелыми нежелательными желудочно-кишечными реакциями.
Некоторые из этих явлений были зарегистрированы у пациентов без известных заболеваний почек. Большинство зарегистрированных явлений произошло у пациентов, которые испытывали тошноту, рвоту, диарею или обезвоживание. Мониторинг почечной функции при начале или повышении дозы Ozempic ® у пациентов с тяжелыми нежелательными желудочно-кишечными реакциями. В плацебо-контролируемых исследованиях сообщалось о желчнокаменной болезни у 1,5% и 0,4% пациентов, получавших Оземпик ® 0,5 мг и 1 мг соответственно, и не сообщалось у пациентов, получавших плацебо. При подозрении на желчнокаменную болезнь показаны исследования желчного пузыря и соответствующее клиническое наблюдение.
В плацебо-контролируемых исследованиях сообщалось о желчнокаменной болезни у 1,5% и 0,4% пациентов, получавших Оземпик ® 0,5 мг и 1 мг соответственно, и не сообщалось у пациентов, получавших плацебо. При подозрении на желчнокаменную болезнь показаны исследования желчного пузыря и соответствующее клиническое наблюдение.
 Посмотреть развернутые направления здесь.
Посмотреть развернутые направления здесь. Держите кнопку введения дозы нажатой и держите иглу под кожей в течение 6 секунд, чтобы убедиться, что введена полная доза. Держите большой палец на кнопке инъекции, пока не вытащите иглу из кожи.
Держите кнопку введения дозы нажатой и держите иглу под кожей в течение 6 секунд, чтобы убедиться, что введена полная доза. Держите большой палец на кнопке инъекции, пока не вытащите иглу из кожи.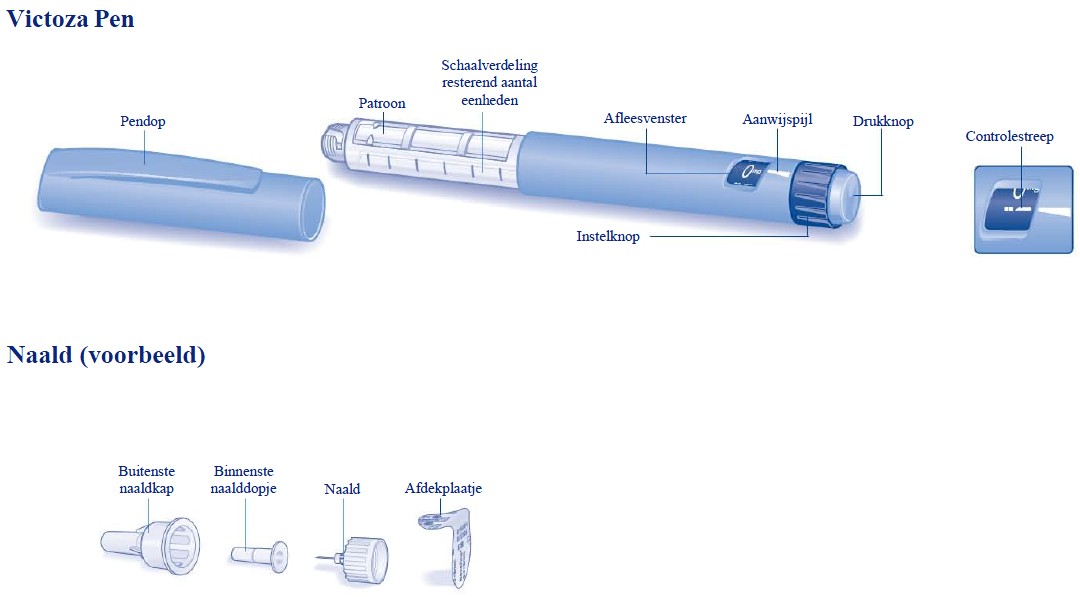
 Он также одобрен для снижения риска серьезных неблагоприятных сердечно-сосудистых событий (таких как сердечный приступ, инсульт или смерть) у взрослых с диабетом 2 типа и сердечными заболеваниями.
Он также одобрен для снижения риска серьезных неблагоприятных сердечно-сосудистых событий (таких как сердечный приступ, инсульт или смерть) у взрослых с диабетом 2 типа и сердечными заболеваниями.