Протеин – это… Что такое Протеин?
 Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка.
Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка.Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека, поскольку в их организме не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков принесло Фредерику Сенгеру Нобелевскую премию в 1958 году. Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции рентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в 1958 году [1][2], за что в 1962 году они получили Нобелевскую премию по химии.
История изучения

Антуан Франсуа де Фуркруа, основоположник изучения белков
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен из зерна пшеницы. Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. Термин «протеин» для обозначения подобных молекул был предложен в 1838 году сотрудником Мульдера Якобом Берцелиусом
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков [5]. В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза
Однако центральная роль белков в организмах не была признана до 1926 года, когда американский химик Джеймс Самнер (впоследствии — лауреат Нобелевской премии) показал, что фермент уреаза была белком[6].
Изучению белков препятствовала сложность их выделения. Поэтому первые исследования белков проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов и пищеварительных/метаболических ферментов, которые можно было выделить в местах забоя скота. В конце 1950-х годов компания Armour Hot Dog Co смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих учёных.
Идея о том, что вторичная структура белков образуется в результате образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов были получены в 1960-х годах и с помощью ЯМР в 1980-х годах. В 2006 году Банк данных о белках (Protein Data Bank) содержал около 40 000 структур белков.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.
Свойства
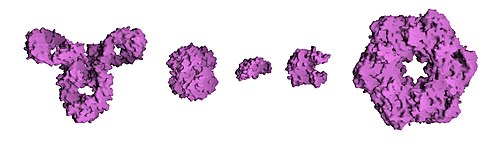
 Сравнительный размер белков. Слева направо: Антитело (IgG), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент)
Сравнительный размер белков. Слева направо: Антитело (IgG), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент)Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин (другие названия: тайтин, коннектин) — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3 000 до 3 700 кДа, а общая длина 38 138 аминокислот (в человеческой мышце solius
Белки также являются амфотерными полиэлектролитами (полиамфолитами), при этом группами, способными к ионизации в растворе, являются карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие боковых цепей основных аминокислот (в первую очередь ω-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина). Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды рН, при которой молекула данного белка не несёт электрического заряда и, соответственно, не перемещаются в электрическом поле (например, при электрофорезе). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI.
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 считаются основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако некоторых случаях значения лежат в экстремальных областях так, например, для пепсина — протеолетического фермента сильнокислого желудочного сока pI ~ 1[8], а для сальмина — белка-протамина молок лосося, особенностью которого является чрезвычайно высокое содержание аргинина, pI ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот часто являются основными белками. Примером таких белков служат гистоны и протамины.
По степени растворимости в воде белки бывают растворимыми (гидрофильные) и нерастворимыми (гидрофобные). К последним относятся большинство входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны [9].
Денатурация

Необратимая денатурация белка куриного яйца под воздействием высокой температуры
Как правило, белки сохраняют структуру и, следовательно, физико-химические свойства, например, растворимость в условиях, таких как температура и рН, к которым приспособлен данный организм [6]. Резкое изменение этих условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной, третичной и вторичной структур белка, называемой денатурацией. Самый известный случай денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, как в случае осаждения (преципитации) водорастворимых белков с помощью солей аммония, и используется как способ их очистки[10].
Простые и сложные белки
Все белки разделяют на две большие группы — простые и сложные белки. Простые белки содержат только аминокислоты, сложные белки имеют также неаминокислотные группы. Эти дополнительные группы в составе сложных белков называются «простетическими группами». Примерами простетических групп в составе белков служат гем (в составе гемоглобина), витамины тиамин и биотин. Неорганические простетические группы состоят из ионов металлов — цинка, магния и молибдена
Структура белка
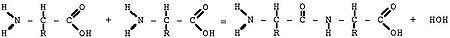 Схематическое изображение образования пептидной связи (справа). Подобная реакция происходит в молекулярной машине по образованию белка — рибосоме
Схематическое изображение образования пептидной связи (справа). Подобная реакция происходит в молекулярной машине по образованию белка — рибосомеМолекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются пептидные связи. Концы белка называют С- и N- концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде последовательности нуклеотидов, причём одной аминокислоте соответствует одна или несколько последовательностей из трёх нуклеотидов — так называемых триплетов или кодонов. То, какая аминокислота соответствует данному кодону в мРНК определяется генетическим кодом, который может несколько отличаться у разных организмов.
 Сравнение аминокислотных последовательностей белков (в данном случае — гемоглобинов) из разных организмов позволяет определять участки, важные для функционирования белков, а также эволюционную историю сравниваемых видов
Сравнение аминокислотных последовательностей белков (в данном случае — гемоглобинов) из разных организмов позволяет определять участки, важные для функционирования белков, а также эволюционную историю сравниваемых видовГомологичные белки (выполняющие одну функцию и, предположительно, имеющие общее эволюционное происхождение, например, гемоглобины) разных организмов имеют во многих местах цепи различные аминокислотные остатки, называемые вариабельными, в противоположность консервативным, общим остаткам. По степени гомологии возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.
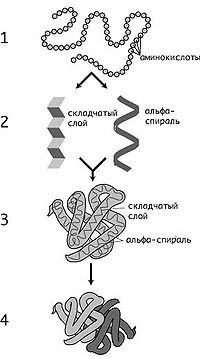
Уровни структуры белков: 1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная
Уровни структуры белка
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура белка, которая формируется в процессе фолдинга (от англ. folding), «сворачивание»). Трёхмерная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка[12]:
- Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, важных для функции белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним можно предсказать функцию неизвестного белка.
- Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями. Ниже приведены некоторые распространённые типы вторичной структуры белков:
- α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L), хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина, близкорасположенные аспарагин, серин, треонин и лейцин могут стерически мешать образованию спирали, пролин вызывает изгиб цепи и также нарушает α-спирали.
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры R-групп аминокислот, преобладают обычно глицин и аланин.
- π-спирали;
- 310-спирали;
- неупорядоченные фрагменты.
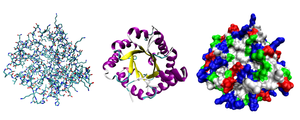 Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева — «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы, α-спирали и β-листы. Справа изображена контактная поверхность белка, на основании Ван-дер-Ваальсовых радиусов атомов; цветами показаны особенности активности участков
Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева — «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы, α-спирали и β-листы. Справа изображена контактная поверхность белка, на основании Ван-дер-Ваальсовых радиусов атомов; цветами показаны особенности активности участков- Третичная структура
- — пространственное строение полипептидной цепи — взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. В стабилизации третичной структуры принимают участие:
Белки разделяют на группы согласно их трёхмерной структуре. Например, изображённый на картинке справа белок, триозофосфатизомераза, состоит из восьми α-спиралей, расположенных на внешней поверхности структуры и восьми параллельных β-слоёв внутри структуры. Белки с подобным тёхмерным строением называются αβ-баррелы (от англ. barrel — бочка) [1].
- Четверичная структура
- — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Также выделяют:
- Трёхмерную структуру белка — набор пространственных координат, составляющих белок атомов.
- Субъединичную (доменную) структуру белка — последовательность участков белка, имеющих известную функцию или определённую трёхмерную структуру.
- Гидрофобное ядро, обеспечивающее сворачивание белка.
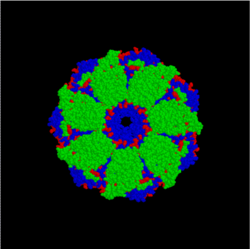 Изображение модели комплекса бактериальных шаперонов GroES и GroEL (вид сверху). Аггрегированный белок поступает в центральную полость комплекса, где в результате гидролиза АТФ происходит изменение его структуры
Изображение модели комплекса бактериальных шаперонов GroES и GroEL (вид сверху). Аггрегированный белок поступает в центральную полость комплекса, где в результате гидролиза АТФ происходит изменение его структурыОбразование и поддержание структуры белков в живых организмах
Способность белков восстанавливать правильную трёхмерную структуру после денатурации позволила выдвинуть гипотезу о том, что вся информация о конечной структуре белка содержится в его аминокислотной последовательности. В настоящее время общепризнана теория о том, что в результате эволюции стабильная конформация белка обладает минимальной свободной энергией по сравнению с другими возможными конформациями этого полипептида [13].
Тем не менее, в клетках существует группа белков, функция которых — обеспечение восстановления структуры белков после повреждения, а также создание и диссоциация белковых комплексов. Эти белки называются шаперонами. Концентрация многих шаперонов в клетке возрастает при резком повышении температуры окружающей среды, поэтому они относятся к группе Hsp (англ. heat shock proteins — белки теплового шока)[14]. Важность нормальной работы шаперонов для функционирования организма может быть проиллюстрирована на примере шаперона, α-кристаллина, входящего в состав хрусталика глаза человека. Мутации в этом белке приводят к помутнению хрусталика из-за аггрегирования белков и, как результат, к катаракте [15].
Синтез белков
Химический синтез
Короткие белки могут быть синтезированы химическим путём с помощью группы методов, которые используют органический синтез — например, химическое лигирование[16]. Большинство методов химического синтеза проходят в направлении от С-конца к N-концу, в противоположность биосинтезу. Таким образом можно получить короткий иммунногенный пептид (эпитоп), необходимый для получения антител путём инъекции в животных, или получения гибридо́м; химический синтез также используется для получения ингибиторов некоторых ферментов [17]. Химический синтез позволяет вводить искусственные, то есть не встречающиеся в обычных белках аминокислоты — например, присоединять флюоресцентные метки к боковым цепям аминокислот. Однако химические методы синтеза неэффективны при длине белков более 300 аминокислот; кроме того, искусственные белки могут иметь неправильную третичную структуру, и у аминокислот искусственных белков отсутствуют посттрансляционные модификации.
Биосинтез белков
Универсальный способ: рибосомный синтез
Молекулярная модель малой (слева) и большой (справа) субъединиц бактериальной рибосомы — молекулярной машины, синтезирующей белки. Голубым цветом показаны белки в составе рибосомы, но основную структурную роль выполняет рРНКБелки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах. Каждый белок состоит из уникальной последовательности аминокислот, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. Генетический код составляется из трёхбуквенных «слов», называемых кодонами; каждый кодон отвечает за присоединение к белку одной аминокислоты: например, сочетание АУГ соответствует метионину. Поскольку ДНК состоит из четырёх типов нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более, чем одним кодоном. Гены, кодирующие белки сначала транскрибируются в последовательность нуклеотидов матричной РНК (мРНК) белками РНК-полимеразами.
У прокариот мРНК может считываться рибосомами в аминокислотную последовательность белков сразу после транскрипции, а у эукариот она транспортируется из ядра в цитоплазму, где находятся рибосомы. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду [18].
Процесс синтеза белка с мРНК называется трансляцией. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена метиониновая транспортная РНК (тРНК). После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции — элонгация. При каждом движении рибосомы от 5′ к 3′ концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами (кодоном) мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомальной РНК рРНК, образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК (рРНК) катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положении, благоприятном для прохождения реакции. Ферменты аминоацил-тРНК-синтетазы присоединяют аминокислоты к их тРНК. Третья, и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C- концу.
Нерибосомный синтез
У низших грибов и некоторых бактерий существует менее распространённый способ биосинтеза белков, который не требует участия рибосом. Синтез пептидов, обычно вторичных метаболитов, проводится высокомолекулярным белковым комплексом, так называемой НРС-синтазой. НРС-синтаза обычно состоит из нескольких доменов или отдельных белков, осуществляющих селекцию аминокислот, образование пептидной связи, высвобождение синтезированного пептида и, иногда, домен, способный изомеризовать L-аминокислоты (нормальная форма) в D-форму.[19][20]
Внутриклеточный транспорт и сортировка белков
Основная статья: Внутриклеточная сортировка белков
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные компартменты клетки — ядро, митохондрии, ЭПР, аппарат Гольджи, лизосомы и др., а некоторые белки должны попасть во внеклеточную среду. Для попадания в определенный компартмент белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или сигнальная последовательность белка). В некоторых случаях меткой служат посттрансляционно присоединенные к белку олигосахариды. Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путем везикулярного транспорта. В ядро белки, обладающие сигнальной последовательностью для ядра, попадают через ядерные поры. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шапе
Сывороточный протеин — Циклопедия
Сывороточный белок — биологически активная добавка с высокой концентрацией глобулярных белков. Делается из сыворотки, образовавшейся в процессе производства сыра из молока. [1]
[править] Производство концентрата сывороточного белка
После сворачивания молоко делится на две части: простокваша и сыворотка. Из простокваши делают творог, сыр и казеин. А из молочной сыворотки — концентрат сывороточного белка.
Производство концентрата осуществляется удалением лишних элементов, таких как липиды и других небелковых компонентов по принципу фильтрации.[2] Затем, получившаяся масса высушивается в распылительной сушке, где она впрыскивается каплями в поток горячего воздуха, нагретого до высокой температуры с последующей сепарацией твердых частиц[2]
[править] Виды сывороточного белка
Исходя из способа получения, уровня фильтрации и концентрации сыворотчные белки делятся на три вида:
- Концентрат сывороточного белка (КСБ) содержит до 89 % белка, при этом сохраняя в своем составе незначительную долю жира и лактозы.
- Изолят сывороточного белка (ИСБ) представляет собой более глубокий уровень фильтрации и очистки от небелковых компонентов. Содержит свыше 90 % белка.
- Гидролизат сывороточного белка (ГСБ) это сывороточный белок, в котором, с целью увеличения скорости усваиваемости, было произведено расщепление некоторых химических связей, путём гидролизации.
[править] Влияние сывороточного протеина на здоровье
Сывороточный протеин является источником незаменимых аминокислот и аминокислот с разветвленной цепью (BCAA). В настоящее время учеными ведутся исследования о пользе этих аминокислот, оказываемой организму при болезнях сердечно-сосудистой системы и раковых заболеваниях.[3] К положительным функциям сывороточного протеина относятся:
- Способствует похудению — употребление сывороточного протеина останавливает катаболизм, способствует метаболизму и замедляет усвоение жиров;
- Способствует мышечному росту — сывороточный протеин содержит большое количество аминокислот, необходимых нашим мышцам в послетренировочный период; для восстановления гипертрофированных мышечных волокон и создания новых необходим протеин, который служит строительным материалом для этого;
- Повышение уровня глутатиона — это трипептид, который защищает наши клетки от свободных радикалов. Является антиоксидантом;
- Является помощником в профилактике сердечно-сосудистых заболеваний: протеин снижает уровень «плохого» холестерина (повышенный уровень является причиной возникновения атеросклероза) и триглициридов;
- Повышение иммунитета: белок осуществляет много защитных функций в организме и, как следствие, его недостаток снижает способности нашей иммунной системы. Когда в организм попадают вредоносные бактерии, организм выделяет особый вид белков — антитела, которые связывают и обезвреживают возбудителей
Стоит добавить, что сывороточный протеин содержит лактозу и, как следствие, у людей с непереносимостью лактозы он может вызвать диарею.
[править] Российские производители
В настоящее время не имеется каких-либо данных о существовании на молочных заводах Российской Федерации оборудования необходимого для производства концентрата сывороточного белка. Возможно, это вызвано дороговизной этого оборудования. Однако, производство спортивного питания осуществляется.
[править] Как проверить сывороточный белок в домашних условиях
Белок подвержен денатурации и под воздействием высоких температур начинает безвозвратно сворачиваться, подобно яичному белку на сковороде. Чтобы проверить насыщенность белком сывороточного протеина, достаточно варить его в кипящей воде в течение 2-4 минут. В процессе варки должна выделяться обильная пенна, а протеины начнут сворачиваться, образуя небольшие комочки. Чем больше таких комочков образуется, тем больше содержание белка в тестируемом продукте.
Кроме того, в силу своей натуральности, сывороточный протеин является скоропортящимся продуктом и уже через час после смешивания его с водой или другой жидкостью, он начинает тухнуть.
- ↑ Spurlock, D. «Isolation and Identification of Casein From Milk Course Notes». Retrieved 27 June 2014.
- ↑ 2,02,1 Foegeding, EA; Davis, JP; Doucet, D; McGuffey, MK (2002). «Advances in modifying and understanding whey protein functionality». Trends in Food Science & Technology 13 (5): 151-9. doi:10.1016/S0924-2244(02)00111-5.
- ↑ Luhovyy BL, Akhavan T, Anderson GH (2007). «Whey proteins in the regulation of food intake and satiety». Journal of the American College of Nutrition 26 (6): 704S-712S
Яичный протеин — SportWiki энциклопедия
Яичный протеин называют совершенным. Это и в самом деле так: он содержит все необходимые человеку для жизнедеятельности аминокислоты. В данном случае обязательно нужно уточнить: белок цельных яиц, а не только яичного белка, который привыкли есть бодибилдеры. Хотя биологическая ценность и такого белка все еще достаточно высока.
Желтки обычно игнорируются из-за наличия в них жиров. Меж тем, в них есть достаточное количество белка – примерно 2,7 грамм для среднего яйца весом 50 грамм, а жиров всего лишь четыре с половиной грамма.
И вот что интересно: 72% жиров яичного желтка – моно- либо полиненасыщенные, то есть, совсем не вредные. Так что полностью отказываться от желтков не стоит.
Те, кто застал «благословенное» время полного отсутствия любого спортивного питания на полках магазинов, наверняка пробовали сотворить из подручных средств нечто свое, что хотя бы отдаленно напоминало коктейли, которые удавалось подсмотреть на страницах западных журналов, невесть каким ветром занесенных на бескрайние просторы СССР. Очень часто в ход шли сырые яйца – мы ведь не задумывались тогда о том, что они могут таить с себе разные весьма неприятные болезни. И уж совершенно не знали, что белок сырых яиц усваивается очень плохо. Действительно, согласно многочисленным исследованиям, белок из сырых яиц усваивается примерно на 50-51 %, в то время, как белок яиц, сваренных вкрутую, усваивается практически на 91 %. Так что если вы до сих пор отдаете предпочтение именно сырым яйцам, самое время сменить привычки.
Надо сказать, что выпуском яичного протеина занимается далеко не каждый производитель спортивного питания. Яичный альбумин (в незначительном количестве) входит в состав многих продуктов, но в чистом виде его выпускают лишь 9 компаний, большинство из которых в России. Мне удалось «раскопать» у нас продукты лишь четырех производителей. Во-первых, это Optimum Nutrition – Gold Standart 100% EGG без труда можно найти в обеих странах. Во-вторых, это Dymatize Nutrition – Elite Egg Protein. Правда, этот продукт найти значительно тяжелее. Необходимо отметить, что оба продукта выпускаются только в 900-граммовых (2 фунта) банках. Если вы хотите «сразу всего и побольше», то, вероятно, вам стоит обратить внимание на Sci-Fit 100% Egg Protein. Как можно понять из его названия, выпускается этот протеиновый напиток компанией Sci-Fit (Science Fitness) и поставляется как в двух-, так и в пятифунтовых (2270г) банках. Из отечественных брендов яичный протеин представлен Pureprotein Egg Protein в упаковках по 1000грамм.
Интересно, что все продукты можно считать практически идентичными – у них одинаковое все: от состава до вкусовых решений, а ценовой политикой выделяется только отечественный производитель. Все они содержат чистый яичный альбумин, который производится из цельных яиц, а не только из белков. То есть, состав аминокислот получившегося порошка близок к идеалу.
Все продукты обезжирены либо практически полностью (0,5 грамма жиров) либо таки полностью (этим отличается «дайматайзовский» протеин). Вкусовых решений три: натуральный вкус, ваниль и шоколад. Но, как по мне, все эти «сливочные печенья», «клубники в шоколаде» или «яблоки с корицей» приедаются достаточно быстро, а напитки с ванильным и шоколадным вкусом пьются легко и совершенно не надоедают. Впрочем, «на вкус и цвет…»
С недавнего времени в Украине появился производитель яичного белка в чистом виде для спортсменов – ТМ Овум.
Собственно говоря, минус у протеинового напитка из яичного белка один -достаточно высокая цена. Она-то и является тем сдерживающим фактором, который мешает широкому распространению яичного протеина.
Из плюсов напитка можно отметить сбалансированный аминокислотный состав (даже добавляя к белкам яиц некоторое количество желтков, вам не удастся достичь идеала, а тут -пожалуйста), практически полное отсутствие жиров (хотя далеко не все из них вредны, а некоторые являются весьма полезными), легкость приготовления. Да и выпить коктейль, как ни крути, легче, чем съесть 5-6 яиц, даже если часть желтков выбросить в мусорное ведро. Перевешивают ли все эти плюсы один минус? Если вы не стеснены в средствах, то безусловно. В противном случае – сомнительно. В общем, считайте сами и выбирайте то, что по карману именно вам.
Среднее яйцо весит 50-55 грамм. Будем отталкиваться в расчетах от нижнего предела, тем более, что так и считать легче. Примерно шестьдесят процентов веса яйца приходится на долю белка, сорок – желтка (скорлупа тоже есть, но весит она, по сравнению с внутренностью яйца, ничтожно мало). Значит, белок одного среднестатистического яйца весит примерно 30 грамм. 85% массы белка составляет вода, на долю протеина приходится меньше 13 процентов (точнее -12,7). Отсюда следует, что один яичный белок даст нам примерно 3,8 грамм хорошего яичного протеина. Множим 3,8 на 10 и получаем 38 грамм – это «отдача» от белков десятка яиц. Возьмемся теперь за желтки. Для того, чтобы сбалансировать аминокислотный состав яичных белков, нам стоит на десяток белков добавлять 2 желтка, каждый из которых содержит, как мы уже говорили, примерно 2,7 грамма белка. Добавляем к нашим тридцати восьми граммам и получаем итоговый «выход» белка с десятка яиц – 42,7 грамма. Правда, при этом мы получим и примерно 9 грамм жира. Остается добавить, что цена десятка яиц колеблется (в зависимости от сезона) от одного доллара США (в эквиваленте) до полутора.
О ценах на протеиновые напитки мы уже говорили. Остается выяснить, за какое именно количество белка вы выложите ваши кровные. Собственно протеина в банке Gold Standart 100% EGG 648 грамм (27 порций по 24 грамма в каждой). В продукте от Dymatize Nutrition белка несколько больше – 720 грамм (30 порций по 24 грамма в каждой). Наконец, в маленькой банке Sci-Fit 100% Egg Protein 704 грамма (32 порции по 22 грамма в каждой).
720 грамм – примерно столько же протеина содержится в семнадцати десятках яиц. Которые обойдутся нам максимум в 25 с половиной долларов. Напомню: мы взяли максимальные значения содержания протеина в одной банке и стоимости десятка яиц. Даже если учесть те самые 9 процентов, которые в случае «живых» яиц не усваиваются, сравнение получается не в пользу протеиновых напитков…
Приобретение
Источник Журнал Железный мир №2 2012
Оранжевый каротиноид-протеин — Википедия
Оранжевый каротиноид-протеин (ОКП) — водорастворимый протеин, который у различных цианобактерий служит белком-тушителем, уменьшающим на интенсивном свету передачу энергии от фикобилисом к хлорофиллу в пигментном аппарате фотосинтеза у цианобактерий[1]. Это единственный из известных фотоактивных белков, в котором в качестве фоточувствительных хромофоров используются каротиноиды. Белок состоит из двух доменов, между которыми нековалентно закреплена единственная молекула кето-каротиноида. Это очень эффективный тушитель энергии возбуждения, поглощённой основным светособирающим антенным комплексом цианобактерий — фикобилисомами. Тушение происходит под действием сине-зеленого света. ОКП также способен предотвращать окислительное повреждение, осуществляя тушение энергии возбуждения синглетного кислорода (1O2).
ОКП был впервые описан в 1981 году Холтом и Крогманном, которые изолировали его из цианобактерии Arthrospira maxima[2]. Функции белка оставались не ясны вплоть до 2006 года. Пространственная структура ОКП была получена в 2003 году. Из неё следовало, что белок является эффективным тушителем синглетного кислорода[3]. В 2000 году было показано, что цианобактерии могут осуществлять фотозащитное тушение флуоресценции независимо от фазового перехода мембраны, перепада трансмембранного рН и температуры[4]. Спектр действия процесса тушения указывал на причастность каротиноидов[5], а конкретное участия ОКП было позже продемонстрировано Д. Кириловски и коллегами в 2006 году[6]. В 2008 было показано, что для осуществления фотозащитной функции оранжевый каротиноид-протеин должен быть активирован сильным сине-зелёный светом[7].
Долгое время цианобактерии считались неспособными к нефотохимическому тушению, вместо этого предполагалось, что они полагаются на механизм перераспределения энергии между двумя фотосинтетические реакционными центрами, ФСII и ФСI, известный как механизм «переходных состояний»[8].
Оранжевый каротиноид-протеин присутствует в большинстве геномов цианобактерий[1] и обладает невероятно консервативной первичной структурой, что по-видимому объясняется важностью такой аминокислотной последовательности для сохранения функции протеина. Мутантные клетки с делетированным ОКП выцветали на ярком свету[6], а их фотоингибирование под действием вспышек света наступает быстрее[9]. В условиях недостатка питательных веществ, что является нормой в морских местообитаниях, механизм фотозащиты, такой как ОКП, становится важным даже при низкой освещённости[10].
Этот белок не обнаружен в хлоропластах, и по-видимому характерен только для цианобактерий.
 Спектр поглощения неактивной оранжевой формы ОКП в сравнении со спектром поглощения фотоактивной красной формы.
Спектр поглощения неактивной оранжевой формы ОКП в сравнении со спектром поглощения фотоактивной красной формы.Фотоактивация[править | править код]
При освещении зелёно-голубым светом оранжевый каротиноид-протеин переключается из оранжевой формы (ОКПО) в красную (ОКПR). Возврат ОКПR в ОКПО не зависит от освещения и медленно, самопроизвольно происходит в темноте. Обратимость процесса в клетках обеспечивает низкомолекулярный (13 кДа) белок, FRP (англ. Fluorescence recovery protein). ОКПО считается темновой, стабильной формой этого белка, она не способствует тушению фикобилисом, а вот форма ОКПR активна и участвует в этом процессе. Переход из оранжевой в красную форму происходит на свету и идёт с низкой эффективностью (очень низкий квантовый выход). Такой механизм даёт возможность белку быть активным только при высокой освещённости; в противном случае нефотохимическое тушение, осуществляемое белком, мешало бы фотосинтезу в условиях низкого освещения.
Тушение[править | править код]
Снижение флуоресценции свидетельствует, что красная форма ОКП рассеивает поглощённую фикобилисомами энергию света (энергию возбуждения). Согласно измерениям, при активации ОКП около 30-40 % энергии, поглощаемой фикобилисомами не достигает реакционных центров[11]. Точный механизм тушения и сайты связывания каротиноидов и фикобилисом по-прежнему остаются не известными. Известно что линкерный полипептид ApcE в аллофикоцианиновом ядре фикобилисом важен для этого процесса[6][12], но он не является сайтом тушения[13]. Различные доказательства указывают на то, что тушению подвергается полоса флуоресценции аллофикоцианинового ядра с длинной волны в 660 нм[11][13][14]. Температурная зависимость скорости тушения флуоресценции похожа на кривую сворачивания оранжевого каротиноид-протеина[15], что поддерживает гипотезу о том, что ОКПО слегка денатурирует, когда превращается в ОКПR.
Тушение синглетного кислорода[править | править код]
Кроме всего прочего ОКП способен тушить синглетный кислород при облучении сильным оранжево-красным светом, когда он не может фотоактивироваться и выполнять свою фотозащитную функцию тушения фикобилисом[16]. Это факт весьма существенен, поскольку все оксигенные фототрофы имеют определённый риск окислительного повреждения синглетным кислородом (1О2), который вырабатывается, когда их собственные светособирающего пигменты действуют как фотосенсибилизаторы[17].
 Ленточная диаграмма оранжевого каротиноид-протеина из Arthrospira maxima, (PDB 1M98).
Ленточная диаграмма оранжевого каротиноид-протеина из Arthrospira maxima, (PDB 1M98).Трёхмерная структура[править | править код]
Трехмерные структуры ОКП (в форме ОКПО) была расшифрована в 2003 году, до того как стала понятна его фотозащитная функция[3]. Этот белок весом в 35 кДа состоит из двух структурных доменов: полностью α-спирального N-концевого домена, построенного из двух чередующихся четырёхспиральных пучков, и смешанного α/β С-концевого домена. Два домена соединены длинным пептидным линкером. На трёхмерной структуре ОКПО каротиноиды пересекают оба домена, которые у этой формы белка тесно связаны между собой.
Белок-белковые взаимодействия[править | править код]
Оранжевый каротиноид-протеин участвует в ключевых белок-белковых взаимодействях, которые имеют решающее значение для его фотозащитной функции. Активированная форма ОКПR связывается c aллофикоцианиновым ядром и инициирует механизм тушения. Другой белок, FRP, взаимодействует с C-концевым доменом ОКПR и катализирует реакцию превращения его обратно в ОКПО форму[18]. Поскольку ОКПО не может связываться с фикобилисомами, FRP может эффективно отсоединять ОКП от светособирающих комплексов и восстанавливать их способность к передачи энергии света в реакционные центры.
Гены[править | править код]
Первичная структура (аминокислотная последовательность) очень консервативна среди различных ОКП, а ген белка на бактериальной хромосоме, как правило, расположен в соседнем локусе с белком FRP[1]. Довольно часто рядом расположены гены, ответственные за биосинтез кетокаротиноидов. Такие консервативные функциональные связи подчеркивают эволюционное значение механизма фотозащиты основанного на ОКП для многих цианобактерий.
Существует также множество эволюционно-родственных генов, которые кодируют белки состоящие только из одного из двух доменов, характерных для ОКП. N-концевой домен, Carot_N, встречается только у цианобактерий, но проявляет значительный уровень дупликации. С-концевой домен гомологичен широко распространённому суперсемейству NTF2, все члены которого обладаю укладкой аналогичной белку NTF2 (фактор ядерного транспорта 2), а также примерно 20 другим белковым подсемействам с разнообразными функциями: лимонен-1,2-эпоксидгидролазы, SnoаL-полекетидциклазы и дельта-5-3-кетостероидизомеразы. Большинство если не все члены суперсемейства NTF2 образуют олигомеры, часто используя поверхность бета-листа, чтобы взаимодействовать друг с другом и другими белками.
Растворимость в воде вместе со статусом единственного известного фотоактивного белка, содержащего каротиноиды, делает ОКП ценной моделью для изучения энергетических и фотофизических свойств каротиноидов в растворах. Кроме того, каротиноиды широко известны как антиоксиданты, и таким образом белок может служить упаковкой для доставки каротиноидов в организм в лечебных целях.
Благодаря высокой эффективности тушения флуоресценции в сочетании с низким квантовым выходом фотоактивации с помощью специфических длин волны света, ОКП обладает всеми качествами идеального фотопереключателя, в связи с чем было предложено его использование в качестве новой системы для развивающихся оптогенетических технологий[1]. В будущем он может получить и другие применения в оптофлюидике и биофотонике.
- ↑ 1 2 3 4 Kirilovsky Diana, Kerfeld Cheryl A. The Orange Carotenoid Protein: a blue-green light photoactive protein (англ.) // Photochemical and Photobiological Sciences (англ.)русск. : journal. — 2013. — Vol. 12, no. 7. — P. 1135—1143. — ISSN 1474-905X. — DOI:10.1039/c3pp25406b. — PMID 23396391.
- ↑ Kay Holt, Thomas Krogmann, David W. A carotenoid-protein from cyanobacteria (англ.) // Biochimica et Biophysica Acta (англ.)русск. : journal. — 1981. — Vol. 637, no. 3. — P. 408—414. — ISSN 0005-2728. — DOI:10.1016/0005-2728(81)90045-1.
- ↑ 1 2 Kerfeld, Cheryl A; Sawaya, Michael R; Brahmandam, Vishnu; Cascio, Duilio; Ho, Kwok Ki; Trevithick-Sutton, Colleen C; Krogmann, David W; Yeates, Todd O. The Crystal Structure of a Cyanobacterial Water-Soluble Carotenoid Binding Protein (англ.) // Structure : journal. — 2003. — Vol. 11, no. 1. — P. 55—65. — ISSN 0969-2126. — DOI:10.1016/S0969-2126(02)00936-X. — PMID 12517340.
- ↑ El Bissati K. Delphin E. Murata N. Etienne A.-L. Kirilovsky D. Photosystem II fluorescence quenching in the cyanobacterium Synechocystis PCC 6803: involvement of two different mechanisms (англ.) // Biochimica et Biophysica Acta (англ.)русск. : journal. — 2000. — Vol. 1457, no. 3. — P. 229—242. — ISSN 0005-2728. — DOI:10.1016/S0005-2728(00)00104-3.
- ↑ Rakhimberdieva =Marina G. Stadnichuk Igor N. Elanskaya Irina V. Karapetyan Navassard V. Carotenoid-induced quenching of the phycobilisome fluorescence in photosystem II-deficient mutant of Synechocystis sp. (англ.) // FEBS Letters (англ.)русск. : journal. — 2004. — Vol. 574, no. 1—3. — P. 85—88. — ISSN 0014-5793. — DOI:10.1016/j.febslet.2004.07.087.
- ↑ 1 2 3 Wilson A., Ajlani G., Verbavatz J.M., Vass I., Kerfeld C.A., Kirilovsky D. A soluble carotenoid protein involved in phycobilisome-related energy dissipation in cyanobacteria. (англ.) // The Plant Cell : journal. — 2006. — Vol. 18, no. 4. — P. 992—1007. — DOI:10.1105/tpc.105.040121. — PMID 16531492.
- ↑ Wilson A., Punginelli C., Gall A., Bonetti C., Alexandre M., Routaboul J.M., etal. A photoactive carotenoid protein acting as light intensity sensor. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2008. — Vol. 105, no. 33. — P. 12075—12080. — DOI:10.1073/pnas.0804636105. — PMID 18687902.
- ↑ Biggins John, Bruce Doug. Regulation of excitation energy transfer in organisms containing phycobilins (англ.) // Photosynthesis Research : journal. — 1989. — Vol. 20, no. 1. — P. 1—34. — ISSN 0166-8595. — DOI:10.1007/BF00028620.
- ↑ Boulay Clémence, Abasova Leyla, Six Christophe, Vass Imre, Kirilovsky Diana. Occurrence and function of the orange carotenoid protein in photoprotective mechanisms in various cyanobacteria (англ.) // Biochimica et Biophysica Acta (англ.)русск. : journal. — 2008. — Vol. 1777, no. 10. — P. 1344—1354. — ISSN 0005-2728. — DOI:10.1016/j.bbabio.2008.07.002.
- ↑ Wilson A. Boulay C. Wilde A. Kerfeld C. A. Kirilovsky D. Light-Induced Energy Dissipation in Iron-Starved Cyanobacteria: Roles of OCP and IsiA Proteins (англ.) // THE PLANT CELL ONLINE : journal. — 2007. — Vol. 19, no. 2. — P. 656—672. — ISSN 1040-4651. — DOI:10.1105/tpc.106.045351. — PMID 17307930.
- ↑ 1 2 Rakhimberdieva Marina G. Elanskaya Irina V. Vermaas. Carotenoid-triggered energy dissipation in phycobilisomes of Synechocystis sp. PCC 6803 diverts excitation away from reaction centers of both photosystems (англ.) // Biochimica et Biophysica Acta (англ.)русск. : journal. — 2010. — Vol. 1797, no. 2. — P. 241—249. — ISSN 0005-2728. — DOI:10.1016/j.bbabio.2009.10.008.
- ↑ Rakhimberdieva Marina G. Vavilin Dmitrii V. Vermaas Wim F.J. Elanskaya; Irina V. Karapetyan Navassard V. Phycobilin/chlorophyll excitation equilibration upon carotenoid-induced non-photochemical fluorescence quenching in phycobilisomes of the cyanobacterium Synechocystis sp. PCC 6803 (англ.) // Biochimica et Biophysica Acta (англ.)русск. : journal. — 2007. — Vol. 1767, no. 6. — P. 757—765. — ISSN 0005-2728. — DOI:10.1016/j.bbabio.2006.12.007.
- ↑ 1 2 Jallet D., Gwizdala M., Kirilovsky D. ApcD, ApcF and ApcE are not required for the Orange Carotenoid Protein related phycobilisome fluorescence quenching in the cyanobacterium Synechocystis PCC 6803. (англ.) // Biochimica et Biophysica Acta (англ.)русск. : journal. — 2012. — Vol. 1817, no. 8. — P. 1418—1427. — DOI:10.1016/j.bbabio.2011.11.020. — PMID 22172739.
- ↑ Kuzminov F.I. Bolychevtseva Yu.V. Elanskaya I.V. Karapetyan N.V. Effect of APCD and APCF subunits depletion on phycobilisome fluorescence of the cyanobacterium Synechocystis PCC 6803 (англ.) // Journal of Photochemistry and Photobiology (англ.)русск. : journal. — 2014. — Vol. 133. — P. 153—160. — ISSN 1011-1344. — DOI:10.1016/j.jphotobiol.2014.03.012.
- ↑ Rakhimberdieva Marina G. Bolychevtseva Yulia V. Elanskaya Irina V. Karapetyan Navassard V. Protein–protein interactions in carotenoid triggered quenching of phycobilisome fluorescence in Synechocystis sp. PCC 6803 (англ.) // FEBS Letters (англ.)русск. : journal. — 2007. — Vol. 581, no. 13. — P. 2429—2433. — ISSN 0014-5793. — DOI:10.1016/j.febslet.2007.04.056.
- ↑ Sedoud A., López-Igual R., Ur Rehman A., Wilson A., Perreau F., Boulay C., etal. The Cyanobacterial Photoactive Orange Carotenoid Protein Is an Excellent Singlet Oxygen Quencher. (англ.) // The Plant Cell : journal. — 2014. — Vol. 26, no. 4. — P. 1781—1791. — DOI:10.1105/tpc.114.123802. — PMID 24748041.
- ↑ Krieger-Liszkay Anja, Fufezan Christian, Trebst Achim. Singlet oxygen production in photosystem II and related protection mechanism (англ.) // Photosynthesis Research : journal. — 2008. — Vol. 98, no. 1—3. — P. 551—564. — ISSN 0166-8595. — DOI:10.1007/s11120-008-9349-3. — PMID 18780159.
- ↑ Sutter, M.; Wilson, A.; Leverenz, R. L.; Lopez-Igual, R.; Thurotte, A.; Salmeen, A. E.; Kirilovsky, D.; Kerfeld, C. A. Crystal structure of the FRP and identification of the active site for modulation of OCP-mediated photoprotection in cyanobacteria (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2013. — Vol. 110, no. 24. — P. 10022—10027. — ISSN 0027-8424. — DOI:10.1073/pnas.1303673110.
<ref>, определённый в <references>, с именем «Kay_HoltKrogmann1981» не имеет содержания.Тау-белок — Википедия
Материал из Википедии — свободной энциклопедии
Тау-белок (англ. Microtubule-associated protein tau, MAPT) принадлежит к группе белков, ассоциированных с микротрубочками (MAP). Альтернативный сплайсинг гена MAPT порождает в организме человека шесть известных изоформ белка[1][2]. Белок часто встречается в нейронах центральной нервной системы (ЦНС), и редко — в других местах, однако слабо экспрессируется в астроцитах и олигодендроцитах ЦНС[3].
При болезни Альцгеймера и некоторых других заболеваниях избыточно фосфорилированный тау-белок образует нейрофибриллярные клубки, прекращая стабилизировать микротрубочки.
Тау-белок был открыт в 1975 в лаборатории Marc Kirschner, Принстонский университет.[4]
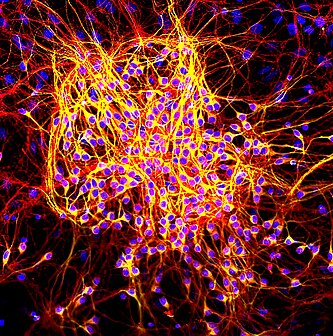 Нейроны, выращенные в культуре. Зелёным обозначены антитела к MAP2, а красным — к MAP tau. Синий цвет — ДНК, желтый — комбинация зеленого и красного.
Нейроны, выращенные в культуре. Зелёным обозначены антитела к MAP2, а красным — к MAP tau. Синий цвет — ДНК, желтый — комбинация зеленого и красного.- ↑ Goedert M., Wischik C.M., Crowther R.A., Walker J.E., Klug A. Cloning and sequencing of the cDNA encoding a core protein of the paired helical filament of Alzheimer disease: identification as the microtubule-associated protein tau (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1988. — June (vol. 85, no. 11). — P. 4051—4055. — DOI:10.1073/pnas.85.11.4051. — PMID 3131773.
- ↑ Goedert M., Spillantini M.G., Jakes R., Rutherford D., Crowther R.A. Multiple isoforms of human microtubule-associated protein tau: sequences and localization in neurofibrillary tangles of Alzheimer’s disease (англ.) // Neuron (англ.)русск. : journal. — Cell Press (англ.)русск., 1989. — October (vol. 3, no. 4). — P. 519—526. — DOI:10.1016/0896-6273(89)90210-9. — PMID 2484340.
- ↑ Shin R.W., Iwaki T., Kitamoto T., Tateishi J. Hydrated autoclave pretreatment enhances tau immunoreactivity in formalin-fixed normal and Alzheimer’s disease brain tissues (англ.) // Lab. Invest. (англ.)русск. : journal. — 1991. — May (vol. 64, no. 5). — P. 693—702. — PMID 1903170.
- ↑ Weingarten M.D., Lockwood A.H., Hwo S.Y., Kirschner M.W. A protein factor essential for microtubule assembly (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1975. — May (vol. 72, no. 5). — P. 1858—1862. — DOI:10.1073/pnas.72.5.1858. — PMID 1057175.
Protein – Wikipedia
Proteini (nem. Proteins, prema grč. πρῶτος: prvi), veliki organski biomakromolekuli sastavljeni od amino kiselina, koje su poređane u linearne lance i spojene međusobno peptidnim vezama između ugljenikovog atoma i amino grupe dve aminokiseline; takođe bjelančevine (ijek.) ili belančevine (ek.).[1] Sekvenca amino kiselina u proteinu definisana je u genima i sadržana u genetičkom kodu. Genetički kod određuju 20 „osnovnih“ amino kiselina. Proteini mogu da deluju zajedno da bi tako lakše dostigli određene funkcije i zato se vezuju u stabilne komplekse. Kao i svi biološki makromolekuli, kao što polisaharidi i amino kiseline, i proteini ulaze u sastav živih organizama i učestvuju u svim procesima među ćelijama. Mnogi proteini su enzimi koji katališu biohemijske reakcije i značajni su za metabolizam. Drugi imaju strukturne ili mehaničke funkcije kao proteini u citoskeletu, koji formiraju “kičmu” koja čini oblik ćelije. Značajni su u ćelijskom prenosu signala, adheziji ćelija, imunološkom sistemu i ćelijskom ciklusu. Neophodni su u našoj ishrani, jer životinje ne mogu da sintetišu sve amino kiseline, i moraju neke da uzimaju iz hrane. Reč protein potiče od Grčke reči πρώτα što znači “ najvažniji, prvi ”. Ove molekule je prvi opisao i imenovao Jakob Bercelijus 1838. Prvi protein koji je izdvojen je insulin od strane Fredericka Sangera, koji je dobio Nobelovu nagradu za ovo otkriće 1958. Među prvima su otkriveni i hemoglobin i mioglobin na osnovu kristalografje X-zbračenja.[2][3][4]
Protein je reč koja potiče iz grčkog jezika u kome ima značenje prvi, zauzimam prvo mesto. U prirodnim naukama označava najširu klasu bioloških makromolekula koji su uključeni u praktično sve biološke pojave.[1]
Proteini su linearni polimeri izgrađeni od 20 različitih L-α amino kiselina. Sve amino kiseline dele zajedničke strukturne karakteristike uključujući α-ugljenik za koji su amino grupa, COO– grupa i bočni lanac vezani. Samo se prolin razlikuje u bočnoj strukturi jer sadrži neuobičajen prsten na N-kraju amino grupe koji drži CO-NH polovinu u fiksnoj konformaciji.[5] Bočni lanac amino kiselina, čiji su detalji dati u listu standardnih amino kiselina, imaju različite hemijske karakteristike koje reprodukuju 3D strukturu. Amino kiseline u polipeptidnom lancu su povezane peptidnim vezama. Peptidna veza je sačinjena od COO– i [NH3] + grupe. Peptidna veza je osnova peptidnog lanca. Formiranje peptidne veze rezultuje otpuštanjem H2O. NCC ponovljeni niz je “kičma” peptida dok sa strane stoje bočni lanci (R). Označavanje linearnog reda amino kiselinskih ostataka ide od N-terminusa ka C-terminusu. Delimično dvogubi karakter peptidne veze uzrokuje da lanac ima samo dva stepena slobode po amino kiselinama, tako da se kiseonik iz karbonilne grupe i amidni vodonik nalaze u istoj ravni kao i peptidna veza i jedino je moguća rotacija oko CO-Cα i N-Cα. Kiseonik iz karbonilne grupe i vodonik iz amidne grupe se zbog sternih interakcija nalaze u trans položaju koji je energetski najpovoljniji (trans je u odnosu na cis stabilniji za 8 KJ/mol). Kraj proteina sa slobodnom COO– grupom je označen kao C-terminus, a kraj [NH3] + kao N-terminus.
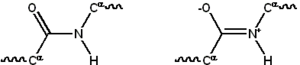 Rezonantna struktura peptidnog lanca individualnih amino kiselina iz proteina
Rezonantna struktura peptidnog lanca individualnih amino kiselina iz proteinaProteini su sklopljeni od amino kiselina čiji je raspored zapisan u genima. Svaki protein ima jedinstvenu amino kiselinsku sekvencu koja je određena sekvencom nukleotida u genu, a nju određuje protein. Genetički kod je set tri nukleotida koji se zovu kodoni. Sve tri nukleotidne kombinacije su svojstvene za jednu aminokiselinu, npr. AUG je kombinacija za metionin. DNK sadrži četiri različita nukleotida, što znači da je broj mogućih kombinacija kodona 64. Geni sadržani u DNK se prvo transkribuju u informacionu RNK preko (iRNK) pošiljaoca, kao što je RNK-polimeraza. Nakon toga ide u ribozome. U prokariotima iRNK može da se koristi kao sama ili da se veže za ribozome koji je odnose iz nukleotida. Eukarioti prave iRNK u ćelijskom jedru i onda se premeštaju kroz membranu jedra u citoplazmu gde dolazi do sinteze proteina.[6] Proces sinteze proteina pomoću iRNK se zove translacija. iRNK se ubacuje u ribozome i pronalazi tri nukleotida koji joj odgovaraju. Enzimi aminoacil-tRNK sintetaza puni tRNK sa odgovarajućim amino kiselinama. Proteini se uvek sintetišu od N-terminusa do C-terminusa.[7][8]
Hemijska sinteza[uredi – уреди | uredi izvor]
Kratki proteini mogu da budu sintetisani grupom metoda poznatih kao “peptidne sinteze”, koje se oslanjaju na tehnike organske sinteze.[9] Hemijska sinteza je uvod u neprirodne amino kiseline u polipeptidnim lancima, kao dodatak za fluorescenciju amino kiselinskim spoljašnjim lancima[10]. Ove metode su veoma korisne u laboratorijama za biohemiju i mikro-ćelijsku biologiju, pa generalno nije za komercijalnu upotrebu. Hemijska sinteza je neupotrebljiva za polipeptidne lance duže od 300 amino kiselina. Proteini se uvek sintetišu od N-terminusa do C-terminusa, nakon hemijskih reakcija.
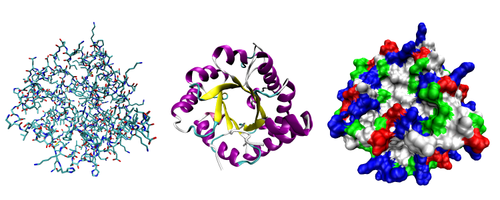 Tri moguće prezentacije 3D strukture tri-fosfat izomeraze levo: predstavljeni su svi atomi različitim bojama u zavisnosti od vrste; sredina: predstavljene su veze unutar molekula; desno: kiselinski deo-crveno, bazni deo-plavo, polarni deo-zeleno, nepolarni deo-belo.
Tri moguće prezentacije 3D strukture tri-fosfat izomeraze levo: predstavljeni su svi atomi različitim bojama u zavisnosti od vrste; sredina: predstavljene su veze unutar molekula; desno: kiselinski deo-crveno, bazni deo-plavo, polarni deo-zeleno, nepolarni deo-belo.Proteini nastaju formiranjem lanaca u čiji sastav ulazi 20 aminokiselina koje se nazivaju proteinogenične ili standardne aminokiseline. Proteini su veliki molekuli čija masa može dostići i vrednosti od nekoliko miliona daltona a struktura može obuhvatiti i neproteinske molekule. U tom smislu razlikujemo proteine sastavljene od aminokiselina i tzv. heteroproteine sastavljene od čisto proteinskog dela koji se naziva apoprotein i prostetične grupe:
- Heteroprotein = apoprotein + prostetična grupa
Ono što proteine čini posebnim jesu stadijumi više organizacije molekula koje nastaju specifičnim vezivanjem lanaca aminokiselina koja mogu biti:
- Primarna
- Sekundarna
- Tercijarna
- Kvarterna

Primarna struktura[uredi – уреди | uredi izvor]
- Glavni članak: Primarna struktura proteina
Primarna struktura proteina je njegova jedinstvena amino kiselinska sekvenca i raspored disulfidnih mostova. Broj i raspored amino kiselina varira od proteina do proteina. Direktna informacija o rasporedu je sadržana u genima, a raspored disulfidnih mostova i 3D struktura zavisi i od drugih faktora. I najmanja promena u primarnoj strukturi može značajno uticati na ukupnu strukturu i funkcionisanje proteina.[11][1]
Sekundarna struktura[uredi – уреди | uredi izvor]
- Glavni članak: Sekundarna struktura proteina
Ovo je lokalna konformacija polipeptidnog lanca zasnovana na vodoničnim vezama. Međutim veze koje stabilizuju sekundarnu strukturu su: disulfidni mostovi, polarne interakcije, vodonične veze. Podrazumeva lokalnu 3D strukturu, zasnovanu na pravilno raspoređenim vodoničnim vezama. Osnovni oblici koji se podrazumevaju pod sekundarnom strukturom su α-heliks, β-nabrana struktura (β-ravan) i β-zavoj. Sekundarna struktura proteina nije nepromenjiva, te su moguće konformacione promene vezane za funkcionisanje proteina, promene u okolini.[12]
Tercijarna struktura[uredi – уреди | uredi izvor]
- Glavni članak: Tercijarna struktura proteina
Ovo je ukupan oblik polipeptida, 3D raspored svih atoma u jednom polipeptidu. Tercijarna struktura je zasnovana na nizu različitih interakcija:
- Između bočnih grupa i peptidnog okoline (vode)
- Bočnih grupa i bočnih grupa
- Bočnih grupa i kičme
Reč je o interakcijama između delova polipeptidnog lanca udaljenih u primarnoj strukturi.[12]
Kvarterna struktura[uredi – уреди | uredi izvor]
- Glavni članak: Kvaternarna struktura proteina
Kvaternarna struktura je prostorni raspored polipeptida u proteinima koji imaju više podjedinica.[12] Prostorni raspored podjedinica u okviru proteina predstavlja njegovu kvaternarnu strukturu. Neki autori govore i o kvintarnoj stukturi u slučajevima kada polipeptidi prave komplekse sa drugim tipovima biomolekula (npr. sa RNK u ribozomima).[13] Najčešće su kombinacije proteina i RNK ili DNK. Malo se zna o tim tipovima veze.
Kvarternu strukturu proteina srećemo, na primer, kod hemoglobina.
Proteini mogu biti svrstani u tri klase: globularni proteini, fibrilarni proteini, membranski proteini.
Skoro svi globularni proteini su rastvorljivi, a mnogi od njih su i enzimi. Prema tipu sekundarne strukture koja u njima dominira mogu se podeliti na:
- Antiparalelne α-heliks proteine
- Paralelne ili kombinovane β-ravan proteine
- Antiparalelne β-ravan proteine
- Male metalo-sulfidima bogate proteine
Unutrašnjost i spoljašnjost proteina su dobro definisane:
- ostaci nepolarnih aminokiselina usmereni su gotovo isključivo ka unutrašnjosti molekula proteina
- naelektrisani ostaci polarnih amino kiselina usmereni su gotovo isključivo ka površini
- nenaelektrisani ostaci polarnih amino kiselina sreću se i u unutrašnjosti, kao i na površini proteina
- gotovo sve grupe koje mogu da grade vodonične veze postavljene su tako da se te veze oforme
Fibrilarni proteini su veoma izduženi molekuli, čija sekundarna struktura čini dominantan strukturni motiv. Najčešće imaju strukturnu ili motornu funkciju. U njih spadaju α i β keratin, fibronektin, kolagen, elastin.
Membranski proteini se dele na integralne i periferne. Integralni su čvrsto ugrađeni u membranu za koju su vezani hidrofobnim vezama. Periferni se lako odvajaju od membrane, za koju su najčešće vezani preko integralnih proteina, elektrostatičkim interakcijama i vodoničnim vezama. Deo strukture membranskih proteina koji je u direktnom kontaktu sa membranom, uređen je suprotno delu u vodenom rastvoru. Hidrofobne bočne grupe i strukture su okrenute prema spolja, dok je jezgro relativno polarno.[14]Membranski proteini nisu fiksirani već im je dozvoljeno transverzalno kretanje, a nekim i flip-flop. Nisu raspoređeni uniformno u membrani, već postoje delovi membrane sa više ili manje nekog proteina. Proteini koji grade jonske kanale ili akvaporini su posebno interesantni, jer deo koji prolazi kroz membranu mora da bude nepolaran ka lipidima, a polaran ili čak naelektrisan ka unutrašnjosti kanala.
Proteini u zavisnosti od svoje građe, provode čitav niz različitih aktivnosti unutar organizma. Prvi i osnovni zadatak proteina je njihova neophodnost u procesu rasta i razvoja. Za bilo koji deo našeg tela koji prolazi kroz proces rasta ili regeneracije proteini su neophodni u svakodnevnici. U zavisnosti od pola i godina unos proteina treba korigovati. Proteini učestvuju praktično u svim procesima u jednom organizmu. Proteini su biomolekuli sa najraznovrsnijimfunkcijama:
- Strukturna (kolagen, keratin)
- Skladišna (albumin, kazein)
- Transportna (hemoglobin)
- Katalitička (enzimi)
- Kontraktilna (miozin)
- Odbrambena (antitela)
- Signalna (insulin)
- Modulaciona (PKA)
- Egzotična (van podele npr. lepak-proteini kod školjki)
Proteini zamenjuju izumrle ćelije. Ćelije koje traže ovakvu zamenu sa proteinima su obično: ćelije krvi, bubrega, jetre, mišića, kose, noktiju, zuba i kosti. Takođe proteini su potrebni telu kako bi mogao da stvori čitav niz enzima i hormona i antitela. Proteini grade velike molekule hemoglobina – materija koja prenosi kiseonik i omogućava nam odvijanje procesa disanja u svim mestima u kojima se taj proces odvija.
Enzimi[uredi – уреди | uredi izvor]
Najveći posao proteina u ćelijama obavljaju enzimi, kada se radi o katalitičkim reakcijama unutar ćelije.[15]Enzimi su katalizatori u katalitičkim reakcijama. Enzimski efekti reakcija učestvuju u velikom broju metabolitičkih i katabolitičkih procesa, kao što su DNK preslikavanje ili pak RNK sintetisanje.[16] Neki enzimi pomažu proteinima da dodaju ili oduzmu neku hemijsku grupu u hemijskim reakcijama, proces poznat kao posttranslaciona modifikacija. Poznato je oko 4 000 reakcija koje katališu enzimi[17]. Aktivno mesto je jedan mali deo proteina koji je direktno uključen u reakciju, ostatak služi za regulaciju, za druge reakcije, za specifične interakcije (sa inhibitorima, kofaktorima, membranom itd).[18]
Ćelijska komunikacija[uredi – уреди | uredi izvor]
- Glavni članak: Ćelijska komunikacija
Neki proteini kao što je insulin, su ekstracelularni proteini koji prenose signal iz ćelije u kojoj su se sintetisali do drugih ćelija. Alosterna regulacija podrazumeva zavisnost vezivanja jednog liganda (molekul koga protein vezuje za sebe, da bi ga transportovao, hemijski obradio i sl) od vezivanja drugog liganda, koji se označava kao modulator. Ako se radi o istim ligandima (istim molekulima) – homotropni efekat, a ako su različiti – heterotropni. Efekti mogu biti pozitivni i negativni, u zavisnosti da li modulator povećava ili smanjuje afinitet proteina za sledeći ligand. Antitela su proteini koji čuvaju imunološki sistem čoveka, tako što se bore protiv ćelija koje žele da ga razore. Mnogi ligandni proteini su vezani za male biomolekule i transportovanje njih do neke druge lokacije u telu vrši se tako što ti proteini moraju imati veliki afinitet vezivanja kada su njihovi ligandi prisutni u velikim koncentracijama u meti-tkivu. Primer ligandno-vezujućih proteina je hemoglobin koji transportuje kiseonik svuda po organizmu.
Kombinacija X-kristalografije, NMR-a, kompjuterskih simulacija i proračuna je dobitna kombinacija u najaktuelnijoj disciplini savremene biofizike tj. određivanja strukture proteina. Poznatije metode za određivanje funkconisanja proteina su:
- X-kristalografija i 2D NMR:
X-kristalografija je dala prvi direktan uvid u strukturu proteina; i danas je nezamenjiva. Problem je u tome što kristalizovan protein nije isto što i protein u rastvoru i dobijena struktura je prosečna struktura proteina. Ne daje podatke o mobilnost i fleksibilnosti proteina. Te podatke dobijamo NMR-om. Kombinacija X kristalografije, NMR-a i mnogo sati kompjuterskih simulacija i proračuna je dobitna kombinacija u najaktuelnijoj disciplini savremene biofizike – određivanju strukture/funkcionisanja proteina.[19][20]
- Difrakcija: Higens-Fresnelov princip
- Jungova interferencija
- Bragov zakon
- Von Laueov uslov
- Akceleratori
Proteini se nalaze u raznim vrstama prehrambenih namirnica. Može se gotovo reći da su u većim ili manjim količinama zastupljeni u svoj hrani osim u rafiniranim šećerima i mastima. Hrana životinjskog porekla poput mesa, riba, jaja, mleka, jogurta i sira dobar je izvor proteina u kvalitativnom i kvantitativnom smislu. Sadrže veliku količinu proteina, ali su i izvor svih esencijalnih aminokiselina. Mnogi mikroorganizmi i biljke mogu da biosintetišu svih 20 aminokiselina, dok životinje i čovek moraju da se podvrgnu određenoj vrsti dijete tj. ishrani[21]. Mnogi enzimi koji imaju glavnu funkciju u ljudskom organizmu nisu stalno prisutni i moraju se unositi.
- ↑ 1,01,11,2 Donald Voet, Judith G. Voet (2005). “Chapter 7. Covalent structure of proteins and nucleic acids”. Biochemistry (3 izd.). Wiley. ISBN 978-0-471-19350-0. http://www.chem.upenn.edu/chem/research/faculty.php?browse=V.
- ↑ Sumner, JB (1926). “The Isolation and Crystallization of the Enzyme Urease. Preliminary Paper” (PDF). J Biol Chem 69: 435–41.
- ↑ Muirhead H, Perutz M (1963). “Structure of haemoglobin. A three-dimensional fourier synthesis of reduced human haemoglobin at 5.5 A resolution”. Nature 199 (4894): 633–8. PMID 14074546. doi:10.1038/199633a0.
- ↑ Kendrew J, Bodo G, Dintzis H, Parrish R, Wyckoff H, Phillips D (1958). “A three-dimensional model of the myoglobin molecule obtained by x-ray analysis”. Nature 181 (4610): 662–6. PMID 13517261. doi:10.1038/181662a0.
- ↑ David L. Nelson, Michael M. Cox (2005). Principles of Biochemistry (4th izd.). New York: W. H. Freeman. ISBN 0-7167-4339-6. http://www.whfreeman.com/newcatalog.aspx?disc=Biochemistry&course=Introduction%2bto%2bBiochemistry&isbn=071677108X&detail=toc.
- ↑ Dobson CM (2000). “The nature and significance of protein folding”. u: RH Pain. Mechanisms of Protein Folding (2 izd.). New York, NY: Oxford University Press. ISBN 978-0-19-963788-1. http://books.google.com/books?hl=en&lr=&id=DvJygJkNCYkC&oi=fnd&pg=PR21&dq=Mechanisms+of+Protein+Folding+Pain&ots=lDcCjkeNE1&sig=3lOFlqfDXwPjlNWNtSbbGNXxc6U#v=onepage&q&f=false.
- ↑ Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipurksy SL, Darnell J. (2004). Molecular Cell Biology (5 izd.). New York, NY.: WH Freeman and Company. http://bcs.whfreeman.com/lodish6e/default.asp?s=&n=&i=&v=&o=&ns=0&uid=0&rau=0.
- ↑ Fulton A, Isaacs W (1991). “Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis”. Bioessays 13 (4): 157–61. PMID 1859393. doi:10.1002/bies.950130403.
- ↑ Bruckdorfer T, Marder O, Albericio F (2004). “From production of peptides in milligram amounts for research to multi-tons quantities for drugs of the future”. Curr Pharm Biotechnol 5 (1): 29–43. PMID 14965208.
- ↑ Schwarzer D, Cole P (2005). “Protein semisynthesis and expressed protein ligation: chasing a protein’s tail”. Curr Opin Chem Biol 9 (6): 561–9. PMID 1859393. doi:10.1016/j.cbpa.2005.09.018.
- ↑ Branden C, Tooze J.. Introduction to Protein Structure. New York, NY: Garland Publishing. ISBN: 0-8153-2305-0. http://www.garlandscience.com/textbooks/0815323042.asp?type=reviews.
- ↑ 12,012,112,2 Donald Voet, Judith G. Voet (2005). “Chapter 8. Three-Dimensional structures of proteins”. Biochemistry (3 izd.). Wiley. ISBN 978-0-471-19350-0. http://www.chem.upenn.edu/chem/research/faculty.php?browse=V.
- ↑ Gonen T, Cheng Y, Sliz P, Hiroaki Y, Fujiyoshi Y, Harrison SC, Walz T. (2005). “Lipid-protein interactions in double-layered two-dimensional AQP0 crystals”. Nature 438 (7068): 633–8. PMID 16319884.
- ↑ Walian P, Cross TA, Jap BK. (2004). “Structural genomics of membrane proteins”. Genome Biol 5 (4): 215. PMID 395774.
- ↑ Bairoch A. (2000). “The ENZYME database in 2000”. Nucleic Acids Res 28: 304–305. PMID 10592255.
- ↑ “The Catalytic Site Atlas at The European Bioinformatics Institute”. http://www.ebi.ac.uk/thornton-srv/databases/CSA/.
- ↑ Radzicka A, Wolfenden R (1995). “A proficient enzyme”. Science 267 (6): 90–931. PMID 7809611. doi:10.1126/science.7809611.
- ↑ Hoffmann M, Wanko M, Strodel P, Konig PH, Frauenheim T, Schulten K, Thiel W, Tajkhorshid E, Elstner M. (2006). “Color tuning in rhodopsins: the mechanism for the spectral shift between bacteriorhodopsin and sensory rhodopsin II”. J Am Chem Soc 128 (33): 10808–18. doi:10.1021/ja062082i.
- ↑ Zagrovic B, Snow CD, Shirts MR, Pande VS. (2002). “Simulation of folding of a small alpha-helical protein in atomistic detail using worldwide-distributed computing”. J Mol Biol 323 (5): 927–37. doi:10.1016/S0022-2836(02)00997-X.
- ↑ Herges T, Wenzel W. (2005). “In silico folding of a three helix protein and characterization of its free-energy landscape in an all-atom force field”. Phys Rev Let 94 (1): 018101. doi:10.1103/PhysRevLett.94.018101.
- ↑ Kuhlman B, Dantas G, Ireton GC, Varani G, Stoddard BL, Baker D. (2003). “Design of a novel globular protein fold with atomic-level accuracy”. Science 302 (5649): 1364–8. doi:10.1126/science.1089427.
- Branden C, Tooze J (1999). Introduction to Protein Structure. New York: Garland Pub. ISBN 0-8153-2305-0.
- Murray RF, Harper HW, Granner DK, Mayes PA, Rodwell VW (2006). Harper’s Illustrated Biochemistry. New York: Lange Medical Books/McGraw-Hill. ISBN 0-07-146197-3.
- Van Holde KE, Mathews CK (1996). Biochemistry. Menlo Park, California: Benjamin/Cummings Pub. Co., Inc. ISBN 0-8053-3931-0.
- Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipurksy SL, Darnell J. (2004). Molecular Cell Biology (5 izd.). New York, NY.: WH Freeman and Company. http://bcs.whfreeman.com/lodish6e/default.asp?s=&n=&i=&v=&o=&ns=0&uid=0&rau=0.
- Dobson CM (2000). “The nature and significance of protein folding”. u: RH Pain. Mechanisms of Protein Folding (2 izd.). New York, NY: Oxford University Press. ISBN 0-19-963788-1. http://books.google.com/books?hl=en&lr=&id=DvJygJkNCYkC&oi=fnd&pg=PR21&dq=Mechanisms+of+Protein+Folding+Pain&ots=lDcCjkeNE1&sig=3lOFlqfDXwPjlNWNtSbbGNXxc6U#v=onepage&q&f=false.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6. Auflage. Spektrum, Heidelberg 2007, ISBN 3-8274-1800-3.
- Friedrich Lottspeich, Haralabos Zorbas: Bioanalytik. Spektrum Akademischer Verlag, Heidelberg 1998, ISBN 978-3-8274-0041-3.
- Hubert Rehm, Thomas Letzel: Der Experimentator: Proteinbiochemie / Proteomics. 6. Auflage, Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-2312-2.
- E. Buxbaum: Fundamentals of Protein Structure and Function (Englisch), Springer, New York 2007. ISBN 9780387263526.
- P. Kaumaya: Protein Engineering, Intech Open, 2012. ISBN 978-953-51-0037-9. (Online Version in Englisch)

Быстрый протеин — SportWiki энциклопедия
Быстрый протеин – это белок с высокой скоростью абсорбции из желудочно-кишечного тракта. К быстрым протеинам относят белки молочной сыворотки – концентрат, изолят и гидролизат с наивысшей скоростью усвоения, также к быстрым причисляют мясной и рыбный белки, однако применяются они крайне редко. Быстрый протеин идеально подходит для набора мышечной массы, так как быстро создаёт высокую концентрацию аминокислот в крови и мышцах, что особенно важно после тренировки, а также провоцирует секрецию анаболического гормона инсулина. Для получения максимального эффекта рекомендуется комбинировать с BCAA.
Читайте также: Виды протеина по происхождению
Что лучше: концентрат, изолят или гидролизат?[править | править код]
В настоящее время выделяют три вида сывороточного белка:
- Концентрат – отличается низкой стоимостью и умеренной степенью очистки. Около 5-10% концентрата составляет лактоза и небольшое количество жира. Усваивается из кишечника примерно на 90% за 3-4 часа. Биологическая ценность – 140.
- Изолят – фактически, это очищенный концентрат. Процент белка достигает 97%. Усваивается примерно 90% за 3 часа. Биологическая ценность 150.
- Гидролизат – частично разрушенный ферментами белок, с целью ускорения всасывания, самая дорогая форма быстрого протеина. Исследования показали, что гидролизация не приводит к значительному ускорению абсорбции[1], однако данная форма значительно сильнее увеличивает секрецию инсулина[2].
Независимое исследование Moriarty KJ[3] показало, что нет значительной разницы в эффекте на азотистый баланс (мышечный рост), при использовании различных форм сывороточного протеина. Это значит, что нет особого смысла платить больше за гидролизат или изолят.
Кому требуется быстрый протеин[править | править код]
Людям, склонным к худобе и с небольшим содержанием жира в организме необходимо принимать протеин несколько раз в сутки. Тучным людям и во время цикла похудения или сушки быстрый белок рекомендуется принимать перед началом тренинга, после тренировки и утром, когда организм испытывает наибольшую востребованность в аминокислотах.
При наборе мышечной массы
Идеальное время приёма быстрого протеина – сразу после тренировки, и утром. Кроме того, белковый концентрат можно принимать между приёмами пищи, за 1,5 часа до тренировки, в общей сложности 3-5 порций по 30 г в среднем. Помните, что 50 % белка желательно принимать из пищевых источников.
При похудении
При похудении лучше принимать комплексный протеин, однако утром и после тренировки подойдёт быстрый, в размере 1/2 от стандартной порции. Примерно 50 % белка желательно получать из пищевых источников.
Читайте основную статью: Расчет дневной потребности в белке
Читайте основную статью: Оптимальное время приема протеина
Лучший быстрый протеин[править | править код]
Изоляты
- Zero Carb от VPX – высококачественный изолят с высокой скоростью усвоения, с хорошим вкусом.
- Iso Sensation от Ultimate Nutrition – вариант аналогичный предыдущему.
Гидролизаты
- ISO-100 от Dymatize – чистый гидролизат изолята сывороточного протеина без добавления жиров, углеводов, витаминов, пищеварительных ферментов, пищевых волокон и прочего. Идеален на время диеты.
Приобретение
- ↑ Farnfield MM, Trenerry C, Carey KA, Cameron-Smith D: Plasma amino acid response after ingestion of different whey protein fractions. Int J Food Sci Nutr 2008 , 8:1-11.
- ↑ Manninen AH: Hyperinsulinaemia, hyperaminoacidaemia and post-exercise muscle anabolism: the search for the optimal recovery drink. Br J Sports Med 2006 , 40:900-5.
- ↑ Moriarty KJ, Hegarty JE, Fairclough PD, Kelly MJ, Clark ML, Dawson AM. Relative nutritional value of whole protein, hydrolysed protein and free amino acids in man. Gut. 1985 Jul;26(7):694-9.
