Что такое аминокислоты – для чего они нужны, польза и вред для человеческого организма, классификация
Аминокислоты — Википедия. Что такое Аминокислоты

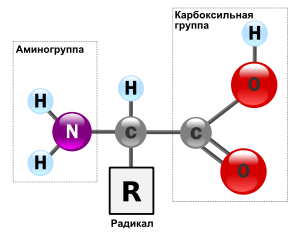
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен [en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH
 N+H3 —CH2COO–
N+H3 —CH2COO–
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой
аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация
| Аминокислота | 3-буквы[13] | 1-буква[13] | аминокислот | мнемоническое правило[14] | Полярность[15] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[16] | частота в белках (%)[17] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75.067 | 48 | 6.06 | −0.4 | 7.03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89.094 | 67 | 6.01 | 1.8 | 8.76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117.148 | 105 | 6.00 | 4.2 | 6.73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131.175 | 124 | 6.05 | 4.5 | 5.49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131.175 | 124 | 6.01 | 3.8 | 9.68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6.30 | −1.6 | 5.02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105.093 | 73 | 5.68 | −0.8 | 7.14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119.119 | 93 | 5.60 | −0.7 | 5.53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Неполярные | Серосодержащие | 121.154 | 86 | 5.05 | 2.5 | 1.38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149.208 | 124 | 5.74 | 1.9 | 2.32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133.104 | 91 | 2.85 | −3.5 | 5.49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132.119 | 96 | 5.41 | −3.5 | 3.93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147.131 | 109 | 3.15 | −3.5 | 6.32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146.146 | 114 | 5.65 | −3.5 | 3.9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146.189 | 135 | 9.60 | −3.9 | 5.19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10.76 | −4.5 | 5.78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155.156 | 118 | 7.60 | −3.2 | 2.26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165.192 | 135 | 5.49 | 2.8 | 3.87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181.191 | 141 | 5.64 | −1.3 | 2.91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204.228 | 163 | 5.89 | −0.9 | 6.73 |
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[15]
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[18]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[19]
См. также
Примечания
- ↑ 1 2 (November 1983) «New Naturally Occurring Amino Acids». Angewandte Chemie International Edition in English 22 (11): 816–28. DOI:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada (1975). «Aspartic acid racemization in tooth enamel from living humans». Proceedings of the National Academy of Sciences 72 (8): 2891 -2894. Проверено 2011-09-05.
- ↑ CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Проверено 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R–36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514–3526. — ISSN 1742-464X. — DOI:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317–327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) – General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1–13. — ISSN 0304-4165. — DOI:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706–712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29–35. — ISSN 1552-4450. — DOI:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — DOI:10.1186/1745-6150-6-14.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105–132. — ISSN 0022-2836.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112–D1116. — ISSN 1362-4962. — DOI:10.1093/nar/gkw978.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — DOI:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
Ссылки
Аминокислоты – это… Что такое Аминокислоты?
 | В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 10 апреля 2012. |
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
История
Открытие аминокислот в составе белков
Физические свойства
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
- NH2 —CH2COOH
 N+H3 —CH2COO–
N+H3 —CH2COO–
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
Данную особенность «живых» аминокислот весьма трудно объяснить, так как в реакциях между оптически неактивными веществами L и D-формы образуются в одинаковых количествах. Возможно, выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним «приспособились» соответствующие ферменты.
D-аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: так в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[2], что может быть использовано для определения возраста млекопитающих. Рацемизация остатков аспарагиновой также отмечена при старении коллагена, предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутремолекулярном ацилировании пептидного азота свободной карбоксильной группой аспарагиновой кислоты[3].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих.
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путем нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся не решённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20-ти протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Для запоминания однобуквенного обозначения протеиногенных аминокислот используется мнемоническое правило (последний столбец).
Классификация
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
- Полярные заряженные отрицательно при pH<7: аспартат, глутамат
- Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями. По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы: глюкогенные (при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат), кетогенные (распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды), глюко-кетогенные (при распаде образуются метаболиты обоих типов).
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты[4].
Примечания
См. также
Ссылки
Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с. [1]
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |
АМИНОКИСЛОТЫ • Большая российская энциклопедия
АМИНОКИСЛО́ТЫ, органич. соединения, содержащие карбоксильные COOH и аминогруппы NH2. Исключение составляет пролин. Обладают свойствами и кислот и оснований. В зависимости от положения аминогруппы в углеродной цепи относительно карбоксильной группы различают α-, β-, γ- и др. А. У ω-А. аминогруппа находится на конце цепи. Участвуют в обмене азотистых веществ всех организмов, являясь исходными соединениями при биосинтезе белков, пептидов, пуриновых и пиримидиновых оснований, ряда витаминов, пигментов, алкалоидов и др.
Классификация
Описано свыше 150 природных А., среди которых особенно важны 20 α-А. (табл.), входящих в состав белков, кодируемых генетическим кодом; общая формула:
В зависимости от природы боковой цепи R α-А. подразделяют на две группы: А. с неполярными (гидрофобными) и А. с полярными (гидрофильными) боковыми цепями. К 1-й группе относятся шесть А. с алифатич. боковой цепью – аланин, валин, лейцин, изолейцин, метионин, пролин и две с ароматической – фенилаланин и триптофан. Среди представителей 2-й группы боковые цепи семи А. содержат группировки, способные нести отрицат. или положит. заряд. В аспарагиновой и глутаминовой кислотах β- и γ-карбоксильные группы при рН 7,0 заряжены отрицательно. К осно́вным А. относятся лизин, аргинин и гистидин. ε-Аминогруппа лизина и гуанидиновая группировка аргинина несут положит. заряд (протонированы) в нейтральной среде, а имидазольная группировка гистидина – в кислой. В щелочных условиях отрицат. заряд могут приобретать боковые группы тирозина и цистеина. Характерной особенностью остатков цистеина является их способность в составе молекулы белка подвергаться окислению с образованием остатков цистина. А. присвоены сокращённые трёхбуквенные и однобуквенные обозначения, используемые в науч. литературе. В 1986 в ряде белков архебактерий, истинных бактерий (эубактерий) и животных была обнаружена α-А. – селеноцистеин (ей присвоены символы Sec и U), в 2002 открыт пирролизин (пока обнаружен только у одного вида метанобразующих архей). Обе эти А. кодируются триплетами, которые обычно служат «стоп-кодонами» (т. е. оповещают об окончании синтеза белка на рибосомах): селеноцистеин – триплетом UGA, а пирролизин – UAG.
Пирролизин (где R=Ch4, Nh3 или OH)
Цистин
Селеноцистеин
Большая часть А., обнаруженных в тканях живых организмов, но не входящих в состав белков, могут выполнять важные функции. Так, орнитин и цитрулин участвуют в обмене веществ, в частности в синтезе мочевины у животных, 2,4-дигидрооксифенилаланин (ДОФА) образуется в качестве промежуточного продукта в ходе распада фенилаланина и тирозина в организме и является медиатором центральной нервной системы. Кроме того, имеются А., функция которых пока не ясна. В ряде белков (уже после их синтеза на рибосомах) боковые группы А. претерпевают изменения в ходе посттрансляционной модификации. Напр., в составе молекулы коллагена пролин и лизин превращаются соответственно в 4-гидроксипролин и 5-гидроксилизин, в миозине присутствует N-метиллизин, только в эластине встречается ферментативно модифицированный лизин – десмозин. Помимо α-А. в свободном виде и в составе некоторых биологически важных пептидов, встречаются А., аминогруппа которых связана не с α-углеродным атомом. К их числу относятся β-аланин, входящий в состав пантотеновой кислоты, γ-аминомасляная кислота, играющая важную роль в функционировании нервной системы, δ-аминолевулиновая кислота, являющаяся промежуточным продуктом синтеза порфиринов.
Физические и химические свойства
А. – бесцветные кристаллич. вещества, растворимые в воде; темп-ры плавления 220–315 °C. В кристаллах и водных растворах при нейтральных значениях рН α-А. существуют преим. в виде диполярных ионов (цвиттер-ионов), у которых аминогруппы протонированы , а карбоксильные группы диссоциированы (СОО–). А. являются амфолитами; ионизация их молекул зависит от рН раствора:
Значения pH, при котором концентрация катионов А. равна концентрации анионов, называется изоэлектрической точкой (pI). Аминогруппа А. ионизирована в неск. меньшей степени, чем карбоксильная группа, поэтому водный раствор А. имеет слабокислый характер. Все α-А., кроме глицина, имеют асимметрический (хиральный) α-углеродный атом и существуют в виде двух энантиомеров. У изолейцина и треонина хиральными являются также и β-углеродные атомы.
За редким исключением природные α-А. относятся к L-ряду и только в оболочках бактерий, в составе некоторых антибиотиков и в метаболитах грибов, а также в коже некоторых видов южноамериканских лягушек и корне женьшеня обнаружены А. D-ряда.
В результате взаимодействия α-аминогруппы одной А. с α-карбоксильной группой другой А. в процессе биосинтеза белка (трансляции) происходит образование пептидной связи.
Превращения аминокислот в организмах
Высшие растения и хемосинтезирующие организмы все необходимые им А. синтезируют из аммониевых солей и нитратов, а также из кето- или гидроксикислот – продуктов дыхания и фотосинтеза. Человек и животные синтезируют большинство А. из обычных безазотистых продуктов обмена и аммониевого азота. Это т. н. заменимые А. Но ряд А. – незаменимых – они должны получать в готовом виде с пищей. Для человека, напр., незаменимыми А. являются валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин, а для детей также аргинин и гистидин. Недостаток в организме той или иной аминокислоты приводит к нарушению обмена веществ, замедлению роста и развития. А. участвуют в поддержании азотистого баланса в организме. Окислит. распад А. путём дезаминирования приводит к образованию кето- и гидроксикислот – промежуточных продуктов цикла трикарбоновных кислот; далее они превращаются в углеводы, новые А. и т. д. или окисляются до СО2 и Н2О с выделением энергии. У животных азот в виде аммониевых солей, мочевины или мочевой кислоты выводится из организма. У растений усвоение А. происходит т. о., что азотистые отходы практически отсутствуют. Некоторые А. являются предшественниками важных гормонов и нейромедиаторов: тирозин и фенилаланин – дофамина и адреналина, триптофан – серотонина, гистидин – гистамина, глутаминовая кислота – γ-аминомасляной кислоты, аргинин – оксида азота (NO).
Практическое использование

Таблица. Важнейшие аминокислоты, входящие в состав белков (цветом обозначены боковые цепи)
Смеси L-α-А., а также отдельные А. применяют в медицине для лечения больных с заболеваниями пищеварит. органов (гистидин, метионин), при малокровии, ожогах (метионин), нервно-психич. заболеваниях (глицин и глутаминовая кислота), при сосудистых заболеваниях головного мозга (γ-аминомасляная кислота) и т. д. Для обогащения кормов в животноводстве и лечения животных используются лизин, метионин, треонин, триптофан, в пищевой пром-сти – глутамат натрия и лизин. ω-А. и их лактамы служат для пром. произ-ва полиамидов. Ароматич. А. нашли применение в синтезе красителей и лекарственных препаратов. Некоторые L-α-А. получают микробиологич. синтезом (лизин, триптофан, треонин, глутаминовая кислота) или выделяют из гидролизатов богатых ими белков (пролин, аргинин, гистидин, глутаминовая кислота, тирозин).
Аминокислоты — Википедия
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот – это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шелка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и др. |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и др. |
Жирным шрифтом выделены незаменимые аминокислоты
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO–
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счет образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация
| Аминокислота | 3-буквы[13] | 1-буква[13] | аминокислот | мнемоническое правило[14] | Полярность[15] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[16] | частота в белках (%)[17] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75.067 | 48 | 6.06 | −0.4 | 7.03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89.094 | 67 | 6.01 | 1.8 | 8.76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117.148 | 105 | 6.00 | 4.2 | 6.73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131.175 | 124 | 6.05 | 4.5 | 5.49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131.175 | 124 | 6.01 | 3.8 | 9.68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6.30 | −1.6 | 5.02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105.093 | 73 | 5.68 | −0.8 | 7.14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119.119 | 93 | 5.60 | −0.7 | 5.53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Неполярные | Серосодержащие | 121.154 | 86 | 5.05 | 2.5 | 1.38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149.208 | 124 | 5.74 | 1.9 | 2.32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133.104 | 91 | 2.85 | −3.5 | 5.49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132.119 | 96 | 5.41 | −3.5 | 3.93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147.131 | 109 | 3.15 | −3.5 | 6.32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146.146 | 114 | 5.65 | −3.5 | 3.9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146.189 | 135 | 9.60 | −3.9 | 5.19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10.76 | −4.5 | 5.78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155.156 | 118 | 7.60 | −3.2 | 2.26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165.192 | 135 | 5.49 | 2.8 | 3.87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181.191 | 141 | 5.64 | −1.3 | 2.91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204.228 | 163 | 5.89 | −0.9 | 6.73 |
По радикалу
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[15]
По функциональным группам
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[18]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[19]
См. также
Примечания
- ↑ 1 2 (November 1983) «New Naturally Occurring Amino Acids». Angewandte Chemie International Edition in English 22 (11): 816–28. DOI:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada (1975). «Aspartic acid racemization in tooth enamel from living humans». Proceedings of the National Academy of Sciences 72 (8): 2891 -2894. Проверено 2011-09-05.
- ↑ CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Проверено 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R–36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514–3526. — ISSN 1742-464X. — DOI:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317–327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) – General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1–13. — ISSN 0304-4165. — DOI:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706–712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29–35. — ISSN 1552-4450. — DOI:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — DOI:10.1186/1745-6150-6-14.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105–132. — ISSN 0022-2836.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112–D1116. — ISSN 1362-4962. — DOI:10.1093/nar/gkw978.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — DOI:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
Ссылки
Что такое аминокислоты и для чего они нужны
Аминокислоты представляют собой строительный материал, который необходим каждому организму для создания и роста мышц. При наличии достаточного количества этих веществ в организме активно идет набор мышечной массы. Именно поэтому профессиональные спортсмены, а также любители увлекаются спортивным питанием с большим количеством аминокислот.
Конечно, эти вещества можно получать и из обычной пищи при грамотно продуманном рационе. Больше всего их находится в рыбе, мясе, яйцах, а также в твороге. Аминокислоты не только помогают сделать тело сильнее и красивее, они нормализуют гормональный фон и отвечают за восстановительные процессы и поддержку иммунной системы.
Роль аминокислот в спортивном питании
Практически в любом спортивном питании в большом количестве имеются аминокислоты. Именно с их помощью тренировки могут быть наиболее результативны. Очень важно правильно принимать вещества и стараться соблюдать дозировки. Для дополнительной страховки перед применением проконсультироваться у врача.
Аминокислоты обязательно нужно принимать в том случае, если человек ведет активный образ жизни и регулярно подвергает себя большим нагрузкам. Их действие будет актуально лишь при наличии тренировок.
Наращивать мышцы и сжигать жир, легко могут с аминокислотами бодибилдеры, боксеры, борцы, бегуны и те, кто просто увлекается фитнесом. Нет ограничений по полу и возрасту. Правда те, кто имеет хронические заболевания, должны проконсультироваться у врача, допустимо ли принятие аминокислот и в каком количестве.
Какие функции выполняют аминокислоты
Эти вещества незаменимы для тренировок. Они помогают избавиться от жировой массы и набрать мышечную. Стоит обратить внимание на действие этих веществ на организм:
- Увеличение энергии. Организм будет заряжен силами для тренировок и человек сможет активнее выполнять упражнения.
- Ускорение синтезирования белка за счет чего активнее идет рост мышц.
- Сжигание подкожного жира, от которого часто тяжелее всего избавится.
Для того, чтобы аминокислоты активно действовали в организме необходимо соблюдать простые правила здорового образа жизни. Достаточное количество времени отдыхать, спать ночью в одно и то же время. Продумать рацион питания и исключить вредные продукты. Дополнительно лучше полностью отказаться от табака и алкоголя.
К чему приводит нехватка аминокислот в организме человека:
- Причины инфекционных заболеваний;
- Частые травмы костей, проблемы с зубами, волосами;
- Периодические стрессы без причин;
- Отражение на синтезе белков в организме, это скажется на отрицательном азотистом балансе.
Что такое заменимые и незаменимые аминокислоты
Все аминокислоты подразделяются на две большие группы:
- Заменимые
- Незаменимые
| Незаменимые аминокислоты | Заменимые |
| Изолейцин | Аланин |
| Гистидин | Аспарагин |
| Лизин | Глицин |
| Лейцин | Таурин |
| Цистеин (условно-незаменимая) | Глутамин |
| Тирозин (условно-незаменимая) | Карнитин |
| Метионин | Орнитин |
| Фенилаланин | Пролин |
| Триптофан | Серин |
| Треонин | |
| Валин |

В каких продуктах содержаться незаменимые аминокислоты
Есть огромное количество разнообразных аминокислот. Каждая из них отвечает за свою функцию. Обязательно нужно постараться добавить в рацион продукты, которые будут источниками незаменимых веществ.
Валин – эта аминокислота помогает восстановлению тканей в организме, отвечает за обмен азота, а также повышает координацию, необходимую для активных тренировок. В простых продуктах она содержится в белом курином мясе, лососе, говядине, а также в яйцах и грецких орехах.
Гистидин также имеется в курице, тунце и лососе, а также полезно добавить чечевицу и арахис. С помощью этой кислоты восстанавливаются мышечные ткани, это помогает легко и просто переживать даже сильные нагрузки на тренировках.
Изолейцин помогает нормализовать гемоглобин и сахар. Это помогает иметь достаточно энергии даже для самых активных тренировок. Яйца, сыр, курица и индейка являются необходимыми продуктами питания для тех, кто хочет иметь нормальное количество этой аминокислоты.
Лейцин поддерживает иммунную систему. Здоровый образ жизни итак помогает меньше болеть и лучше себя чувствовать. Курица, рыба, индейка и творог позволяют нормализовать обмен веществ и организм начинает самостоятельно правильно проводить все метаболические процессы.
Лизин помогает усваивать кальций. Это укрепляет кости и мышцы. Продукты в рационе яйца, курица, рыба, мясо, любое кроме свинины, а также горох и фасоль. Дополнительно с помощью данного вещества формируется коллаген, необходимый для хрящевой ткани суставов.
Метионин отвечает за жировой обмен. Улучшается состояние системы пищеварения. Человек начинает активнее худеть при должном уровне физических нагрузок, а мышечная масса, наоборот, растет. В меню должна быть курица, телятина, индейка, бобы и творог.
Из выше указанных продуктов легко создать вкусный и разнообразный рацион, который будет очень полезен и поможет иметь здоровый организм и отличное тело. Самое главное правильно их готовить, употреблять в вареном или тушеном виде, не злоупотреблять жаркой.
Какие аминокислоты следует принимать

При выборе конкретных аминокислот, которые решено купить для спортивного питания, необходимо ориентироваться на цели, которые стоят перед спортсменом.
Для того чтобы похудеть,обратите внимание на лизин и метионин. Именно эти вещества помогают ускорить обменные процессы и расщепляют подкожные жиры. В соответствии с правильным питанием и необходимыми физическими нагрузками у каждого должно получится быстро похудеть.
Набирать мышечную массу необходимо в первую очередь с помощью длительных силовых тренировок. Дополнительным стимулирующим средством будут аминокислоты аспарагин и аргинин. Они помогут быстрее расти мышцам и стимулируют заживляющие процессы. С помощью данных веществ вырабатывается в теле также гормон роста.
Есть некоторые аминокислоты, которые помогают восстановить многие процессы в организме и способствуют омоложению. Это аргинин, метионин и тирозин, которые обеспечивают регенерацию клеток и восстанавливают организм после любых нагрузок.
Важно отметить, что аминокислоты помогают не только справиться со старением мышц, они предотвращают этот неприятный процесс во всем организме. В первую очередь это вывод шлаков, токсинов и других вредных веществ. Вторым моментом становится обновление клеток.
Женщинам приятно будет узнать, что с помощью данных аминокислот легко восстановить зубы, ногти и волосы, символы ухоженности и красоты. Также останавливаются дегенеративные процессы. Аминокислоты влияют и на усталость, энергия помогает выйти из депрессии и упадка сил.
Побочные эффекты от аминокислот
Аминокислоты и протеин приносят неоценимую пользу для организма. Заменимые и незаменимые полезные вещества помогают восстанавливаться и делать каждую тренировку наиболее результативной. Спорт и правильная диета в сочетании с этими веществами дарят удивительные результаты.
При рассмотрении побочных эффектов от аминокислот нужно внимательно разделять мифы и реальный вред. Естественно импотенция, нарушение гормонального фона, а также возможные отравления являются явным мифом. Можно не ориентироваться на эти характеристики.
Однако некоторые недостатки у аминокислот все же есть. Их нужно с осторожностью принимать тем, кто имеет любые хронические заболевания сердечно-сосудистой системы. Аккуратно нужно пить аминокислоты в том случае, если уже принимаются серьезные медикаменты.
Для того чтобы точно быть уверенным в безвредности аминокислот предварительно можно пройти обследование у врача и послушать его рекомендации. Однако, здоровый человек может смело принимать любые аминокислоты, главное соблюдать предписанные в инструкции дозировки.
Что такое аминокислоты, для чего нужны и как принимать аминокислоты
Пора выяснить что такое аминокислоты, для чего они нужны и как их правильно принимать.
Аминокислоты служат «строительным материалом» для белков, поскольку благодаря уникальной последовательности 21 вида данных органических соединений в организме образуются все типы белков и мышечные ткани. В плане химического строения, аминокислоты характеризуются наличием аминогруппы с атомом азота, которая является основой данного соединения.
Присутствие атома азота отличает аминокислоты от других питательных веществ, которые мы получаем из пищи (например, углеводов), вот почему это – единственные соединения, которые способны образовывать ткани, органы, мышцы, кожу и волосы.
Сейчас, когда люди слышат о белке, они автоматически думают лишь мышцах и бодибилдинге, хотя аминокислоты являются значимым компонентом диеты любого человека, но в особенности это важно для тех, кто занимается каким-либо видом спорта. Аминокислоты обычно делятся на 3 категории: незаменимые, полузаменимые и заменимые.
Содержание статьи
Незаменимые аминокислоты
Что подразумевается под словом «незаменимые»? «Незаменимые» означает, что эти аминокислоты не могут быть синтезированы в организме и должны поступать в него с пищей. Существует 9 незаменимых аминокислот, в числе которых знаменитая группа ВСАА.

Аминокислоты с разветвленными боковыми цепями (ВСАА)
Лейцин, изолейцин и валин
Из 9-ти незаменимых аминокислот 3 относятся к категории аминокислот с разветвленными цепями. Это лейцин, изолейцин и валин. ВСАА имеют уникальное химическое строение по сравнению с другими незаменимыми аминокислотами, и поэтому обладают особыми свойствами. В отличие от остальных аминокислот, ВСАА быстрее и лучше усваиваются организмом, то есть они абсорбируются не в желудке, а фактически поступают непосредственно в мышцы. Чтобы узнать больше о ВСАА, читайте нашу статью «ВСАА. Что такое аминокислоты с разветвленными цепями?».
Другие незаменимые аминокислоты
Остальные незаменимые аминокислоты: гистидин, метионин, фенилаланин, треонин, триптофан и лизин, – необходимы организму для выполнения ряда физиологических функций.
Гистидин
Гистидин – ароматическая аминокислота, которая выполняет ряд жизненно важных функций в организме, в том числе участвует в синтезе гемоглобина, функционировании иммунной системы и восстановлении тканей. Гистидин является важной аминокислотой в период роста человека, а также при реабилитации после болезни.
Лизин
Лизин играет важную роль в функционировании иммунной системы. Он также наряду с полузаменимыми кислотами участвует в синтезе коллагена, чтобы кожа, волосы и ногти оставались здоровыми.
Триптофан
Триптофан – это незаменимая ароматическая аминокислота, которая содержит ядро индола. Она выполняет ряд функций в организме, в частности играет роль химического посыльного в нервной системе. В отличие от других аминокислот, L-триптофан не растворяется в воде и устойчив к теплу, то есть в процессе обработки не теряет большую часть полезных свойств.
Метионин
Метионин – это аминокислота с неприятным запахом (содержит атом серы), которая является предшественником других аминокислот, таких как таурин. Ее антиоксидантные свойства способны защищать организм, подавляя в нем действие вредных веществ. Она также участвует в построении белков и выработке различных гормонов, в том числе адреналина и мелатонина.
Фенилаланин
Фенилаланин является неполярной аминокислотой, которая обладает бензильной боковой цепью и известна своими антидепрессантными свойствами. Она играет важную роль в выработке допамина и адреналина.
Треонин
Эта аминокислота является полярной незаряженной, и после усвоения преобразуется в пируват, играя важную роль в производстве глюкозы и выработке энергии АТФ.
Заменимые аминокислоты
Заменимыми аминокислотами называются те, которые могут быть синтезированы организмом. У вас может возникнуть следующий вопрос: «Если они вырабатываются в организме, тогда зачем мы должны принимать их дополнительно?». Дело в том, что во время физических упражнений, после того как энергия в виде углеводов исчерпана, организм начинает искать другие источники питания. Аминокислоты могут выступать в качестве такого источника, чтобы обеспечить мышцы всем необходимым для продолжения тренировки. Однако организм часто не способен достаточно быстро вырабатывать аминокислоты для удовлетворения возросших во время тренировки потребностей, потому мы должны потреблять их в большем количестве независимо от того, являются они заменимыми или нет.

Аланин
Аланин – одно из простейших органических соединений с точки зрения химической структуры, которое классифицируется как неполярная аминокислота. Аланин играет ключевую роль в глюкозо-аланиновом цикле между печенью и тканями организма. Проще говоря, он вступает в реакцию в тканях, чтобы образовать пируват, а затем глюкозу для использования ее в качестве источника энергии.
Глицин
Глицин – самая маленькая из всех аминокислот, которая связана с выработкой коллагена, а также пролина и лизина. Помимо этого она выступает в качестве нейромедиатора в спинном мозге, стволе головного мозга и сетчатке.
Аспарагиновая кислота
Эта аминокислота участвует в цикле мочевины в организме, а также в процессе, который называется глюконеогенезом (метаболический путь, приводящий к образованию глюкозы). Помимо этого аспарагиновая кислота действует как нейромедиатор, стимулирующий определенные рецепторы в нервной системе.
Аспарагин
Аспарагин необходим для нормальной работы нервной системы, а также он играет важную роль в синтезе аммиака.
Полузаменимые или условнозаменимые аминокислоты
Эти аминокислоты могут вырабатываться организмом в определенном количестве, однако в некоторых обстоятельствах этого количества недостаточно для нормального физиологического функционирования, например во время болезни или при интенсивных тренировках.

Серин
Серин – это протеиногенная аминокислота, которая выполняет ряд биологических функций в организме. Он играет важную роль в метаболизме, ферментативных реакциях и работе мозга.
Аргинин
Аргинин является прекурсором оксида азота. Он уменьшает время восстановления после травм, ускоряет заживление поврежденных тканей и способствует снижению и стабилизации артериального давления.
Тирозин
Тирозин – это протеиногенная аминокислота, которая играет важную роль в передаче сигналов в клетках.
Пролин
Эта аминокислота обладает исключительно жесткой структурой, которая используется для синтеза коллагена, необходимого для поддержания здоровья волос, кожи и ногтей.
Орнитин
Орнитин играет ключевую роль в биосинтезе мочевины, а также, как предполагается, предотвращает появление усталости во время тренировок. Цикл мочевины – это ряд биохимических процессов, в результате которых образуется мочевина для выведения аммиака из организма.
Глутамин
Глутамин является одной из самых популярных полузаменимых аминокислот среди спортсменов, которая участвует в регуляции кислотности в почках, создании клеточной энергии и стимулировании мышечного метаболизма.
Цистеин
Цистеин играет важную роль в ферментативных реакциях в организме. Считается, что он принимает участие в связывании металлов, а также является предшественником определенных антиоксидантов.
Польза и применение аминокислот
Теперь разберемся для чего нужны аминокислоты и для достижения каких целей они эффективны. Аминокислоты являются неотъемлемой частью нашего организма и тех процессов, которые в нем ежедневно происходят. Поддержание должного баланса аминокислот путем употребления добавок продемонстрировало большую пользу для организма от стимулирования мышечного роста до улучшения функций иммунной системы.
Мышечный анаболизм, снижение мышечной усталости и помощь в восстановлении мышц
Самая большая польза добавок с аминокислотами заключатся в их способности стимулировать мышечный анаболизм, восстанавливать мышцы и предотвращать появления мышечной усталости.
Лейцин, изолейцин, валин, аспарагин, аспарагиновая кислота и глутамин – это те 6 аминокислот, которые метаболизируются в мышцах в состоянии покоя. Они поддерживают многочисленные метаболические процессы, например, играют основополагающую роль субстратов для синтеза белка и образования энергии, а также являются предшественником глутамина и аланина.
В течение первых 10 минут физических упражнений в организме происходит реакция с участием фермента аланинаминотрансфераза с целью поддержания высокого уровня определенных аминокислот во время тренировки. Промежуточные соединения, которые образуются в результате этой реакции, могут вызывать появление усталости. Однако глутамин выполняет ряд функций в организме, которые позволяют использовать его в качестве источника питания, поэтому глутаминовые добавки способны повышать мышечную энергию и уровень мышечного метаболизма во время тренировок.

Эти полезные свойства добавок с аминокислотами делают их идеальными не только для бодибилдеров, но и для бегунов, спринтеров, а также для людей, ведущих активный образ жизни.
В 2000 году был проведен эксперимент с целью определить реакцию мышечного белка на прием аминокислот. Шесть мужчин и женщин употребляли напиток, содержащий 6 г незаменимых аминокислот или напиток-плацебо, спустя 1 час после тренировки. У тех, кто принимал аминокислоты, наблюдалось увеличение уровня фенилаланина, чего не происходило среди тех, кто принимал плацебо. Это увеличение вызывало анаболический отклик в мышцах, поэтому был сделан вывод о том, что аминокислоты стимулируют белковый анаболизм и синтез белка в мышцах.
Кроме того, в 2003 году в одном из научных обзоров было сказано, что увеличенная концентрация лейцина в организме способна стимулировать синтез мышечного белка при катаболическом состоянии, вызванном ограничениями в пище или утомительными тренировками.

Аминокислоты для похудения
Аминокислоты полезны не только для тех, кто хочет нарастить мышцы и улучшить их восстановление, но они также показаны как средство, способствующее избавлению от лишнего веса. В одном из исследований наблюдались 2 группы людей, желающих похудеть и изменить состав тела. Первая группа использовала диету с высоким содержанием аминокислот, а вторая – с низким.
Спустя 16 дней обнаружилось, что группа, принимавшая большее количество аминокислот, потеряла значительно больше жира и меньше мышечной массы, чем другая. В целом, данные свидетельствуют о том, что диета с повышенным содержанием белка и аминокислот и низким содержанием углеводов обеспечивает бо́льшую потерю жира, сохраняя при этом в организме белок.

Диабет
Сахарный диабет – это заболевание, при котором организм не в состоянии эффективно регулировать уровень сахара в крови и вырабатывать инсулин. Когда мы потребляем углеводы, уровень глюкозы в организме возрастает. При диабете организм не способен должным образом вырабатывать инсулин, чтобы вернуть уровень сахара в норму, в результате чего развивается гипергликемия. Аминокислоты положительно влияют на уровень сахара в крови. Например, аргинин является предшественником оксида азота, передающего вещества, которое оказывает прямое влияние на чувствительность к инсулину.

Воспаление и артрит
Еще одно полезное свойство аминокислот заключается в том, что они могут снижать активность воспалительных процессов в организме. В ходе одного исследования, проведенного в 1973 году, было доказано, что эфиры аминокислот и серосодержащие аминокислоты, в том числе цистеин и метионин, являются эффективными противовоспалительными агентами, которые способны уменьшать последствия отеков и анафилактического шока, и даже снижать воспаление и улучшать состояние при адъювант-индуцированном артрите.

Иммунная система
Хотя это может являться новостью для вас, но дефицит пищевого белка или аминокислот ослабляет функции иммунной системы и увеличивает восприимчивость к болезням. В частности, современные исследования показывают, что аргинин, глутамин и цистеин играют важную роль в работе иммунной системы. Например, эти аминокислоты участвуют в активации различных лимфоцитов, естественных клеток-киллеров и макрофагов, вмешиваются в редокс-регуляцию клеточных функций, экспрессию генов и пролиферацию лимфоцитов, а также влияют на выработку антител, цитокинов и других цитотоксичных субстанций. Сегодня ученые приходят к выводу, что добавки, содержащие определенный набор аминокислот, могут улучшить состояние иммунной системы и снизить уровень заболеваемости и смертности.
Рождаемость
Недавние исследования доказывают, что добавки с аминокислотами способны поднять уровень рождаемости. Например, в одном из таких исследований участвовали 132 мужчины с нарушениями фертильности. В течение 3 месяцев они принимали добавки с аминокислотами и микроэлементами. В качестве контрольной выступала группа из 73 мужчин с пониженной плодовитостью (субфертильностью), которые принимали плацебо. Все результаты исследования испытуемой группы показали значительное улучшение в области зачатия, по сравнению с контрольной группой. В течение 6 месяцев после завершения эксперимента в группе мужчин принимавших добавки было зафиксировано 34 случая зачатия.
Надеюсь, у вас больше не осталось вопросов зачем нужны аминокислоты, если есть, всегда можно задать вопрос в комментариях.
Добавки с аминокислотами
Если вы получаете все необходимые питательные вещества с пищей, то добавки могут вам не понадобиться. Однако стоит помнить о том, что во время тренировок потребность организма в аминокислотах повышается, поэтому если вы много тренируетесь и хотите нарастить мышцы или похудеть, то, скорее всего добавки будут вам необходимы. Вариантов аминокислот множество, зайдите в любой магазин, они могут быть в порошковой форме, в виде таблеток или капсул.
Аминокислоты в порошке
Аминокислоты в форме порошка выпускаются с различными вкусами, поэтому вы легко можете их добавлять в ваш любимый сок или воду.
Аминокислоты в таблетках
У вас нет ни минуты свободного времени и нужно срочно принять суточную дозу аминокислот? Добавки в форме таблеток идеально подходят для таких ситуаций.
Имейте ввиду, что роль аминокислот в спортивном питании очень велика, чем их больше, тем лучше. Нет смысла брать высокоуглеводистый гейнер, проще купить кило сахара и размешать его с протеином, выйдет дешевле.
Как принимать аминокислоты?

Добавки с аминокислотами лучше всего принимать утром, до тренировки, после тренировки и перед сном, чтобы снизить мышечную усталость и максимизировать мышечный анаболизм и восстановление.
Как правильно принимать аминокислоты того или иного вида, всегда указано на банке. Например, BCAA лучше всего принимать утром после пробуждения, до и после тренировки. Комплексные аминки употребляйте между основными приемами пищи, а также до и после тренировки. Для правильного потребления остальных видов, необходимо учитывать какие еще добавки вы потребляете.
Заключение
Надеемся, что статья оказалась для вас полезной, и вы ответили на вопрос, нужны ли вам добавки с аминокислотами. Они являются жизненно необходимыми во время тренировок, а также если вы не получаете аминокислоты в достаточном для организма количестве из пищи. Добавки с аминокислотами помогут вам предотвратить травмы и достичь своих целей в фитнесе.
Что Такое Аминокислоты? Свойства и Влияние на Организм
Амнокислоты – что это?
Аминокислоты – это особая структура, благодаря которой образуются белки в человеческом организме. Это те самые кирпичики из которых состоит белок. Именно белки играют одну из важных ролей во всех происходящих процессах организма. В человеческом теле практически все органы состоят из белков – это и мышцы, и различные соединительные ткани, внутренние органы, железы, ногти, волосы, кожа, кости и жидкости. Благодаря перевариванию и синтезу пищи получаются аминокислоты, из которых потом образуются белки. Опираясь на это, можно смело заявить, что именно аминокислоты являются самым важным элементом питания человека, а уже после идут белки.
Все аминокислоты делятся на 2 группы:
-
Заменимые, это те аминокислоты которые могут быть синтезированы в процессе метаболизма в организме из других аминокислот или питательных веществ.
-
Незаменимые аминокислоты это те, которые не могут самостоятельно синтезироватся в организме, поэтому должны поступать с пищей.
Основные незаменимые аминокислоты
| Аминокислота | Описание |
| Фенилаланин | Влияет на настроение, состояние и оттенок кожных покровов, работу печени и поджелудочной железы, регулирует чувство сытости. Он усиливает работу щитовидной железы, влияет на память и концентрацию. |
| Лейцин | Регулирует иммунитет и повышает энергию, стимулирует сжигание жира и уменьшает уровень сахара в крови. |
| Лизин | Является основой борьбы с вирусами и укрепляет иммунитет. Он способствует выработке коллагена, улучшает состояние волос. Большое влияние оказывает на либидо и предупреждает сердечно-сосудистые заболевания. |
| Валин | Обеспечивает энергией, снижает чувствительность к жаре, холоду и боли. Необходим для активного функционирования мозга и поддержания нужного уровня серотонина. |
| Треонин | Укрепляет связки и мышцы, делает зубы и кости более прочными, защищает печень от ожирения. |
| Триптофан | Активно борется с бессонницей, регулирует аппетит, улучшает эмоциональное состояние и расширяет сосуды. |
| Метионин | Прежде всего служит для синтеза аминокислот, отвечающих за вывод токсинов из организма и упрочнение тканей. |
| Гестидин | Участвует в выработке крови, требуется для здоровья суставов. |
| Изолейцин | Участвует в регулировании уровня сахара в крови, повышает выносливость. |
Продукты, в которых содержатся все девять незаменимых аминокислот называются завершенными белками. К таким источникам относятся мясо, рыба, домашняя птица, молочные продукты, яйца, а также соя, киноа и гречка. При недостатке аминокислот снижается вес, ослабевает иммунная система, у спортсменов повышается риск получения травм. Все девять получаемых из пищи аминокислот обязательно должны быть включены в ежедневный рацион. Они необходимы для синтеза белка, усвоения питательных веществ и восстановления тканей. В ряде случаев может потребоваться дополнительный прием аминокислот в виде таблеток и порошка.
Дополнительный прием аминокислот
В ряде случаев аминокислот из пищи не хватает организму, поэтому возможен прием дополнительного количество органических соединений в виде порошков или таблеток. При необходимости улучшить сон и настроение очень часто рекомендуют прием дополнительного количества триптофана. Он помогает в выработке серотонина, с недостатком которого напрямую связано депрессивное состояние и бессонница. Для увеличения спортивной эффективности, облегчения усталости и восстановления мышц чаще всего спортсмены также принимают дополнительное количество аминокислот. Прием дополнительного лейцина увеличивают силу даже не тренированных людей. Во время длительных болезней с постельным режимом особенно у пожилых людей наблюдается потеря мышечной массы. Для ее сохранения им тоже необходим прием дополнительных аминокислот. И-за способности некоторых незаменимых аминокислот стимулируют снижение жировой массы тела, их активно используют при похудении.
В большинстве случаев аминокислоты для мышц выполняют следующие функции:
-
Образование необходимого количества белка, который участвует во многих процессах организма. Кроме того, он входит в глубокие ткани и нужен для правильной работы внутренних органов.
-
Также элементы являются важнейшей частью нейромедиаторов, а еще зачастую выступают в их роли. Во время передачи нервных импульсов из клетки в клетку, эффективнее начинает работать головной мозг, которому и требуется питание.
-
Правильно подобранные аминокислоты в спорте способствуют рациональному распределению витаминов и минералов. Благодаря эффективной работе компонентов обеспечивается хорошее усвоение необходимых для организма элементов.
Белок сам по себе синтезируется исключительно из аминокислоты, польза и вред которой доказаны научно. Можно смело утверждать, что именно эти элементы являются ключевым решением для правильного питания и несут большую ценность. Чтобы ответить на вопрос о том, в чем содержаться аминокислоты, необходимо прочитать немало литературы, однако наибольшее их количество можно встретить в протеине. Регулярное применение спортивного питания позволяет не только восполнить дефицит необходимых микроэлементов, но и существенно увеличить уровень выносливости во время тренировок.

Следует также отметить, что некоторые виды аминокислот являются полезными для выработки энергии мышц. Большинство таких компонентов соединяются с тканями печени, поэтому для нормального функционирования всех систем необходимо постоянно восполнять недостаток. Существуют аминокислоты в бодибилдинге, которые не поддаются синтезу, поэтому человеку следует применять их вместе с едой. В нашем организме постоянно синтезируется большое количество белков, но они тоже иногда нуждаются в помощи. Грамотный подход к данному вопросу позволяет добиться совершенно новых результатов за счет правильного и качественного рациона.
Аминокислоты и спорт питание. Что следует использовать?
Если вы сомневаетесь и не знаете, какую добавку лучше выбрать – опытные профессионалы рекомендуют отдавать предпочтение решениям, которые включают в себя высокий уровень L кристаллов. Практически все аминокислоты, отзывы о которых вы сможете найти в интернете, разделяются на два химических типа – форму D и L, однако только второй тип считается лучшим выбором для людей, которые хотят улучшить свой метаболизм. Также существуют свободные виды, которые отличаются от других чистотой состава. Благодаря подобным свойствам, аминокислоты, вред которых для организма минимален, не нуждаются в дополнительной обработке. Купить аминокислоты для спортивных людей вы всегда сможете на нашем сайте. Мы реализуем исключительно проверенный и сертифицированный продукт, что подтверждается на документальной основе. Однако перед тем, как сделать заказ, настоятельно рекомендуется получить консультацию спортивного врача.

 N+H3 —CH2COO–
N+H3 —CH2COO– N+H3 —CH2COO–
N+H3 —CH2COO–