Вода уксусная кислота: Вода и уксусная кислота: сходства и различия – Уксусная кислота — Википедия
Вода и уксусная кислота: сходства и различия
Со школьной скамьи мы помним задания на уроках химии — сравнить свойства разных веществ: кристаллов, жидкостей и т.д. Сегодня мы совершим путешествие во времени. Вернемся назад в школу и проведем сравнительный анализ обыкновенной воды и уксусной кислоты. С этими жидкостями мы сталкиваемся не так уж и редко. Особенно с водой. Что касается уксуса, то в хозяйстве всегда должна быть бутылка этого вещества. Попробуем сравнить их…

Для начала уточним терминологию
Как мы знаем из курса химии, характеристики того или иного вещества зависят не только от химического состава. Большую роль играют концентрация элементов и наличие примесей. Например, уксусная кислота неоднородна по составу: бывает столовый уксус 3,6 и 9%, уксусная эссенция и т.д. Эти вещества хоть и относятся к одному химическому классу, но имеют существенные различия.
Рассмотрим подробнее:
- Уксусная кислота — это продукт окисления этилового спирта или же перегонки биологического сырья. К такому сырью относят переспелые фрукты, забродившие соки и вина. 100% уксус относится к категории слабых кислот, хорошо смешивается с водой, спиртом, бензолом и эфиром. При смешивании с Н2О получают уксусную эссенцию с концентрацией 70-80%.
- Столовый уксус — этот незаменимый в кулинарии и быту продукт получают разбавлением уксусной эссенции. Если исходное вещество имеет концентрацию 70-80%, то столовый уксус, обильно заправленный водой — всего 3, 6 или 9%. Получить из эссенции столовый уксус несложно. Достаточно правильно рассчитать объемы жидкостей.
Мы определили, что уксус имеет различную концентрацию, которая и определяет свойства, назначение и название раствора. Приступим к сравнению воды и уксусной кислоты.
Что важно при сравнительном анализе жидкостей?
В лаборатории, как правило, изучают физические и химические показатели веществ.
В первом случае определяют:
- Оптические характеристики — мутность/прозрачность, поглощение световых лучей.
- Вкус, запах.
- Температуру газообразование или плавления.
- Теплопроводность и теплоемкость.
- Плотность.
- Электропроводимость и другие свойства.
Химические показатели — это способность вещества вступать в реакции с другими химическими соединениями.
Итак, вода и уксусная кислота — прозрачные субстанции, которые при небольших объемах не имеют цвета. Температура кипения воды и уксуса примерно равные: вода — 100 градусов, а уксусная кислота — 118 градусов Цельсия. Уксус несколько плотнее воды, примерно на 1,05 кг/м3.
Физические отличия воды и уксуса:
- Чистая вода не обладает вкусом и запахом, тогда как уксусная кислота имеет характерный кисловатый привкус и резкий запах.
- Поверхностное натяжение воды выше в 3 раза и составляет 72,86 мН/м против 27,8 мН/м уксуса.
- При охлаждении вода превращается в кристаллы, а уксус в льдистую массу.
- Теплоемкость воды также выше в 2 раза — 4,1 Дж/г·K против 2,01 Дж/г·K уксуса.
Кроме того, различия уксуса и воды вызваны и химическими свойствами. В частности кислота имеет куда более сложную формулу — Ch4COOH и представляет собой органическое вещество. Вода же — это неорганика и её формула проста — Н2О.
Общие химические показатели:
- Вода и уксус взаимодействуют с активными металлами — натрием, кальцием, калием и другими. Результат реакции — водород.
- Взаимодействуют с хлором и щелочными оксидами.
Отличительные характеристики:
- Вода имеет рН около 7, тогда как уксус — это кислота с рН равным 3.
- Вода — растворитель, тогда как уксус — окислитель.
- Н2О реагирует с солями слабых кислот — гидролиз, а уксус нет.
- Вода разлагается на молекулярные составляющие под воздействием электротока и высоких температур. Подобная реакция для уксусной кислоты потребует больших затрат энергии и наличие вещества-катализатора.
Уважаемые читатели!
Спасибо, что читаете наш блог! Получайте самые интересные публикации раз в месяц оформив подписку. Новым читателям предлагаем попробовать нашу воду бесплатно, при первом заказе выберите 12 бутылок (2 упаковки) минеральной воды BioVita или питьевой воды Stelmas. Операторы свяжутся с Вами и уточнят детали. Тел. 8 (800) 100-15-15
* Акция для Москвы, МО, Санкт-петербурга, ЛО
Спасибо за подписку на нашу рассылку
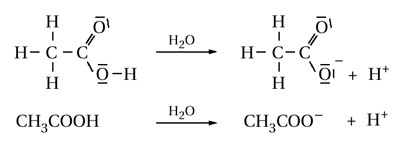
Ch4COOH + h3O = ? уравнение реакции
Уксусная (этановая) кислота представляет собой бесцветную жидкость, обладающую резким раздражающим запахом. При попадании на слизистые оболочки она вызывает ожоги. Уксусная кислота смешивается с водой в любых соотношениях. Образует азеотропные смеси с бензолом и бутилацетатом.
Уксусная кислота замерзает при , её кристаллы по внешнему виду напоминают лед, поэтому 100%-ную уксусную кислоту называют «ледяной».
Уксусная кислота – это слабая одноосновная кислота. В водном растворе (Ch4COOH + h3O = ?) она диссоциирует на ионы:
Уксусная кислота обладает слабыми кислотными свойствами, которые связаны со способностью атома водорода карбоксильной группы отщепляться в виде протона.
Взаимодействие уксусной кислоты со спиртами протекает по механизму нуклеофильного замещения. В качестве нуклеофила выступает молекула спирта, атакующая атом углерода карбоксильной группы уксусной кислоты, несущий частично положительный заряд. Отличительной особенностью этой реакции (этерификации) является то, что замещение протекает у атома углерода, находящегося в состоянии -гибридизации:
При взаимодействии с тионилхлоридом уксусная кислота способна образовывать галогенангидриды:
При действии на уксусную кислоту оксида фосфора (V) образуется ангидрид:
Взаимодействии уксусной кислоты с аммиаком получаются амиды. Вначале образуются аммониевые соли, которые при нагревании теряют воду и превращаются в амиды:
Смеси уксусная кислота—вода – Справочник химика 21
Является крайне сомнительным, оправдывается ли использование действительной диаграммы энтальпия—концентрация хотя бы для какого-нибудь из немногих специальных случаев. Например, даже в случае смесей уксусная кислота — вода, когда разность скрытых теплот является необычно большой, различие при использовании диаграммы энтальпия — концентрация с прямыми и при использовании уравнения (182) получается незначительным и лежит в пределах точности, требующейся для большинства тепловых расчетов. Это показывает следующий пример.У многих смесей жидкостей, не соответствующих приведенному выше определению идеальной смеси, наблюдаются гораздо боль-щие отклонения от прямолинейной зависимости, которые могут быть и положительными, и отрицательными (рис. УИ1-23). На кривой зависимости вязкости от состава смеси в случае смеси этанол — фенетол (кривая /) наблюдается минимум, а в случае смеси уксусная кислота — вода (кривая 2) имеет место максимум. [c.320]
Величина Ф зависит от температуры и давления, а в многокомпонентной смеси еще и от всех мольных долей паровой фазы, а не только от Коэффициент фугитивности по определению нормализуется таким образом, что в то время как О, значение -> 1 для всех Поэтому при низких давлениях хорошим приближением является Ф/ = 1. Но вот какое давление считать за низкое , это уже зависит от состава и температуры смеси. Для типичной смеси неполярных (или слабо полярных) веществ при температуре, близкой к нормальной точке кипения наименее летучего компонента (или выше нее), низким считается давление меньше нескольких атмосфер. Однако для смесей, содержащих сильно ассоциирующую карбоксильную кислоту, например для смеси уксусная кислота — вода /при 25 °С, коэффициенты фугитивности могут существенно отличаться от единицы при давлениях, много меньших чем 1 атм Для смесей, содержащих один компонент с очень низкой летучестью и другой с высокой, например декан метан при 25 °С, коэффициент фугитивности легкого компонента может быть близким к единице при давлениях вплоть до 10 или 20 атм, тогда как при том же давлении коэффициент фугитивности тяжелого компонента будет много больше единицы. Под-робный анализ этого вопроса дан в гл. 5 работы [66].
[c.267]На диаграмме температур кипения смесей уксусная кислота — вода (М., стр. 72, рис. 8) определить состав парообразной фазы над жидкостью, содержащей 80 мол.% уксусной кислоты при 110°С.
Условия титрования. Титрование проводят в среде уксусной кислоты или смеси уксусная кислота — вода, иногда используют в качестве катализатора ацетаты щелочных металлов. [c.309]
Образующаяся при синтезе пероксида вода снижает кислотность реакционной среды — уксусной кислоты. Преобразование уравнений, связывающих кислотность (Ло) растворов НСЮ4 в смеси уксусная кислота — вода, приводит к следующей зависимости отношения начальной [ГПК]о и текущей [ГПК], концентраций гидропероксида в реакционной среде от времени по ходу реакции с учетом образующейся воды, которая снижает индикаторную функцию кислотности [c.306]
Карбаматы гидролизовали до соответствующих фенолов, опрыскивая слой 5 %-ным раствором гидроксида калия [49]. Маркус и Ма [50] проводили гидролиз эфиров флавона следующим образом опрыскивали пластинку 2 н. раствором гидроксида натрия, выдерживали ее 45 мин при комнатной температуре, нагревали 5 мин при 110°С и затем опрыскивали смесью уксусная кислота—вода (1 1). Если нужно было гидролизовать сложные эфиры, каплю исследуемой смеси смешивали с каплей раствора гидроксида калия в этиленгликоле (6 г на 100 мл) в маленькой пробирке [51] и нагревали до появления кольца конденсата на холодной части пробирки. Конденсат стряхивали в реакционную смесь центрифугированием и наносили смесь на хроматографическую пластинку. Касс и Матис [9] омыляли алкалоиды, нагревая их в капилляре при 100°С в течение часа с 0,1 и. спиртовым раствором гидроксида калия. [c.203]
Реактив, а) 0,5 %-ный раствор дикобальтоктакарбонила в петролейном эфире (т. кип. 120—135°С) б) 0,5 %-ный раствор а-нитрозо-р-нафтола в смеси уксусная кислота—вода (1 1). [c.241]
Определение тиоацеталей. Готье и Мэйяр предложили следующий метод определения тиоацеталей. Образец растворяют в смеси уксусной кислоты, воды и соляной кислоты. Раствор нагревают до 30—40 °С и титруют 0,1 н. раствором смеси бромида и бромата калия до появления желтой окраски. Интересно отметить, что окисление останавливается на стадии образования дисульфида [c.308]
Воган и сотрудники [5] синтезировали 4-метил-2-(4-нитрофенил)-фталазинон-1 (2H)-[3-N ] из сернокислой соли 4-.метил-3-(4-нитрофенил)-фталазинона-1 (2H)-[3-N ] реакцией перегруппировки Рау, пользуясь вариантом методики этого автора [6]. Вместо соляной кислоты, которой пользовался Рау [6], применяли серную кислоту (36 мл 1,2 н. кислоты на каждые 2,5 г фта-лазона). При нагревании растворов в течение 9 час. в запаянных ампулах при 180° выходы 2-(4-нитрофенил)-4-метилфталазино-на-1(2Н) составляли 50—60% после перекристаллизации из смеси уксусная кислота —вода, т. пл. 215—216,5°. [c.264]
Разделение проводили на оксиде алюминия смесью ентав — эфир (9 1). Справа приведена хроматограмма акридиновой фракции (фракция I, разделяли на целлюлозе смесью уксусная кислота — вода 3 7). Обозначения цветов см. рис. 5.13. [c.218]
Полимер-носитель трижды промывают трифторуксусной кислотой (каждый раз берут по 10 мл СРзСООН на 1 г полимера), следя за тем, чтобы трифторуксусная кислота при каждой промывке пропитывала и экстрагировала полимер в течение 1 мин, затем раствор пептида упаривают досуха при пониженном давлении без нагревания. Пеп
Уксусная кислота: свойства и все характеристики
Характеристики и физические свойства уксусной кислоты
При попадании на слизистые оболочки она вызывает ожоги. Уксусная кислота смешивается с водой в любых соотношениях. Образует азеотропные смеси с бензолом и бутилацетатом.
Уксусная кислота замерзает при 16oС, её кристаллы по внешнему виду напоминают лед, поэтому 100%-ную уксусную кислоту называют «ледяной».
Некоторые физические свойства уксусной кислоты приведены в таблице ниже:
|
Температура плавления, oС |
17 |
|
Температура кипения, oС |
118 |
|
рКа |
4,76 |
|
Плотность, г/см3 |
1,0492 |
Получение уксусной кислоты
В промышленности уксусную кислоту получают каталитическим окислением н-бутана кислородом воздуха:
CH3-CH2-CH2-CH3+ [O2] = 2CH3-COOH.
Значительные количества уксусной кислоты производят путем окисления ацетальдегида, который в свою очередь получают окислением этилена кислородом воздуха на палладиевом катализаторе:
CH2=CH2 + [O2] = CH3-COH + [O2] =CH3-COOH.
Пищевую уксусную кислоту получают при микробиологическом окислении этанола (уксуснокислое брожение).
При окислении бутена-2 перманганатом калия в кислой среде или хромовой смесью происходит полный разрыв двойной связи с образованием двух молекул уксусной кислоты:
CH3-CH=CH-CH3 + [O2] = 2CH3-COOH.
Химические свойства уксусной кислоты
Уксусная кислота – это слабая одноосновная кислота. В водном растворе она диссоциирует на ионы:
CH3COOH↔H+ + CH3COOH.
Уксусная кислота обладает слабыми кислотными свойствами, которые связаны со способностью атома водорода карбоксильной группы отщепляться в виде протона.
CH2COOH + NaOH = CH3COONa + H2O.
Взаимодействие уксусной кислоты со спиртами протекает по механизму нуклеофильного замещения. В качестве нуклеофила выступает молекула спирта, атакующая атом углерода карбоксильной группы уксусной кислоты, несущий частично положительный заряд. Отличительной особенностью этой реакции (этерификации) является то, что замещение протекает у атома углерода, находящегося в состоянии sp3-гибридизации:
CH3-COOH + CH3OH = CH3O-C(O)-CH3 + H2O.
При взаимодействиистионилхлоридом уксусная кислота способна образовывать галогенангидриды:
CH3-COOH + SOCl2 = CH3-C(O)Cl + SO2↑ + HCl↑.
При действии на уксусную кислоту оксида фосфора (V) образуется ангидрид:
2CH3-COOH + P2O5 = CH3-C(O)-O-C(O)-CH3 + 2HPO3.
Взаимодействии уксусной кислоты с аммиаком получаются амиды. Вначале образуются аммониевые соли, которые при нагревании теряют воду и превращаются в амиды:
CH3-COOH + NH3↔CH3-COO—NH4+↔CH3-C(O)-NH2 + H2O.
Применение уксусной кислоты
Уксусная кислота известна с глубокой древности, её 3 – 6% растворы (столовый уксус) используют как вкусовую приправу и консервант. Консервирующее действие уксусной кислоты связано с тем, что создаваемая ею кислая среда подавляет развитие гнилостных бактерий и плесневых грибков.
Примеры решения задач
Уксусная кислота | Снабжение365
Синонимы: этановая кислота, метанкарбоновая кислота
Уксусная кислота является одной из самых важных органических кислот.
История уксуса
Уксус является продуктом, который известен человечеству уже более 7000лет.
Гиппократ описывал его использование в качестве внутреннего и наружного средства.
Уксус являлся важным консервантом и пряностью. В древних писаниях он упоминается как безалкогольный напиток для путешествий, охоты и работы.
В течение многих веков раствор уксусной кислоты использовался в качестве дезинфицирующего средства. Например, во время смертельных эпидемий чумы им пропитывались защитные маски.
Получение уксуса в древности, вероятно явилось следствием случайного открытия при ферментации виноградного сока в вино.
При алкогольной ферментации дрожжи превращают сахар в этанол и углекислый газ. При этом емкости для брожения должны быть надежно защищены от попадания воздуха. Иначе бактерии уксусной кислоты, в присутствии кислорода, могут ферментативно окислить этанол до уксусной кислоты, и вино приобретет кислый вкус.
Однако, при природном (естественном) ферментативном окислении можно получить максимальную концентрацию не более 15% уксусной кислоты, поскольку ферменты неэффективны при более высоких концентрациях. Они практически убивают сами себя.
Существует много разных сортов уксуса, которые отличаются не только концентрацией, но и вкусом. Однако, основным компонентом у них всегда будет вода и уксусная кислота (этановая кислота).
Структура и свойства уксусной кислоты
Это органическая кислота (карбоновая кислота), молекулы которой имеют два атома углерода, связанных друг с другом простой связью.
Функциональная группа, как и все другие карбоновые кислоты, представляет собой карбоксильную группу – COOH.
Физические свойства
- Молярная масса: 60,1 г/моль;
- Плотность: 1,044 г/куб.см;
- Температура плавления: 16,7 С;
- Температура кипения: 117,9 С.
Когда уксусная кислота растворяется в воде, примерно каждая сотая молекула уксусной кислоты диссоциирует с образованием ацетат-иона.
Уксусная кислота имеет относительно высокую температуру кипения (118 С) по сравнению с полярными веществами со сравнимой молярной массой (например, 1-пропанол закипает при температуре 97 С). Причиной этого является способность молекул уксусной кислоты образовывать две «взаимные» водородные связи через свои карбоксильные группы. Полученные димеры возникают из двух молекул уксусной кислоты, которые ведут себя как молекулы с двойной молярной массой. Следовательно, для переноса этих димеров в газовую фазу требуется большее количество энергии, что и характеризуется «повышенной» температурой кипения.
Химические свойства
Этановая кислота – едкая, бесцветная, прозрачная, очень гигроскопичная (влагопоглощающая) жидкость.
Безводную уксусную кислоту называют ледяной уксусной кислотой. Название происходит от того, что чистая уксусная кислота затвердевает до ледяных кристаллов уже при 16,7 C.
Этановая кислота смешивается с водой, эфиром, хлороформом, этанолом и другими спиртами в любом соотношении.
Уксусная кислота является слабой кислотой. Это означает, что она не полностью реагирует с водой, образуя ацетат-ионы и ионы водорода.
Благодаря полученным свободно подвижным ионам раствор этановой кислоты является электропроводящим.
Уравнение реакции по Аррениусу:
Уравнение реакции по Бренстеду-Лоури:
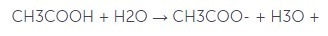
Уксусная кислота полностью окисляется на воздухе с конвекцией тепла в воду и углекислый газ.
Обычные металлы, такие как магний, кальций, цинк или железо, растворяются в разбавленной уксусной кислоте с образованием водорастворимых ацетатов и выделением водорода.
Реакции
Уксусная кислота образует соли (ацетаты).
Например, свинец образует токсичный, сладкий на вкус ацетат свинца (свинцовый сахар). В древние времена римляне использовали свинцовые сосуды в качестве кухонной утвари, а на керамические изделия наносили свинцовую глазурь. Кислая пища или напитки способны растворять свинец. На основании археологических исследований можно говорить о том, что хроническое отравление свинцом в то время было, по-видимому, очень распространенным явлением.
Соли неорганических кислот реагируют с карбонатами и другими солями.
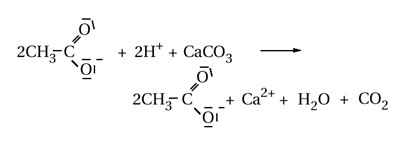
Типичная реакция уксусной кислоты – образование эфира.
Производство
Классическим производством уксусной кислоты является процесс ферментации, при котором бактерии Acetobacter превращают этанол (спирт) в уксусную кислоту (уксуснокислое брожение). Исходными продуктами могут выступать вино, пиво или солод.
Бытовой уксус состоит из ферментативного уксуса или разбавленного синтетического уксуса с содержанием 5-10% уксусной кислоты.
Промышленное производство
Наиболее важным промышленным синтезом уксусной кислоты является каталитическая конверсия метанола с монооксидом углерода под давлением (процесс Монсанто).
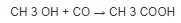
Помимо этого, уксусную кислоту также можно получить путем окисления ацетальдегида воздухом или кислородом с использованием ацетата марганца в качестве катализатора или путем частичного окисления других углеводородов.
Помимо этого, этановую кислоту также можно получить другими способами.
1. При каталитическом окислении в бутане с атмосферным кислородом образуется уксусная кислота в смеси с многочисленными другими полезными органическими соединениями (включая муравьиную кислоту).
2. Реакция этина (ацетилена) с этаналом (ацетальдегид) использовалась, начиная с 1914 года.
В результате получался сырой уксус (технический уксус) с концентрацией до 95%.
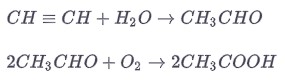
3. Возможно извлечь этановую кислоту из метанола и окиси углерода.
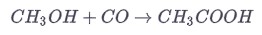
Приготовленная таким образом уксусная кислота в основном используется для приготовления различных сложных эфиров этановой кислоты, которые из-за своего фруктового запаха используются в парфюмерии.
Использование
Только около 3% производимой во всем мире уксусной кислоты используется в качестве пищевого уксуса (5% содержание уксусной кислоты) или уксусной эссенции (25%).
Большая часть уксусной кислоты превращается в винилацетат, из которого получают поливинилацетат. Он используется в качестве связующего для красок и лаков, в бумажной и текстильной промышленности, а также в качестве растворителя для клеев.
Другая значительная часть уксусной кислоты превращается в уксусный ангидрид. Он может быть получен путем взаимодействия с ацетатом целлюлозы (ацетилцеллюлоза), который затем перерабатывается в текстильные волокна («искусственный шелк»), оправы для очков, сигаретные фильтры и другие.
Около 5-10% мирового производства уксусной кислоты используется в качестве растворителя при производстве терефталевой кислоты, которая затем перерабатывается в полиэтилентерефталат.
Соли уксусной кислоты используются в качестве пищевого консерванта. Это ацетат натрия (E 262), ацетат калия (E 261) и ацетат кальция (E 263).
Сама уксусная кислота используется в качестве подкислителя для пищевых продуктов (E 260).
В быту уксусная кислота может использоваться для удаления известкового налета:
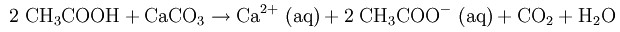
А при стирке белья небольшое количество уксуса является дешевой и экологически чистой заменой кондиционера для белья.
Воздействие на организм человека
Концентрированная уксусная кислота оказывает сильное коррозионное воздействие на глаза, кожу и слизистые оболочки.
Порог чувствительности к запаху очень низкий – от 1 до 5 частей на миллион. Что обычно предотвращает вдыхание опасных для человека концентраций этой кислоты.
Длительное вдыхание 100 ppm может вызвать отек легких.
Следует отметить, что попадание даже пищевого уксуса в глаза может вызвать повреждение глаз. При попадании, следует незамедлительно промыть глаза большим количеством воды.
Техника безопасности при работе с уксусной кислотой
При работе с концентрированной уксусной кислотой требуются защитные очки и перчатки. Если в помещении не используются принудительные системы кондиционирования, то работы должна выполняться в вытяжном шкафу.
Концентрированная чистая уксусная кислота (ледяная) – это легковоспламеняющаяся гигроскопическая жидкость, которая легко испаряется. С воздухом пары могут образовывать взрывоопасную смесь!
Купить уксусную кислоту
что это такое и из чего делают, особенности применения и химические, а также пищевые свойства, раствор
Уксусная кислота – вещество, относящееся к органическим соединениям и группе карбоновых. Представлена в виде бесцветной жидкости с наличием резкого специфического запаха. Хорошо растворяется в воде. В кислоте отсутствуют инородные примеси. Используют в медицине, косметологии, промышленности.
Содержание статьи
Что такое уксусная кислота
Вещество получают биогенным или синтетическим путем.
Формула
Органическое соединение имеет свою химическую формулу – CH3COOH. На его основе получают другие вещества – производные уксусной кислоты, имеющие название «ацетаты».

Из чего и как получают уксусную кислоту
Возможен биогенный способ производства вещества. Источник – бактериальные закваски. Однако существует и синтетический метод приготовления органического соединения – выделение реагента из нефтепродуктов или древесины. Из таковых производится ацетилен, при переработке образующий уксусный альдегид, который впоследствии подвергают окислению.
Метод химического производства разработан известным ученым Михаилом Кучеровым, который предложил способ получения вещества из альдегида. Доказано, что органическое соединение образуется в природе, а ацетилен нет. Однако больше выгоды возникает при добыче кислоты из последнего, чем ее выделение из окружающей среды.
Концентрация
Исходя из объема содержания органического соединения, различают уксусную кислоту, эссенцию и чистый уксус. При смешивании кислоты с водой до образования 70-80%-го раствора можно получить эссенцию, до 3-6% – уксус. Вещество в чистом виде, без взаимодействия с иной жидкостью, именуют кислотой.
Важно! В пищевой промышленности, медицине, быту и с другими целями используют именно растворы соединения.
Химические свойства
Для вещества характерны свойства, которыми обладают карбоновые кислоты. Например, при распаде органического соединения образуются протон H+ и ацетат-ион Ch4COO−.
Уксусная кислота – это слабое одноосновное соединение (pKa). Водное значение (рН) раствора с концентрацией 1.0 М (что приблизительно характерно для пищевого уксуса – яблочного, столового и др.) – 2,4. Степень распада – 0,4%.
Возможно реагирование органического соединения с активными металлами. В таком случае образуется водород и соли (ацетаты). Хлорирование кислоты происходит под действием газообразного хлора, что обуславливает образование хлоруксусной кислоты.
Восстановление вещества до этанола возможно под действием алюмогидрида лития. Превращение органического соединения в хлорангидрид происходит при контакте с тионилхлоридом. Метан образуется в результате нагревания натриевой соли со щелочью.
Влияние уксусной кислоты на организм человека
Органическое соединение используют в различных отраслях, в том числе в лечебных целях. Однако помимо пользы оно может нанести вред организму, если пренебрегать правилами применения.
Польза
Применение в кулинарии слабого раствора возможно в процессе приготовления блюд. Это позволяет легче усваиваться пище в желудочно-кишечном тракте, так как уксус ускоряет расщепление белков, содержащихся в продуктах. Раствор способствует размягчению волокон пищи, делает ее нежной и улучшает вкусовые качества. Используют в процессе консервации, при мариновании мяса, для добавления в салаты и холодные закуски.
Уксус способствует выведению токсических веществ и шлаков из организма, очищая его. Полезно добавление в блюда за счет способности жидкости подавлять аппетит. Это важно для лиц, имеющих лишний вес и ожирение. Внутрь рекомендуется употреблять только натуральное средство, предварительно разведенное с водой. Это может быть яблочный, винный, бальзамический уксус.
Раствор задействуют не только в приготовлении блюд и для приема внутрь. Полезно обертывание, которое ускоряет обменные процессы, повышает упругость и эластичность кожного покрова. Поэтому такую методику применяют при наличии целлюлита.
За счет полезного состава яблочного уксуса, который также содержит кислоту, его принимают внутрь для снижения интенсивности симптомов мигрени, при алкогольной интоксикации. Средство способствует ликвидации патогенных микроорганизмов, поэтому его рекомендуется принимать при желудочно-кишечном расстройстве.
Совет! Уксус – незаменимый состав для снижения повышенной температуры тела. Даже грудничкам разрешается проводить обтирание туловища, которое быстро снимает жар.
Вред
Сильную опасность для организма представляет нерастворимая жидкость. Также может нанести вред средство с концентрацией органического соединения в 30% и более. Если высококонцентрированное вещество попало на слизистую оболочку или кожный покров, возникает химический ожог.

Негативные последствия возникают в случае пренебрежения противопоказаниями. Ограничения к приему:
- язвенная болезнь желудка и 12-перстной кишки;
- гастрит, повышенная кислотность среды;
- возраст до 6 лет.
Уксус способствует увеличению кислотности органов желудочно-кишечного тракта, поэтому ее противопоказано принимать внутрь при соответствующих заболеваниях (панкреатите и др.).
Вещество оказывает мочегонное действие. В связи с этим его нельзя употреблять лицам, страдающим циститом и патологиями, протекающими с учащением позывов к мочеиспусканию. Противопоказано использование уксусной кислоты при нарушении функционирования печени.
Органическое соединение разрушает ткани десен и зубную эмаль. Поэтому после приема средств с его добавлением рекомендуется прополоскать ротовую полость. Для снижения нагрузки на структуры рта при употреблении растворов с присутствием кислоты можно использовать трубочку.
Чем опасна передозировка
Если систематически превышать рекомендуемую дозировку, разрушается и сворачивается белок в организме, возникают участки с некротическими изменениями тканей желудочно-кишечного тракта. После всасывания уксусной кислоты в кровоток и его окисления начинают видоизменяться эритроцитарные клетки. В итоге в кровь свободно выбрасывается гемоглобин, провоцирующий сбои в работе почек и печени, в том числе недостаточность органов.
Важно! За счет сильного химического ожога слизистых оболочек пищевода и других внутренних органов возможет летальный исход.
Особенности применения уксусной кислоты
Для снижения риска возникновения негативных последствий нужно изучить правила использования. В первую очередь – это соблюдение рекомендуемой дозировки средства. Для детей, взрослых и лиц пожилого возраста суточный объем варьируется. Поэтому перед применением составов внутрь нужно проконсультироваться с врачом.
В народной медицине
Приготовление средств на основе уксусной кислоты отличается в зависимости от цели применения:
- в лечении гинекологических патологий, бессонницы и головной боли: взять 1 ст.л. 5%-го уксуса, развести в 1 л воды, делать спринцевание влагалища разово в день или принимать внутрь по 1 ст.л. трижды в день;
 для устранения неприятного запаха изо рта при заболеваниях желудочно-кишечного тракта: взять 2 капли 70%-й уксусной кислоты, смешать с 200 мл настоя мяты, проводить полоскания ротовой полости после очищения зубов пастой;
для устранения неприятного запаха изо рта при заболеваниях желудочно-кишечного тракта: взять 2 капли 70%-й уксусной кислоты, смешать с 200 мл настоя мяты, проводить полоскания ротовой полости после очищения зубов пастой;- в лечении геморроидальных узлов и варикозной болезни: взять по 60 г кардамона, мальвового листа, плодов шиповника, тимьяна, 9%-ый уксус в объеме 100 мл и 300 мл воды, смешать, настоять в течение недели, делать аппликации на больную зону перед сном, выдерживая до утра;
- при ожогах кожного покрова и после укуса насекомого: развести в воде 9%-ый уксус в соотношении 2:1, смазывать полученным составом пораженные участки несколько раз в день;
- в терапии заболеваний суставов: взять 70%-ую кислоту (50 мл), скипидар и растительное масло по 1 ст.л., 1 куриное яйцо, воду в объеме 300 мл, смешать, наносить под компресс на больные области на ночь;
При атеросклерозе делают следующий состав: смешать лимонный, чесночный сок по 1 ст.л., добавить 50 мл 6%-го яблочного уксуса и 500 г меда, употреблять внутрь по 1 ст.л., предварительно растворяя в 200 мл теплой воды (трижды в день).
В косметологии
Для придания блеска и здоровья волосам рекомендуется проводить ополаскивания уксусом. После такой процедуры расчесывание проходит легко, локоны не путаются.
Уксус добавляют в косметические средства, в частности, в кремы. Это обеспечивает антивозрастной уход за кожей лица, оказывает омолаживающее действие. Нормализуется деятельность сальных желез, устраняется блеск, разглаживаются морщины.
В промышленности
Уксусная кислота – это растворитель, поэтому ее используют в производстве ацетона, различных искусственных пигментов, негорючих пленок, а также в книгопечатании, крашении.
Совет! В сельскохозяйственной деятельности кислота эффективно помогает избавиться от агрессивных сорняков.
Другое
В пищевой промышленности органическое соединение – это консервант, натуральная добавка к пище, регулирующая кислотный баланс продуктов. Его используют в процессе приготовления майонеза и кондитерских изделий.
В бытовых условиях кислоту применяют для удаления накипи из посуды, сантехники, бытовой техники, пятен на одежде, домашнем текстиле. За счет способности дезинфицировать, веществом проводят обработку различных поверхностей.
Итоги
Уксусная кислота – комплексное средство, используемое в различных отраслях. Однако злоупотреблять применением составов на ее основе не рекомендуется. Перед приемом внутрь и обработкой кожных покровов нужно обратиться к врачу и получить консультацию.
Мама 3 детей. Готовлю на всю семью) О народной медицине узнала от бабушки. С тех пор много лет применяю сама и теперь делюсь с читателями.
§ 20. УКСУСНАЯ КИСЛОТА. Токсикологическая химия. В.Ф. Крамаренко
Безводная (ледяная) уксусная кислота СН 3 СООН представляет собой бесцветную гигроскопическую жидкость или бесцветные кристаллы с резким запахом. Она смешивается с водой, этиловым спиртом и диэтиловым эфиром во всех соотношениях. Эта кислота перегоняется с водяным паром. Уксусную кислоту получают при брожении некоторых органических веществ и путем синтеза. Эта кислота содержится в продуктах сухой перегонки дерева. В небольших количествах уксусная кислота может содержаться в человеческом организме.
Применение. Действие на организм. Уксусная кислота применяется для синтеза красителей, получения ацетата целлюлозы, ацетона и многих других веществ. В виде уксуса и уксусной эссенции она применяется в пищевой промышленности и в быту для приготовления пищи. Отмечены случаи отравления уксусной кислотой (главным образом уксусной эссенцией), принятой внутрь. 10—20 г уксусной эссенции или 200—300 мл уксуса является смертельной дозой. Уксусная кислота оказывает действие на кровь и почки. При контакте с кожей ледяная уксусная кислота вызывает ожоги и образование пузырьков. После приема концентрированной уксусной кислоты или уксусной эссенции внутрь поражается верхняя часть пищевого канала, появляется кровавая рвота, понос, развивается гемолитическая анемия, гемогло-бинурия, анурия и уремия. При вдыхании паров уксусной кислоты происходит раздражение слизистых оболочек дыхательных путей, могут развиваться бронхопневмония, катаральный бронхит, воспаление глотки и г. д.
Метаболизм. Метаболитом уксусной кислоты является ацетальдегид, превращающийся частично в этиловый спирт и частично разлагающийся с образованием оксида углерода (IV) и воды.
Уксусная кислота относится к веществам, изолируемым из объектов перегонкой с водяным паром. В отличие от других веществ этой группы уксусную кислоту отгоняют из объектов биологического происхождения, подкисленных 10 %-м раствором серной или фосфорной кислоты.
Перегонку уксусной кислоты производят до отрицательной реакции дистиллята на наличие этой кислоты. Ввиду ее летучести дистиллят собирают в сосуд, содержащий 0,1 н. раствор гидроксида натрия. В дистилляте ацетат-ионы определяют при помощи перечисленных ниже реакций.
Обнаружение уксусной кислоты
Реакция с хлоридом железа (III). От прибавления хлорида железа (III) к ацетат-ионам появляется красная окраска, обусловленная образованием основного ацетата железа:
Выполнение реакции. 2—3 мл дистиллята вносят в пробирку и прибавляют 1 каплю 5 %-го свежеприготовленного раствора хлорида железа (III). Появление красной окраски указывает на наличие ацетат-ионов в дистилляте. При нагревании окрашенного раствора происходит гидролиз, в результате которого выпадает бурый осадок.
Предел обнаружения: 1,25 мг ацетат-ионов в 1 мл дистиллята.
Реакция с нитратом лантана и иодом. При взаимодействии ацетат-ионов с нитратом лантана La(NO 3 ) 3 в присутствии иода и аммиака раствор приобретает темно-синюю окраску или выпадает такого же цвета осадок. Появление этой окраски или осадка обусловлено адсорбцией иода основным ацетатом лантана. Подобную окраску дают и пропионаты.
Выполнение реакции. К 1 мл дистиллята прибавляют 0,5 мл 5 %-го водного раствора нитрата лантана, 0,5 мл 0,25 %-го спиртового раствора иода и 5 капель 2 н. раствора аммиака. Появление интенсивной синей или коричнево-фиолетовой окраски указывает на наличие ацетат-ионов в дистилляте.
Предел обнаружения: 500 мкг ацетат-ионов в 1 мл. Этой реакции мешают сульфаты, фосфаты и катионы, дающие с аммиаком осадки.
Реакция образования индиго. При нагревании уксусной кислоты или ацетатов с солями кальция образуется ацетон:
Образовавшийся ацетон в присутствии щелочей взаимодействует с о -нитробензальдегидом. При этом образуется ряд промежуточных продуктов. Конечным продуктом реакции является, индиго. Уравнение этой реакции приведено выше (см. гл. IV, §11).
Выполнение реакции. Около половины дистиллята вносят в пробирку и выпаривают досуха. К сухому остатку прибавляют смесь равных количеств оксида кальция и карбоната кальция. Отверстие пробирки накрывают фильтровальной бумагой, смоченной свежеприготовленным раствором о -нитробензальдегида в 5 %-м растворе гидроксида натрия. Затем пробирку нагревают на пламени газовой горелки до прокаливания ее содержимого. При наличии ацетат-ионов в исследуемом растворе на бумаге, пропитанной раствором о -нитробензальдегида, появляется синее пятно (окраска индиго).
Эту реакцию дают соединения, при гидролизе которых образуется группа СН 3 СО—. К таким соединениям относятся диацетил и др.
Реакция образования уксусно-этилового эфира. При нагревании ацетатов с этиловым спиртом в присутствии серной кислоты образуется уксусно-этиловый эфир (этилацетат):
Выполнение реакции. В пробирку вносят 3—5 мл дистиллята и выпаривают досуха. К сухому остатку прибавляют 1 мл этилового спирта и 2 мл концентрированной серной кислоты, а затем смесь осторожно нагревают на пламени горелки. При наличии ацетатов в дистилляте появляется специфический запах этилацетата.
СОДЕРЖАНИЕ
ПРЕДЫДУЩАЯ | СЛЕДУЮЩАЯ
Еще по теме:
 для устранения неприятного запаха изо рта при заболеваниях желудочно-кишечного тракта: взять 2 капли 70%-й уксусной кислоты, смешать с 200 мл настоя мяты, проводить полоскания ротовой полости после очищения зубов пастой;
для устранения неприятного запаха изо рта при заболеваниях желудочно-кишечного тракта: взять 2 капли 70%-й уксусной кислоты, смешать с 200 мл настоя мяты, проводить полоскания ротовой полости после очищения зубов пастой;