Молочный протеин I Что это? I Виды I Полезные свойства
Кому следует принимать молочный протеин?
Молочный протеин является отличным решением для всех тех, кто хочет увеличить потребление белка. Источники молочного белка доступны по цене, широко представлены в продаже и бывают разных вкусов.
Спортсмены могут использовать молочный белок в своих коктейлях, чтобы восстановиться сразу после тренировки. Молочный протеин отлично дополнит ваш утренний смузи. Те кто хочет похудеть, также могут добавлять его в коктейль, заменяющий прием пищи, а желающие набрать вес могут добавлять его к своей обычной еде, чтобы увеличить прием белка и добавить калорий.
Полезные свойства
Польза от молочного протеина такая же, как от любого другого источника белка — восстановление мышц после тренировки, наращивание мышечной массы, которая может привести к увеличению силы, и улучшение общего состояния здоровья. Наши мышцы постоянно разрушаются и восстанавливаются. Включение в рацион достаточного количества белка гарантирует, что мышечная ткань обеспечена всеми необходимыми строительными блоками для того, чтобы оставаться здоровой.
Молочный белок поможет защитить сухую мышечную массу во время дефицита калорий, поддержит потерю веса и придаст чувство насыщения, что в свою очередь, поможет предотвратить переедание.
Поскольку молочный белок содержит все незаменимые аминокислоты, он также подходит вегетарианцам. А еще, это отличный источник белка для людей с ограниченным бюджетом.
Побочные эффекты
Единственные возможные побочные эффекты при употреблении молочного протеина могут возникнуть у людей с аллергией на молочный белок. Люди с непереносимостью лактозы часто не реагируют на молочный протеин, потому что лактоза — это сахар в молоке, который в основном удаляется из переработанных молочных белковых продуктов.
Веганы, скорее всего, будут избегать молочных протеинов, так как они изготавливаются из коровьего молока.
Заключение
Молочные протеиновые порошки являются весьма популярными, и эта популярность обоснована пользой продукта. Они бывают двух видов — быстро и медленно усваивающиеся, для немедленного и более длительного восстановления. Продукт представлен во множестве вкусовых вариаций. Такой коктейль готовится легко, и его можно брать с собой в дорогу. Кроме того, молочный протеин доступен по цене.
Продукт представлен во множестве вкусовых вариаций. Такой коктейль готовится легко, и его можно брать с собой в дорогу. Кроме того, молочный протеин доступен по цене.
Если вы начинающий атлет, то можете легко запутаться в многообразии представленных на рынке видов протеина. Поиск своего идеального протеина может быть затруднен широким предложением. В любом случае, лучше всего начать с молочных белков.
Статьи на нашем сайте представлены только в просветительских и информационных целях. Мы не рекомендуем использовать материалы статей в качестве медицинских рекомендаций. Если вы решили принимать биодобавки или внести основательные изменения в свой рацион, предварительно проконсультируйтесь со специалистом.
Перевод: Фарида Сеидова
РАЗРУШАЕТСЯ ЛИ БЕЛОК ВО ВРЕМЯ ТЕРМООБРАБОТКИ?
Белковые
продукты Все товары
Категории:
- Сывороточный протеин
- Казеин
- Растительный протеин
- Яичный протеин
- Многокомпонентный
Популярные товары:
- GOLD STANDARD 100% WHEY
- NATURALLY FLAVORED 100% WHEY
- GOLD STANDARD 100% CASEIN
- SERIOUS MASS
- GOLD STANDARD 100% ISOLATE
Сила и
восстановление Все товары
Категории:
- Перед тренировкой
- После тренировки
- Аминокислоты
- Креатин
- Гейнеры
Популярные товары:
- AMINO ENERGY NATURALLY FLAVORED
- Essential Amino Energy + UC-II COLLAGEN
- AMINO ENERGY + ELECTROLYTES
- L – CARNITINE 500 TABS
- ESSENTIAL AMINO ENERGY
Здоровье и
долголетие Все товары
Категории:
- Диетические продукты
- Специальные добавки
- Мультивитамины
Популярные товары:
- OPTI-MEN
- OPTI-WOMEN
- L – CARNITINE 500 TABS
- ZMA
- FISH OIL SOFTGELS
Где купить
продукцию
Optimum
Nutrition
Change Region
USUKDEIEFR
Уважаемые покупатели! Обращаем ваше внимание, что указанные сроки доставки ориентировочные! День оформления заказа, его обработки и отгрузки в расчёт не принимаются! Team ON
Вернуться к списку
Другие статьи
- Остерегайтесь подделок
- Изменение состава продукции
- Больше, чем просто новая упаковка!
- Вместо трёх загадочных букв ZMA!
- Новые крышки Opti-men & Opti-women
- Белые крышки и банки
- Яблочные оладьи
- Шаг в сторону экологии!
- Защитная мембрана
- Идеальные казеиновые блины
Основы фитнеса
23. 10.2022
10.2022
Денатурация – это разрушение сложной цепочки белковой молекулы под действием дестабилизирующего температурного фактора. <br>
Денатурацию пищевого белка мы видим во время готовки яичницы или жарки мяса. И это не уменьшает их пищевую ценность, а наоборот позволяет легче и эффективнее усваиваться. На примере яиц, если мы не будем их варить или жарить, а съедим сырыми, то они подвергнутся тому же самому разрушению молекулярных связей уже в нашем желудке за счет пищеварительных ферментов. <br>
А вот с витаминами и минералами все немного сложнее, так как они при температурном воздействии легко разрушаются. <br>
Но протеин мы пьем не ради витаминов, а ради содержащихся в нем аминокислот, с которыми ничего плохого не происходит и качество их усвоения и ценность не теряется.
 <br>
<br>Идея, что с протеином что-то может быть не так под влиянием температуры, возникла в попытке сделать с помощью протеина и кипятка протеиновый чай. Получалось что-то невнятное. <br>
Происходило это из-за того, что сывороточный белок (самый популярный вид исходного сырья для высокобелковых смесей) под влиянием температуры сворачивается. Этот процесс называется коагуляцией. <br>
Воздействие высокой температуры приводит к образованию нерастворимого коллоидного фосфата кальция, который выпадает в осадок. И получается пенка на молоке вместо протеинового чая. <br>
Но вся эта технология прекрасно используется в сыроварении и нисколько не мешает нам наслаждаться этим вкусным продуктом. Поэтому протеиновый горячий чай пить можно, но не нужно. <br>
А выпекать блины и кексы с протеином нужно!<br>
Автор статьи: Артём Диянов <br>
Физико-химические характеристики белка, выделенного из жмыха Thraustochytrid
1. Пиментель Д., Пиментел М. Устойчивость мясных и растительных рационов и окружающая среда. Являюсь. Дж. Клин. Нутр. 2002; 78:660S–663S. doi: 10.1093/ajcn/78.3.660S. [PubMed] [CrossRef] [Google Scholar]
Пиментель Д., Пиментел М. Устойчивость мясных и растительных рационов и окружающая среда. Являюсь. Дж. Клин. Нутр. 2002; 78:660S–663S. doi: 10.1093/ajcn/78.3.660S. [PubMed] [CrossRef] [Google Scholar]
2. Хенчон М., Хейс М., Маллен А.М., Фенелон М., Тивари Б. Будущее предложение и спрос на белок: стратегии и факторы, влияющие на устойчивое равновесие. Еда. 2017;6:53. дои: 10.3390/продукты6070053. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Бликли С., Хейс М. Белки водорослей: извлечение, применение и проблемы, связанные с производством. Еда. 2017;6:33. doi: 10.3390/foods6050033. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Матос А.П. Глава 3-Микроводоросли как потенциальный источник белков. В: Галанакис С.М., редактор. Белки: устойчивый источник, обработка и применение. Академическая пресса; Кембридж, Массачусетс, США: 2019 г.. стр. 63–96. [Google Scholar]
5. Chambal B., Bergenståhl B., Dejmek P. Пищевые белки жмыха из кокосового молока; одностадийная щелочная экстракция и характеристика с помощью электрофореза и масс-спектрометрии. Еда Рез. Междунар. 2012; 47: 146–151. doi: 10.1016/j.foodres.2011.04.036. [CrossRef] [Google Scholar]
Еда Рез. Междунар. 2012; 47: 146–151. doi: 10.1016/j.foodres.2011.04.036. [CrossRef] [Google Scholar]
6. Martins J.T., Bourbon A.I., Pinheiro A.C., Fasolin L.H., Vicente A.A. Структуры на основе белков для пищевых применений: от макро до наномасштаба. Фронт. Поддерживать. Пищевая система 2018;2 doi: 10.3389/fsufs.2018.00077. [CrossRef] [Google Scholar]
7. Cui L., Bandillo N., Wang Y., Ohm J.-B., Chen B., Rao J. Функциональность и структура изолята белка желтого гороха под влиянием сортов и рН экстракции. Пищевой гидроколл. 2020;108:106008. doi: 10.1016/j.foodhyd.2020.106008. [CrossRef] [Google Scholar]
8. Timilsena Y.P., Adhikari R., Barrow C.J., Adhikari B. Физико-химические и функциональные свойства белкового изолята, полученного из австралийских семян чиа. Пищевая хим. 2016; 212: 648–656. doi: 10.1016/j.foodchem.2016.06.017. [PubMed] [CrossRef] [Академия Google]
9. Кошик П., Даулинг К., Макнайт С., Барроу С.Дж., Ван Б., Адхикари Б. Получение, характеристика и функциональные свойства изолята белка из семян льна. Пищевая хим. 2016;197:212–220. doi: 10.1016/j.foodchem.2015.09.106. [PubMed] [CrossRef] [Google Scholar]
Пищевая хим. 2016;197:212–220. doi: 10.1016/j.foodchem.2015.09.106. [PubMed] [CrossRef] [Google Scholar]
10. Шене С., Паредес П., Вергара Д., Лейтон А., Гарсес М., Флорес Л., Рубилар М., Бустаманте М., Армента Р. Антарктика thraustochytrids: производители длинноцепочечных полиненасыщенных жирных кислот омега-3. микробиол. Открытым. 2020;9:e00950. doi: 10.1002/mbo3.950. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Массана Р., Пернис М., Бунге Дж. А., дель Кампо Дж. Разнообразие последовательностей и новизна природных сообществ пикоукариот из Индийского океана. ISME J. 2011; 5: 184–195. doi: 10.1038/ismej.2010.104. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Raghukumar S. Экология морских простейших, лабиринтуломицетов (Thraustochytrids и Labyrinthulids) Eur. Дж. Протистол. 2002; 38: 127–145. дои: 10.1078/0932-4739-00832. [CrossRef] [Google Scholar]
13. Лейланд Б., Леу С., Буссиба С. Являются ли траустохитриды водорослями? Грибковая биол. 2017; 121:835–840. doi: 10.1016/j.funbio.2017.07.006. [PubMed] [CrossRef] [Google Scholar]
2017; 121:835–840. doi: 10.1016/j.funbio.2017.07.006. [PubMed] [CrossRef] [Google Scholar]
14. Colonia B.S.O., de Melo Pereira G.V., Soccol CR. Омега-3 микробные масла из морских траустохитридов как устойчивое и технологическое решение: обзор и патентный ландшафт. Тенденции Food Sci. Технол. 2020; 99: 244–256. doi: 10.1016/j.tifs.2020.03.007. [Перекрестная ссылка] [Академия Google]
15. Нхам Тран Т.Л., Миранда А.Ф., Гупта А., Пури М., Болл А.С., Адхикари Б., Мурадов А. Питательный и фармакологический потенциал новых австралийских траустохитрид, выделенных из отложений мангровых зарослей. Мар. Наркотики. 2020;18:151. doi: 10.3390/md18030151. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Иннис С.М. Пищевые омега-3 жирные кислоты и развивающийся мозг. Мозг Res. 2008;1237:35–43. doi: 10.1016/j.brainres.2008.08.078. [PubMed] [CrossRef] [Академия Google]
17. Колдер П.К. Морские омега-3 жирные кислоты и воспалительные процессы: эффекты, механизмы и клиническая значимость. Бба.-мол. Клеточная биол. Л., 2015; 1851. С. 469–484. doi: 10.1016/j.bbalip.2014.08.010. [PubMed] [CrossRef] [Google Scholar]
Бба.-мол. Клеточная биол. Л., 2015; 1851. С. 469–484. doi: 10.1016/j.bbalip.2014.08.010. [PubMed] [CrossRef] [Google Scholar]
18. Byreddy A.R. Траустохитриды как альтернативный источник омега-3 жирных кислот, каротиноидов и ферментов. Липидная технология. 2016;28:68–70. doi: 10.1002/lite.201600019. [CrossRef] [Google Scholar]
19. Райан А.С., Зеллер С., Нельсон Э.Б. 15-Оценка безопасности одноклеточных масел и нормативные требования для использования в качестве пищевых ингредиентов. В: Коэн З., Ратледж С., редакторы. Одноклеточные масла. 2-е изд. АОКС Пресс; Урбана, Иллинойс, США: 2010. стр. 317–350. [Академия Google]
20. Майкл А., Кьевальянга М.С., Лугомела К.В. Биомасса и питательная ценность спирулины (Arthrospira fusiformis), выращенной в экономичной среде. Анна. микробиол. 2019;69:1387–1395. doi: 10.1007/s13213-019-01520-4. [CrossRef] [Google Scholar]
21. Hildebrand G., Poojary M.M., O’Donnell C., Lund M.N., Garcia-Vaquero M., Tiwari B.K. Ультразвуковая обработка Chlorella vulgaris для повышения экстракции белка. Дж. Заявл. Фикол. 2020 г.: 10.1007/s10811-020-02105-4. [Перекрестная ссылка] [Академия Google]
Дж. Заявл. Фикол. 2020 г.: 10.1007/s10811-020-02105-4. [Перекрестная ссылка] [Академия Google]
22. АОАС . Официальные методы анализа. АОАС; Роквилл, Массачусетс, США: 2005. Ассоциация официальных химиков-аналитиков. [Google Scholar]
23. Миранда А.Ф., Лю З., Рохфорт С., Мурадов А. Продукция липидов водным растением Азолла на вегетативной и репродуктивной стадиях и в ответ на абиотический стресс. Завод. Физиол. биох. 2018; 124:117–125. doi: 10.1016/j.plaphy.2018.01.012. [PubMed] [CrossRef] [Google Scholar]
24. Подпора Б., Свидерски Ф., Садовска А., Раковска Р., Васяк-Зис Г. Экстракты отработанных пивных дрожжей как новый компонент функционального питания. Чешский J. Food Sci. 2016; 34: 554–563. дои: 10.17221/419/2015-CJFS. [CrossRef] [Google Scholar]
25. Мур С., Штейн В.Х. Фотометрический нин-гидриновый метод для использования в хроматографии аминокислот. Дж. Биол. хим. 1948; 176: 367–388. [PubMed] [Google Scholar]
26. Лоуренсо С.О., Барбарино Э. , Де-Паула Х.К., Перейра Л.О.Д.С., Маркес У.М.Л. Аминокислотный состав, содержание белка и расчет коэффициентов преобразования азота в белок для 19 тропических водорослей. Фикол. Рез. 2002; 50: 233–241. doi: 10.1111/j.1440-1835.2002.tb00156.x. [Перекрестная ссылка] [Академия Google]
, Де-Паула Х.К., Перейра Л.О.Д.С., Маркес У.М.Л. Аминокислотный состав, содержание белка и расчет коэффициентов преобразования азота в белок для 19 тропических водорослей. Фикол. Рез. 2002; 50: 233–241. doi: 10.1111/j.1440-1835.2002.tb00156.x. [Перекрестная ссылка] [Академия Google]
27. Мацусита К. Автоматическая дериватизация аминокислот перед колонкой и анализ методом быстрой ЖХ с использованием системы ЖХ Agilent 1290 Infinity. Эджилент Технологии; Токио, Япония: 2010. [Google Scholar]
28. Кэннон-Карлсон С., Танг Дж. Модификация процедуры электрофореза в полиакриламидном геле с додецилсульфатом натрия Лэммли для устранения артефактов в восстанавливающих и невосстанавливающих гелях. Анальный. Биохим. 1997; 246:146–148. doi: 10.1006/abio.1997.2002. [PubMed] [CrossRef] [Академия Google]
29. Эрнст О., Зор Т. Линеаризация анализа белков Брэдфорда. Юпитер. 2010 г.: 10.3791/1918. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
30. Като А., Накаи С. Гидрофобность, определяемая методом флуоресцентного зонда, и ее корреляция с поверхностными свойствами белков. Биохим. Биофиз. Acta (BBA) Белковая структура. 1980; 624:13–20. doi: 10.1016/0005-2795(80)90220-2. [PubMed] [CrossRef] [Google Scholar]
Гидрофобность, определяемая методом флуоресцентного зонда, и ее корреляция с поверхностными свойствами белков. Биохим. Биофиз. Acta (BBA) Белковая структура. 1980; 624:13–20. doi: 10.1016/0005-2795(80)90220-2. [PubMed] [CrossRef] [Google Scholar]
31. Lobley A., Whitmore L., Wallace B. DICHROWEB: интерактивный веб-сайт для анализа вторичной структуры белка по спектрам кругового дихроизма. Биоинформатика. 2002; 18: 211–212. дои: 10.1093/биоинформатика/18.1.211. [PubMed] [CrossRef] [Google Scholar]
32. Пирс К.Н., Кинселла Дж.Э. Эмульгирующие свойства белков: оценка турбидиметрического метода. Дж. Агрик. Пищевая хим. 1978; 26: 716–723. doi: 10.1021/jf60217a041. [CrossRef] [Google Scholar]
33. Teuling E., Wierenga P.A., Schrama J.W., Gruppen H. Сравнение белковых экстрактов из различных одноклеточных зеленых источников. Дж. Агрик. Пищевая хим. 2017;65:7989–8002. doi: 10.1021/acs.jafc.7b01788. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Safi C., Ursu A.V., Laroche C., Zebib B., Merah O., Pontalier P.-Y., Vaca-Garcia C. Водная экстракция белков из микроводорослей: влияние различных методов разрушения клеток. Алгал Рез. 2014; 3:61–65. doi: 10.1016/j.algal.2013.12.004. [CrossRef] [Google Scholar]
Safi C., Ursu A.V., Laroche C., Zebib B., Merah O., Pontalier P.-Y., Vaca-Garcia C. Водная экстракция белков из микроводорослей: влияние различных методов разрушения клеток. Алгал Рез. 2014; 3:61–65. doi: 10.1016/j.algal.2013.12.004. [CrossRef] [Google Scholar]
35. Джайн Р., Рагхукумар С., Таранатан Р., Бхосле Н. Производство внеклеточных полисахаридов протистами-траустохитридами. Мар. Биотехнолог. 2005; 7: 184–192. doi: 10.1007/s10126-004-4025-x. [PubMed] [CrossRef] [Академия Google]
36. Gerde J.A., Wang T., Yao L., Jung S., Johnson L.A., Lamsal B. Оптимизация выделения белка из обезжиренной и необезжиренной биомассы микроводорослей Nannochloropsis. Алгал Рез. 2013;2:145–153. doi: 10.1016/j.algal.2013.02.001. [CrossRef] [Google Scholar]
37. Родсамран П., Соторнвит Р. Физико-химические и функциональные свойства белкового концентрата из побочного продукта переработки кокоса. Пищевая хим. 2018; 241:364–371. doi: 10.1016/j.foodchem.2017.08.116. [PubMed] [CrossRef] [Академия Google]
38. Тан С.Х., Тэн З., Ван С.-С., Ян С.-К. Физико-химические и функциональные свойства белкового изолята конопли (Cannabis sativa L.). Дж. Агрик. Пищевая хим. 2006; 54:8945–8950. doi: 10.1021/jf0619176. [PubMed] [CrossRef] [Google Scholar]
Тан С.Х., Тэн З., Ван С.-С., Ян С.-К. Физико-химические и функциональные свойства белкового изолята конопли (Cannabis sativa L.). Дж. Агрик. Пищевая хим. 2006; 54:8945–8950. doi: 10.1021/jf0619176. [PubMed] [CrossRef] [Google Scholar]
39. Horax R., Hettiarachchy N., Chen P., Jalaluddin M. Получение и характеристика белкового изолята из вигны (Vigna unguiculata L. Walp.) J. Food Sci. 2004;69:fct114–fct118. doi: 10.1111/j.1365-2621.2004.tb15500.x. [Перекрестная ссылка] [Академия Google]
40. Беверунг С., Радке С.Дж., Бланч Х.В. Адсорбция белка на границе раздела масло/вода: характеристика кинетики адсорбции путем измерения динамического межфазного натяжения. Биофиз. хим. 1999; 81: 59–80. doi: 10.1016/S0301-4622(99)00082-4. [PubMed] [CrossRef] [Google Scholar]
41. Pham L.B., Wang B., Zisu B., Adhikari B. Ковалентная модификация изолята белка льняного семени фенольными соединениями и структура и функциональные свойства аддуктов. Пищевая хим. 2019; 293:463–471. doi: 10. 1016/j.foodchem.2019.04.123. [PubMed] [CrossRef] [Google Scholar]
1016/j.foodchem.2019.04.123. [PubMed] [CrossRef] [Google Scholar]
42. Раиса З., де Хесус К.В., Тамара Л., Грасиела С., Лорена О.М., Клаудио Р. Новый гидролизат белка из Spirulina platensis, используемый в качестве пептона в микробиологических культуральных средах. Дж. Нат. Произв. Ресурс. 2016;2:71–75. [Google Scholar]
43. Boye J., Zare F., Pletch A. Белки бобовых: обработка, характеристика, функциональные свойства и применение в продуктах питания и кормах. Еда Рез. Междунар. 2010;43:414–431. doi: 10.1016/j.foodres.2009.09.003. [Перекрестная ссылка] [Академия Google]
44. Карака А.С., Лоу Н., Никерсон М. Эмульгирующие свойства белковых изолятов канолы и льняного семени, полученных путем изоэлектрического осаждения и экстракции соли. Еда Рез. Междунар. 2011;44:2991–2998. doi: 10.1016/j.foodres.2011.07.009. [CrossRef] [Google Scholar]
45. Кинселла Дж. Э. Взаимосвязь между структурой и функциональными свойствами пищевых белков. В: Fox PF, Condon JJ, редакторы. Пищевые белки. Kluwer Academic Publishers Group; Дордрехт, Нидерланды: 1982. [Google Scholar]
Пищевые белки. Kluwer Academic Publishers Group; Дордрехт, Нидерланды: 1982. [Google Scholar]
46. Ю Г., Лю Х., Венкатешан К., Ян С., Ченг Дж., Сун С., Ван Д. Функциональные, физико-химические и реологические свойства белка ряски (Spirodela polyrhiza). Транс. АСАБЕ. 2011; 54: 555–561. дои: 10.13031/2013.36459. [CrossRef] [Google Scholar]
47. Tang C.-H., Chen Z., Li L., Yang X.-Q. Влияние обработки трансглютаминазой на термические свойства изолятов соевого белка. Еда Рез. Междунар. 2006; 39: 704–711. doi: 10.1016/j.foodres.2006.01.012. [Перекрестная ссылка] [Академия Google]
48. Schwenzfeier A., Wierenga P.A., Gruppen H. Выделение и характеристика растворимого белка из зеленых микроводорослей Tetraselmis sp. Биоресурс. Технол. 2011;102:9121–9127. doi: 10.1016/j.biortech.2011.07.046. [PubMed] [CrossRef] [Google Scholar]
49. Уэйд А. М., Такер Х. Н. Антиоксидантные характеристики L-гистидина. Дж. Нутр. Биохим. 1998; 9: 308–315. doi: 10.1016/S0955-2863(98)00022-9. [CrossRef] [Google Scholar]
[CrossRef] [Google Scholar]
50. Петерсон Дж.В., Болдог И., Попов В.Л., Сайни С.С., Чопра А.К. Противовоспалительный и антисекреторный потенциал гистидина в тонком кишечнике мышей, зараженных сальмонеллой. лаборатория Инвестировать. 1998;78:523–534. [PubMed] [Google Scholar]
51. Кесслер А.Т., Раджа А. Биохимия, гистидин. Издательство StatPearls; Treasure Island, FL, USA: 2019. [Google Scholar]
52. Kim Y., Kim Y. L-гистидин и L-карнозин оказывают антивозрастное действие на нейроны, индуцированные D-галактозой. Нутр. Рез. Практика. 2020; 14 doi: 10.4162/nrp.2020.14.3.188. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Бартон Э.Р., Моррис Л., Кавана М., Биш Л.Т., Турсел Т. Системное введение L-аргинина улучшает функцию скелетных мышц mdx. Мышечный нерв. 2005; 32: 751–760. doi: 10.1002/mus.20425. [PubMed] [CrossRef] [Академия Google]
54. Валлабха В.С., Тапал А., Сухдео С.В., К.Г., Тику П.К. Влияние аргинина: соотношение лизина в форме свободной аминокислоты и белка на гипертензию, индуцированную l-NAME, у крыс Вистар с гиперхолестеринемией. Rsc. Доп. 2016;6:73388–73398. doi: 10.1039/C6RA13632J. [CrossRef] [Google Scholar]
Rsc. Доп. 2016;6:73388–73398. doi: 10.1039/C6RA13632J. [CrossRef] [Google Scholar]
55. Вега-Лопес С., Маттан Н.Р., Аусман Л.М., Хардинг С.В., Райдаут Т.С., Ай М., Отокозава С., Фрид А., Кувин Дж. Т., Джонс П. Дж. Изменение пищевого лизина: Соотношение аргинина мало влияет на факторы риска сердечно-сосудистых заболеваний и сосудистую реактивность у взрослых с умеренной гиперхолестеринемией. Атеросклероз. 2010;210:555–562. doi: 10.1016/j.atherosclerosis.2009.12.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Yang L., Chen J., Xu T., Qiu W., Zhang Y., Zhang L., Xu F., Liu H. Белок риса, выделенный разными способами, влияет на метаболизм холестерина у крыс из-за его меньшей усвояемости. Междунар. Дж. Мол. науч. 2011; 12:7594–7608. doi: 10.3390/ijms12117594. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
57. Кушниров В.В. Быстрая и надежная экстракция белка из дрожжей. Дрожжи. 2000;16:857–860. дои: 10.1002/1097-0061(20000630)16:9<857::AID-YEA561>3. 0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]
0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]
58. Kong J., Yu S. Инфракрасный спектроскопический анализ вторичных структур белка с преобразованием Фурье. Акта Биохим. Биофиз. Грех. 2007; 39: 549–559. doi: 10.1111/j.1745-7270.2007.00320.x. [PubMed] [CrossRef] [Google Scholar]
59. Кримм С., Бандекар Дж. Достижения в области химии белков. Эльзевир; Амстердам, Нидерланды: 1986. Колебательная спектроскопия и конформация пептидов, полипептидов и белков; стр. 181–364. [PubMed] [Академия Google]
60. Jiang Y., Li C., Nguyen X., Muzammil S., Towers E., Gabrielson J., Narhi L. Квалификация метода FTIR-спектроскопии для вторичного структурного анализа белков. Дж. Фарм. науч. 2011; 100:4631–4641. doi: 10.1002/jps.22686. [PubMed] [CrossRef] [Google Scholar]
61. Лаш П., Науманн Д. Энциклопедия аналитической химии. Уайли; Хобокен, Нью-Джерси, США: 2000. Инфракрасная спектроскопия в микробиологии. [CrossRef] [Google Scholar]
62. Тамм Л.К., Татулян С.А. Инфракрасная спектроскопия белков и пептидов в липидных бислоях. Q. Преподобный Биофиз. 1997;30:365–429. doi: 10.1017/S0033583597003375. [PubMed] [CrossRef] [Google Scholar]
Q. Преподобный Биофиз. 1997;30:365–429. doi: 10.1017/S0033583597003375. [PubMed] [CrossRef] [Google Scholar]
63. Расщепляет белки HJ, вторичная структура. В: Амилс Р., Гарго М., Черничаро Кинтанилья Дж., Кливз Х.Дж., Ирвин В.М., Пинти Д., Визо М., редакторы. Энциклопедия астробиологии. Спрингер; Берлин/Гейдельберг, Германия: 2014. с. 1. [Google Scholar]
64. Karunathilaka S.R., Choi S.H., Mossoba M.M., Yakes B.J., Brückner L., Ellsworth Z., Srigley C.T. Быстрая классификация и количественная оценка добавок омега-3 из морского масла с использованием ATR-FTIR, FT-NIR и хемометрии. J. Пищевые композиции. Анальный. 2019;77:9–19. doi: 10.1016/j.jfca.2018.12.009. [CrossRef] [Google Scholar]
65. Тимилсена Ю.П., Вонгсвивут Дж., Адхикари Р., Адхикари Б. Физико-химические и термические характеристики масла семян австралийского чиа. Пищевая хим. 2017; 228:394–402. doi: 10.1016/j.foodchem.2017.02.021. [PubMed] [CrossRef] [Google Scholar]
66. Лаццари М., Чианторе О. Сушка и окислительная деструкция льняного масла. Полим. Деград. Удар. 1999; 65: 303–313. doi: 10.1016/S0141-3910(99)00020-8. [Перекрестная ссылка] [Академия Google]
Сушка и окислительная деструкция льняного масла. Полим. Деград. Удар. 1999; 65: 303–313. doi: 10.1016/S0141-3910(99)00020-8. [Перекрестная ссылка] [Академия Google]
67. Вонгсвивут Дж., Миллер М.Р., Макнотон Д., Херо П., Барроу С.Дж. Быстрое различение и определение состава полиненасыщенных жирных кислот в морских маслах с помощью ИК-Фурье-спектроскопии и многомерного анализа данных. Технология пищевых биопроцессов. 2014;7:2410–2422. doi: 10.1007/s11947-013-1251-0. [CrossRef] [Google Scholar]
68. Rohman A., Man Y.B.C. Инфракрасная спектроскопия с преобразованием Фурье (FTIR) для анализа оливкового масла первого холодного отжима, фальсифицированного пальмовым маслом. Еда Рез. Междунар. 2010; 43:886–89.2. doi: 10.1016/j.foodres.2009.12.006. [CrossRef] [Google Scholar]
69. Guillen MD, Cabo N. Характеристика пищевых масел и сала с помощью инфракрасной спектроскопии с преобразованием Фурье. Взаимосвязь между составом и частотой конкретных полос в области отпечатков пальцев.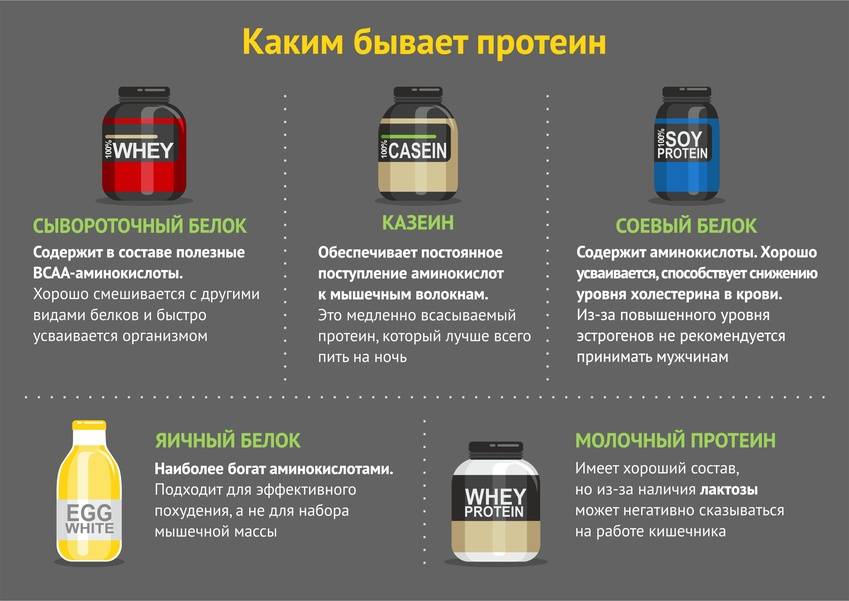 Варенье. Нефть хим. соц. 1997; 74: 1281–1286. doi: 10.1007/s11746-997-0058-4. [CrossRef] [Google Scholar]
Варенье. Нефть хим. соц. 1997; 74: 1281–1286. doi: 10.1007/s11746-997-0058-4. [CrossRef] [Google Scholar]
белок | Определение, структура и классификация
Посмотреть все СМИ
- Ключевые люди:
- Джон Б. Фенн Джордж П. Смит Тасуку Хондзё Ричард Хендерсон Уильям Г. Кэлин-младший
- Похожие темы:
- фермент интерферон транскрипционный фактор прион фосфорилирование белка
- Выдающиеся лауреаты:
- Родни Роберт Портер
Просмотреть весь связанный контент →
Популярные вопросы
Что такое белок?
Белок представляет собой встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями. Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для последующего использования у животных.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной активности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Сводка
Прочтите краткий обзор этой темы
белок , очень сложное вещество, присутствующее во всех живых организмах. Белки имеют большую питательную ценность и принимают непосредственное участие в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йонсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, происходящее от греческого proteios , что означает «занимающий первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Белки имеют большую питательную ценность и принимают непосредственное участие в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йонсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, происходящее от греческого proteios , что означает «занимающий первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Молекула белка очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных друг с другом в длинные цепи, подобно тому, как бусы расположены на нитке. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность. Хотя пока невозможно объяснить все функции белка исходя из его аминокислотной последовательности, установленные корреляции между структурой и функцией можно объяснить свойствами аминокислот, входящих в состав белков.
Растения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, которые обеспечивают азот, калий и другие вещества, необходимые для роста. Они используют углекислый газ в воздухе в процессе фотосинтеза для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений невелико, животным, таким как жвачные (например, коровы), требуется очень большое количество растительного материала, который питается только растительным материалом для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, включая человека, получают белки в основном из животных и их продуктов, например, мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белком (9).0197 см.
Содержание белка в органах животных обычно намного выше, чем в плазме крови. Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Викторина «Британника»
Викторина «Медицинские термины и пионеры»
Кто открыл основные группы крови? Что вызывает болезнь крови талассемию? Проверьте, что вы знаете о медицине, пройдя этот тест.
Высокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые наиболее важные белки, такие как ферменты и гормоны, встречаются в очень малых количествах. Важность белков связана главным образом с их функцией. Все ферменты, идентифицированные до сих пор, являются белками.
