Белки — химический состав, структура, общая формула
Поможем понять и полюбить химию
Начать учиться
Белки — основной строительный материал клеток, они составляют 15–20% общей массы человека. Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Что такое белок. Химический состав и образование белков
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью. Важно уточнить, что в состав белков входит только 20 альфа-аминокислот, тогда как всего ученым известно около 500 аминокислот. Общая формула белков выглядит следующим образом:
Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
Рассмотрим пример образования молекулы белка. Для этого познакомимся сначала с представителем альфа-аминокислот — альфа-аминопропановой кислотой.
Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:
Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом. Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Аминокислоты и их значение для человеческого организма
Говоря об аминокислотах, важно рассмотреть понятие незаменимости. Основной критерий определения биологической ценности аминокислоты — это способность поддерживать рост человека, что, в свою очередь, связано с синтезом белка в живом организме.
Незаменимые аминокислоты — это такие кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для обмена веществ и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это повлечет за собой задержку роста и снижение массы тела растущего организма.
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты — это те, которые организм может синтезировать самостоятельно или получить с продуктами питания. К ним относятся:
| аланин | глицин | серин |
| аргинин | глютамин | таурин |
| аспарагин | инозитол | тирозин |
| аспартат | орнитин | цистеин |
| гистидин | пролин | цитруллин |
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их значение:
аспартат используется для процессов регенерации;
гистидин необходим маленьким детям, у которых недостаточен эндогенный синтез;
глютамин нужен для регенерационных процессов, важный энергетический субстрат в критических состояниях;
таурин нужен новорожденным, у которых недостаточен эндогенный синтез, а также больным в критических состояниях.
 Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина;тирозин необходим маленьким детям, у которых недостаточен эндогенный синтез. При нарушении функции почек снижено образование тирозина из фенилаланина;
цистеин необходим маленьким детям, у которых недостаточен эндогенный синтез. Дефицит цистеина возникает при недостаточном содержании метионина в питании. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
Основные различия — это структура и размер.
 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
форма молекулы глобулярных белков
 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
к неполноценным
относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Структура белков
После того как мы рассмотрели все производные белков, пора переходить к структуре белков.
Как видно из рисунка, белки имеют 4 структуры: первичную, вторичную, третичную и четвертичную. Рассмотрим каждую чуть более подробно.
Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок.
 Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи.
 Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Подробнее об основных функциях белков и их химических свойствах можно узнать из другой нашей статьи. А чтобы убедиться, что вы запомнили характеристику белков, их строение, структуру и функции, приходите на онлайн-курсы химии в школу Skysmart. Здесь вас ждут интересные факты из мира химии, интерактивные задания и опытные преподаватели, которые всегда помогут и поддержат.
Ксения Боброва
К предыдущей статье
Тепловой эффект
К следующей статье
Моносахариды
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Анализ на количественные антитела IgG к спайковому белку S коронавируса COVID-19
Метод определения
Иммуноферментный анализ (ИФА), SARS-CoV-2-IgG количественный-ИФА-БЕСТ (Вектор Бест, Россия).
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Для проведения исследования в медицинских офисах Москвы необходимо предъявить СНИЛС и документ удостоверяющий личность.
Синонимы: Анализ крови на антитела к SARS-CoV-2 (S-белку, включая RBD), IgG, количественное определение; Антитела класса G к SARS-CoV-2 (S-белку и RBD), количественно. Anti-SARS-CoV-2 (S protein, including RBD), IgG, quantitative; Anti-SARS-CoV-2, spike (S) protein (RBD), IgG, quantitative.
Краткая характеристика определяемых количественно IgG антител к S-белку
SARS-CoV-2 SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2 – тяжелого острого респираторного синдрома коронавирус 2) – официальное наименование вируса, вызвавшего эпидемию COVID-19.
COVID-19 (coronavirus disease 2019 – коронавирусная болезнь 2019) – название болезни, которую индуцирует новый вид коронавируса.
Источником передачи инфекции SARS-CoV-2 является, в основном, больной человек, в том числе находящийся в инкубационном периоде заболевания, составляющем от 2 до 14 (в среднем 5-7) дней. Клинические проявления могут быть неспецифичными симптомами ОРВИ (чаще – повышение температуры, сухой кашель, затруднение дыхания). Дополнительные эпидемиологические признаки – подтвержденный либо вероятный контакт с больными COVID-19, а также проявления в виде пневмонии с характерными изменениями в легких по данным компьютерной томографии (КТ), свидетельствуют о высокой вероятности COVID-19.
SARS-CoV-2 стимулирует гуморальный и клеточный ответ иммунной системы инфицированного человека. Гуморальный ответ характеризуется типичным профилем продукции специфических антител классов M и G, которые способны распознавать и связывать чужеродные белки, характерные для этого патогена, участвуя в механизмах его нейтрализации и удаления. Антитела класса M появляются первыми – это может наблюдаться через несколько дней от появления симптомов. Почти одновременно или вскоре вслед за ними появляются IgG (более, чем у половины пациентов уже в период 8-14 дней от начала клинических признаков инфекции, а в период от 15 дней и более – у 99% пациентов). По уровню и динамике концентрации антител в крови гуморальный иммунный ответ индивидуально варьирует, в том числе и в зависимости от тяжести болезни. Уровень IgM снижается до неопределяемого обычно в пределах до одного, реже – двух месяцев от начала заболевания, в то время как IgG антитела могут сохраняться в крови длительное время (3-5 месяцев и более), выполняя защитную роль.
Почти одновременно или вскоре вслед за ними появляются IgG (более, чем у половины пациентов уже в период 8-14 дней от начала клинических признаков инфекции, а в период от 15 дней и более – у 99% пациентов). По уровню и динамике концентрации антител в крови гуморальный иммунный ответ индивидуально варьирует, в том числе и в зависимости от тяжести болезни. Уровень IgM снижается до неопределяемого обычно в пределах до одного, реже – двух месяцев от начала заболевания, в то время как IgG антитела могут сохраняться в крови длительное время (3-5 месяцев и более), выполняя защитную роль.
Четыре структурных белка, которые кодирует РНК вируса SARS-CoV-2, – спайковый (S), оболочечный (E), нуклеокапсидный (N), мембранный (M). Структуры, выступающие на поверхности вируса подобно шипам и придающие сходство с короной, сформированы спайковым (S) белком. S-белок состоит из двух субъединиц, на одной из которых располагается рецептор-связывающий домен (RBD), посредством которого вирус связывается с рецепторами на клетках эпителия дыхательных путей человека при заражении. Нуклеокапсидный и спайковый белки в ходе инфекции вызывают наиболее выраженный антительный ответ. Выявление специфических антител к этим белкам используют в качестве иммунных свидетельств прошлого контакта организма с новым коронавирусом. При этом нейтрализующая активность антител, вырабатываемых против SARS-CoV-2, преимущественно соотносится с антителами к S-белку (который в связи с этим является главной мишенью в вакцинологии).
Нуклеокапсидный и спайковый белки в ходе инфекции вызывают наиболее выраженный антительный ответ. Выявление специфических антител к этим белкам используют в качестве иммунных свидетельств прошлого контакта организма с новым коронавирусом. При этом нейтрализующая активность антител, вырабатываемых против SARS-CoV-2, преимущественно соотносится с антителами к S-белку (который в связи с этим является главной мишенью в вакцинологии).
Вакцинные препараты, использующие в качестве мишени S-белок коронавируса (в том числе векторная Гам-КОВИД-Вак – Спутник V, Спутник Лайт), или вакцины на основе мРНК S-белка, как и инактивированные цельновирионные вакцины (в т. ч. КовиВак) также индуцируют выработку антител к S-белку SARS-CoV-2.
С какой целью используют количественное определение IgG антител к S-белку SARS-CoV-2
Выявление специфических антител к вирусу SARS-CoV-2 класса G указывает на факт недавнего или прошлого воздействия вируса. Поэтому такие тесты используют в комплексной диагностике при наличии клинических подозрений на инфекцию новым коронавирусом или ее осложнения. Основной метод лабораторного подтверждения острой инфекции COVID-19 – выявление методами полимеразной цепной реакции (ПЦР) присутствия РНК вируса в биоматериале, взятом из дыхательных путей, обычно – мазке из носоглотки и ротоглотки. Однако, информативность РНК-тестирования зависит от достаточности содержания вируса в материале выбранной локализации на той или иной стадии инфекции, а также качества взятия материала. Наиболее информативны ПЦР-исследования мазков из рото- и носоглотки в первые 1-5 дней от начала клинических проявлений инфекции. На более поздних сроках (более 1-2 недель) целесообразно дополнительно к ПЦР-тестированию мазков применять исследование крови на наличие специфических антител, вырабатываемых организмом в ответ на инфекцию SARS-CoV-2.
Основной метод лабораторного подтверждения острой инфекции COVID-19 – выявление методами полимеразной цепной реакции (ПЦР) присутствия РНК вируса в биоматериале, взятом из дыхательных путей, обычно – мазке из носоглотки и ротоглотки. Однако, информативность РНК-тестирования зависит от достаточности содержания вируса в материале выбранной локализации на той или иной стадии инфекции, а также качества взятия материала. Наиболее информативны ПЦР-исследования мазков из рото- и носоглотки в первые 1-5 дней от начала клинических проявлений инфекции. На более поздних сроках (более 1-2 недель) целесообразно дополнительно к ПЦР-тестированию мазков применять исследование крови на наличие специфических антител, вырабатываемых организмом в ответ на инфекцию SARS-CoV-2.
Оценка уровня IgG антител к SARS-CoV-2 может использоваться также с целью выявления иммунологических свидетельств прошлой (в том числе субклинической или бессимптомной инфекции) для оценки вероятного иммунного статуса обследуемого человека по отношению к этому вирусу, прослеживания контактов, популяционных эпидемиологических исследований.
Поскольку большинство зарегистрированных и разрабатываемых вакцин против SARS-CoV-2 нацелено на выработку антител к S-белку, количественная оценка уровня этих антител может быть информативным методом для оценки динамики иммунного ответа на вакцинацию такими препаратами. В частности, этот тест может использоваться для оценки ответа на применение векторной вакцины с включением S-белка Гам-КОВИД-ВАК – Спутник V, Спутник Лайт, а также цельновирионных инактивированных вакцин (в том числе – КовиВак производства ФНЦ им. М.П. Чумакова) или вакцин на основе мРНК S-белка (в частности, вакцин Pfizer-BioNTech и Moderna или другие). Тест не применим для оценки иммунитета после вакцинации вакциной ЭпиВакКорона.
Применяемые в данном тесте калибраторы аттестованы по Первому международному стандарту ВОЗ для антител к SARS-CoV-2, результат представляется в единицах этого стандарта (BAU/мл), что поможет сравнивать результаты тест-систем, нацеленных на выявление иммуноглобулинов того же класса и специфичности.
Диапазон количественного измерения: 3-500 BAU/мл.
12.1.5: Белки — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 33827
- OpenStax
- OpenStax
Навыки для развития
- Описать функции белков в клетке и тканях
- Обсудите связь между аминокислотами и белками
- Объясните четыре уровня организации белков
- Опишите, как связаны форма и функция белков
Белки являются одними из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Типы и функции белков
Ферменты, вырабатываемые живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или сопряженные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят из своих субстратов более сложные молекулы, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами. Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Гормоны представляют собой химически сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, обмен веществ и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови. Основные типы и функции белков перечислены в таблице \(\PageIndex{1}\).
| Тип | Примеры | Функции |
|---|---|---|
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи путем катаболизма питательных веществ в мономерные единицы |
| Транспорт | Гемоглобин, альбумин | Переносят вещества с кровью или лимфой по всему телу |
| Структурный | Актин, тубулин, кератин | Создание различных структур, таких как цитоскелет |
| Гормоны | Инсулин, тироксин | Координация деятельности различных систем организма |
| Защита | Иммуноглобулины | Защита организма от чужеродных патогенов |
| Сократительный | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечивает питание на раннем этапе развития зародыша и проростка |
Белки имеют различную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин представляет собой глобулярный белок, а коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается множеством различных типов химических связей. Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация. Все белки состоят из разного расположения одних и тех же 20 типов аминокислот.
Например, гемоглобин представляет собой глобулярный белок, а коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается множеством различных типов химических связей. Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация. Все белки состоят из разного расположения одних и тех же 20 типов аминокислот.
Аминокислоты
Аминокислоты представляют собой мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и атом водорода. Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. \(\PageIndex{1}\)).
Название «аминокислота» происходит от того факта, что они содержат как аминогруппу, так и карбоксильную кислотную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 аминокислот. Десять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их вырабатывать и они поступают с пищей. Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. \(\PageIndex{2}\)).
Art Connection
Рисунок \(\PageIndex{2}\): В белках обычно встречаются 20 аминокислот, каждая из которых имеет свою R-группу (вариантную группу), которая определяет ее химическую природу.Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка и какие вы ожидаете найти внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в двойной липидный слой?
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, являются неполярными или гидрофобными по своей природе, в то время как аминокислоты, такие как серин, треонин и цистеин, являются полярными и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. \(\PageIndex{2}\)).
Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, являются неполярными или гидрофобными по своей природе, в то время как аминокислоты, такие как серин, треонин и цистеин, являются полярными и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. \(\PageIndex{2}\)).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенной аббревиатурой. Например, валин известен под буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, и у человека они включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к аминокислотам, необходимым для построения белков в организме, хотя и не вырабатываемым организмом; какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Незаменимые аминокислоты относятся к аминокислотам, необходимым для построения белков в организме, хотя и не вырабатываемым организмом; какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты соединяются, высвобождая молекулу воды. Образовавшаяся связь представляет собой пептидную связь (рис. \(\PageIndex{3}\)).
Рисунок \(\PageIndex{3}\): Образование пептидной связи является реакцией синтеза дегидратации. Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом высвобождается молекула воды. Продукты, образованные такими связями, называются пептидами. По мере того, как к этой растущей цепи присоединяется все больше аминокислот, получающаяся в результате цепь известна как полипептид.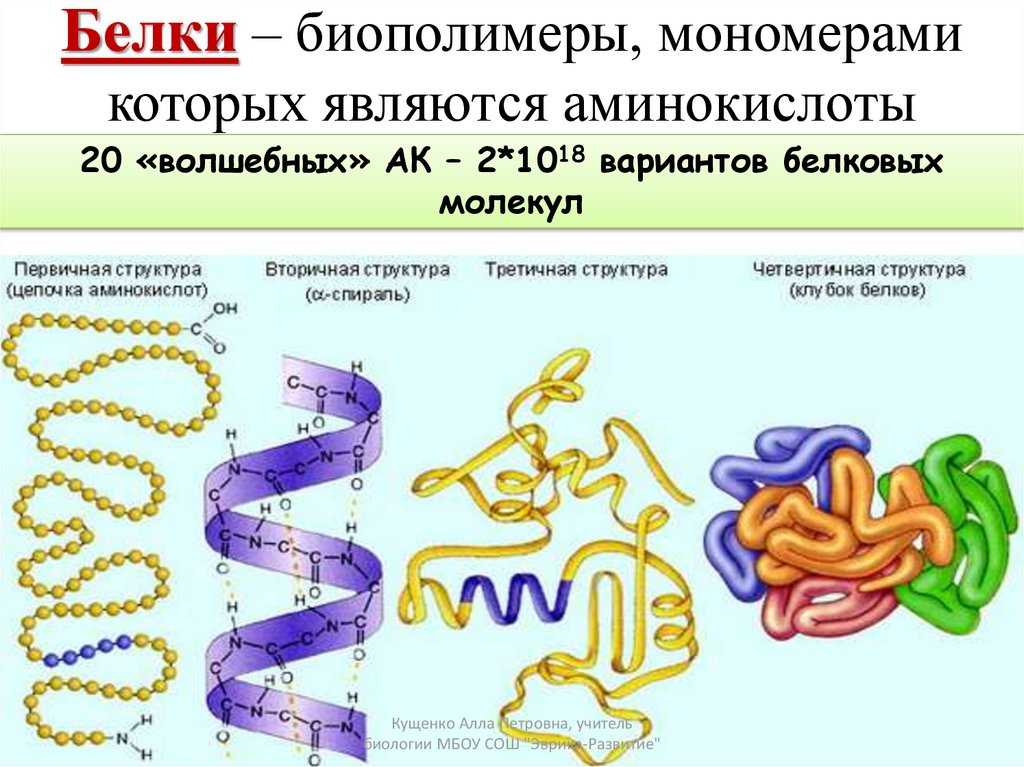 Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. Хотя термины «полипептид» и «белок» иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин «белок» используется для полипептида или полипептидов, которые объединены вместе, часто имеют связанные непептидные простетические группы, имеют четкую форму. , и имеют уникальную функцию. После синтеза белка (трансляции) большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. Хотя термины «полипептид» и «белок» иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин «белок» используется для полипептида или полипептидов, которые объединены вместе, часто имеют связанные непептидные простетические группы, имеют четкую форму. , и имеют уникальную функцию. После синтеза белка (трансляции) большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Evolution Connection
Эволюционное значение цитохрома с Цитохром с является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточных органеллах, митохондриях.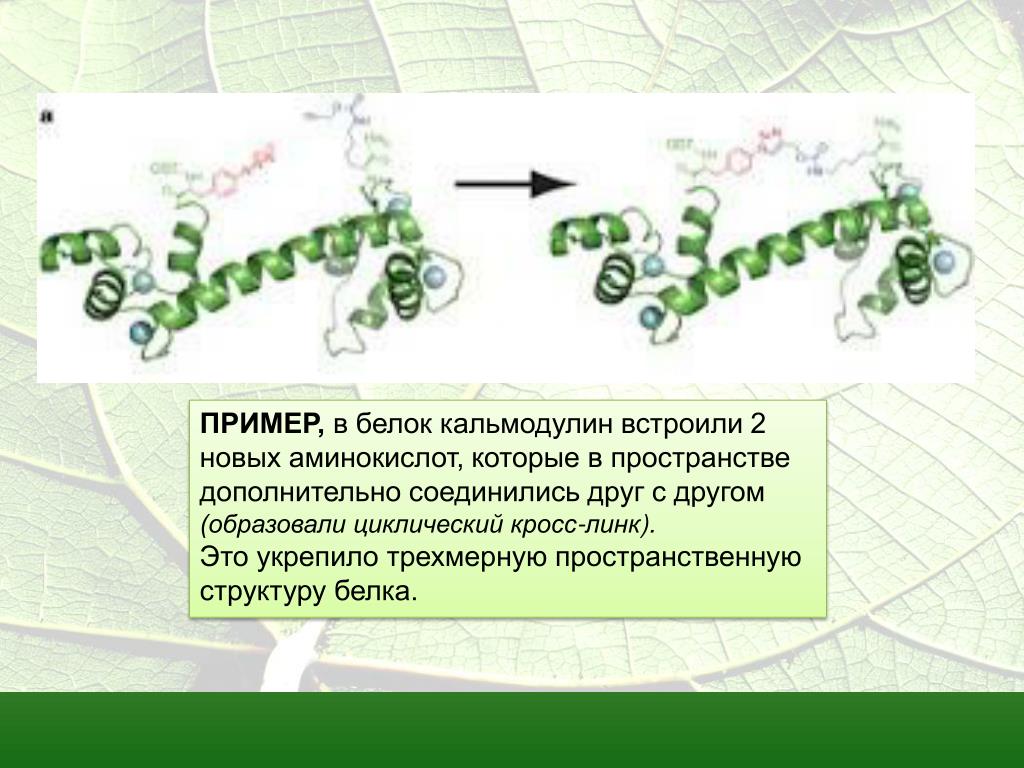 Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется при переносе электрона. Поскольку роль этого незаменимого белка в производстве клеточной энергии имеет решающее значение, она очень мало изменилась за миллионы лет. Секвенирование белка показало, что у разных видов существует значительная степень гомологии аминокислотной последовательности цитохрома с; другими словами, эволюционное родство можно оценить, измерив сходство или различие последовательностей ДНК или белков разных видов.
Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется при переносе электрона. Поскольку роль этого незаменимого белка в производстве клеточной энергии имеет решающее значение, она очень мало изменилась за миллионы лет. Секвенирование белка показало, что у разных видов существует значительная степень гомологии аминокислотной последовательности цитохрома с; другими словами, эволюционное родство можно оценить, измерив сходство или различие последовательностей ДНК или белков разных видов.
Ученые установили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с из разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что у них мог быть общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях обнаружено не было. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Структура белка
Как обсуждалось ранее, форма белка имеет решающее значение для его функции. Например, фермент может связываться со специфическим субстратом в месте, известном как активный центр. Если этот активный центр изменен из-за локальных изменений или изменений в общей структуре белка, фермент может быть не в состоянии связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальная последовательность аминокислот в полипептидной цепи является ее первичной структурой. Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, А и В, и они связаны друг с другом дисульфидными связями. N-концевая аминокислота цепи A представляет собой глицин, тогда как C-концевая аминокислота представляет собой аспарагин (рис. \(\PageIndex{4}\)). Последовательности аминокислот в цепях А и В уникальны для инсулина.
\(\PageIndex{4}\)). Последовательности аминокислот в цепях А и В уникальны для инсулина.
Уникальная последовательность для каждого белка в конечном счете определяется геном, кодирующим белок. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка. При серповидноклеточной анемии цепь гемоглобина β (небольшая часть которой показана на рисунке \(\PageIndex{5}\)) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, аминокислота глутаминовая кислота заменена валином в 9Цепь 0128 β . Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот. Структурное различие между молекулой нормального гемоглобина и молекулой серповидноклеточной клетки, которая резко сокращает продолжительность жизни, заключается в одной аминокислоте из 600. Еще более примечательно то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, и мутация вызывается изменением одного основания (точечная мутация), 1 на 1800 оснований.
При серповидноклеточной анемии цепь гемоглобина β (небольшая часть которой показана на рисунке \(\PageIndex{5}\)) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, аминокислота глутаминовая кислота заменена валином в 9Цепь 0128 β . Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот. Структурное различие между молекулой нормального гемоглобина и молекулой серповидноклеточной клетки, которая резко сокращает продолжительность жизни, заключается в одной аминокислоте из 600. Еще более примечательно то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, и мутация вызывается изменением одного основания (точечная мутация), 1 на 1800 оснований.
 В нормальном гемоглобине аминокислотой в седьмом положении является глутамат. В серповидноклеточном гемоглобине этот глутамат заменен валином.
В нормальном гемоглобине аминокислотой в седьмом положении является глутамат. В серповидноклеточном гемоглобине этот глутамат заменен валином.Из-за этой замены одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые искажают двояковогнутые или дискообразные эритроциты и принимают серповидную или «серповидную» форму, что приводит к закупорке артерий (Рисунок \(\PageIndex {6}\)). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у тех, кто страдает этим заболеванием.
Рисунок \(\PageIndex{6}\): В этом мазке крови, визуализированном при 535-кратном увеличении с использованием светлопольной микроскопии, серповидные клетки имеют форму полумесяца, а нормальные клетки имеют форму диска. (кредит: модификация работы Эда Утмана; данные масштабной линейки Мэтта Рассела)Вторичная структура
Локальная укладка полипептида в некоторых областях приводит к вторичной структуре белка. Наиболее распространенными являются α -спиральные и β -складчатые листовые структуры (рис. \(\PageIndex{7}\)). Обе структуры α – спиральная структура – спираль, удерживаемая в форме водородными связями. Водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Наиболее распространенными являются α -спиральные и β -складчатые листовые структуры (рис. \(\PageIndex{7}\)). Обе структуры α – спиральная структура – спираль, удерживаемая в форме водородными связями. Водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
На каждый спиральный виток альфа-спирали приходится 3,6 аминокислотных остатка. Группы R (вариантные группы) полипептида выступают из цепи α спирали. В складчатом листе β «складки» образованы водородными связями между атомами на основной цепи полипептидной цепи. Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова. α -спираль и β -складчатые листовые структуры обнаруживаются в большинстве глобулярных и волокнистых белков и играют важную структурную роль.
Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова. α -спираль и β -складчатые листовые структуры обнаруживаются в большинстве глобулярных и волокнистых белков и играют важную структурную роль.
Третичная структура
Уникальной трехмерной структурой полипептида является его третичная структура (рис. \(\PageIndex{8}\)). Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи).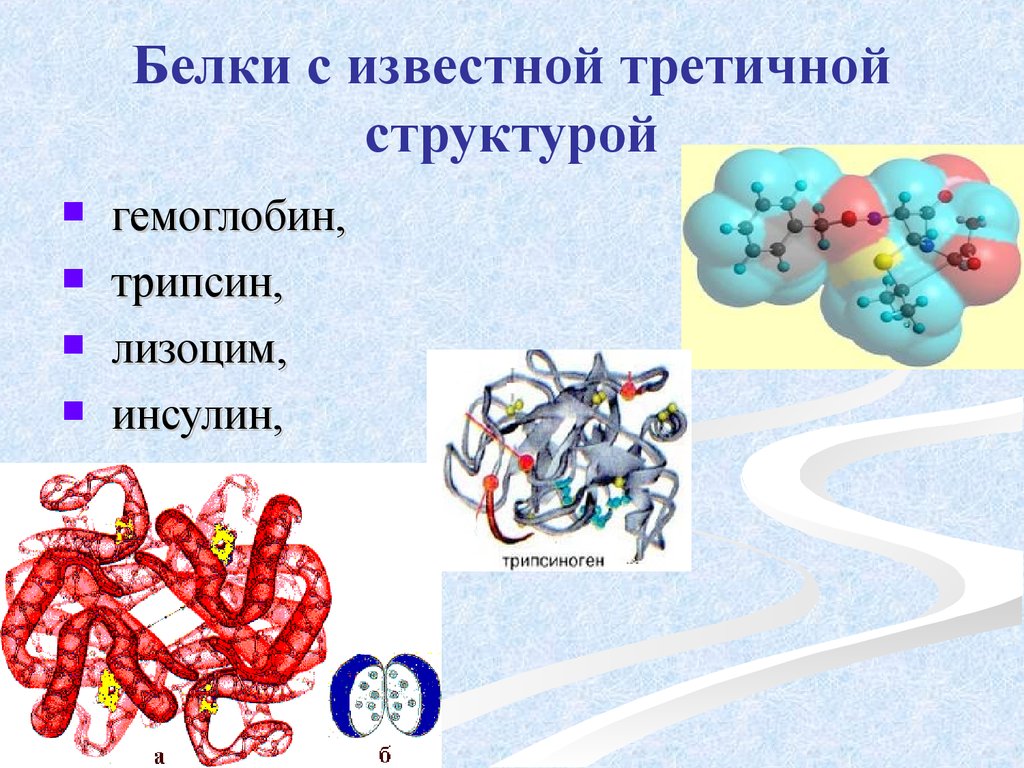 Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот располагаются внутри белка, тогда как гидрофильные R-группы располагаются снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственная ковалентная связь, образующаяся при сворачивании белка.
Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот располагаются внутри белка, тогда как гидрофильные R-группы располагаются снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственная ковалентная связь, образующаяся при сворачивании белка.
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его в основном слипаться в шарообразную форму. Инсулин начинается как один полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи. Шелк (волокнистый белок), однако, имеет β – складчатая листовая структура, которая является результатом водородных связей между различными цепями.
Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его в основном слипаться в шарообразную форму. Инсулин начинается как один полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи. Шелк (волокнистый белок), однако, имеет β – складчатая листовая структура, которая является результатом водородных связей между различными цепями.
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) показаны на рисунке \(\PageIndex{9}\).
Рисунок \(\PageIndex{9}\): На этих иллюстрациях можно наблюдать четыре уровня структуры белка. (кредит: модификация работы Национального исследовательского института генома человека)Денатурация и сворачивание белков
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются вместе химическими взаимодействиями. Если белок подвержен изменениям температуры, pH или воздействию химических веществ, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в результате так называемой денатурации. Денатурация часто бывает обратимой, потому что первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, что позволяет белку возобновить свою функцию. Иногда денатурация необратима и приводит к потере функции. Одним из примеров необратимой денатурации белка является жарка яиц. Белок альбумин в жидком яичном белке денатурирует, когда его помещают на горячую сковороду. Не все белки денатурируют при высоких температурах; например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Если белок подвержен изменениям температуры, pH или воздействию химических веществ, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в результате так называемой денатурации. Денатурация часто бывает обратимой, потому что первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, что позволяет белку возобновить свою функцию. Иногда денатурация необратима и приводит к потере функции. Одним из примеров необратимой денатурации белка является жарка яиц. Белок альбумин в жидком яичном белке денатурирует, когда его помещают на горячую сковороду. Не все белки денатурируют при высоких температурах; например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции. Первоначально считалось, что сами белки ответственны за процесс фолдинга. Только недавно было обнаружено, что часто они получают помощь в процессе фолдинга от белков-помощников, известных как шапероны (или шаперонины), которые связываются с белком-мишенью во время процесса фолдинга. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и диссоциируют от белка, как только целевой белок свернут.
Первоначально считалось, что сами белки ответственны за процесс фолдинга. Только недавно было обнаружено, что часто они получают помощь в процессе фолдинга от белков-помощников, известных как шапероны (или шаперонины), которые связываются с белком-мишенью во время процесса фолдинга. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и диссоциируют от белка, как только целевой белок свернут.
Резюме
Белки представляют собой класс макромолекул, которые выполняют разнообразные функции в клетке. Они помогают в обмене веществ, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеры) являются аминокислоты. Каждая аминокислота имеет центральный углерод, который связан с аминогруппой, карбоксильной группой, атомом водорода и группой R или боковой цепью. Существует 20 часто встречающихся аминокислот, каждая из которых отличается группой R. Каждая аминокислота связана со своими соседями пептидной связью.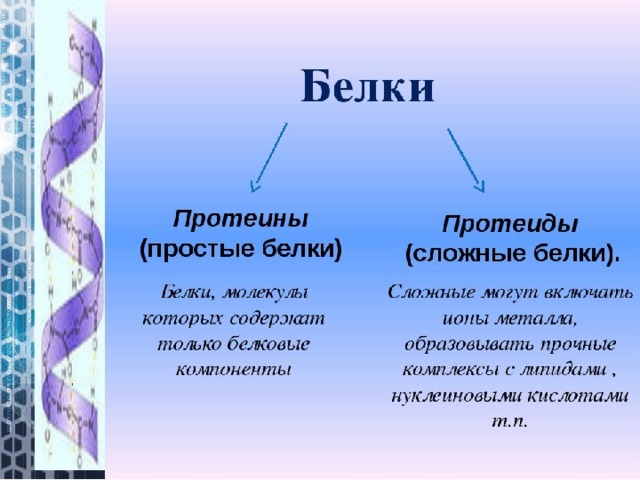 Длинная цепь аминокислот известна как полипептид.
Длинная цепь аминокислот известна как полипептид.
Белки организованы на четырех уровнях: первичном, вторичном, третичном и (необязательно) четвертичном. Первичная структура представляет собой уникальную последовательность аминокислот. Локальная укладка полипептида с образованием таких структур, как спираль α и складчатый лист β , составляет вторичную структуру. Общая трехмерная структура является третичной структурой. Когда два или более полипептида объединяются, образуя полную структуру белка, такая конфигурация известна как четвертичная структура белка. Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменением температуры или pH, может привести к денатурации белка и потере функции.
Art Connections
Рисунок \(\PageIndex{2}\): Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка и какие вы ожидаете найти внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в двойной липидный слой?
- Ответить
Полярные и заряженные аминокислотные остатки (остаток после образования пептидной связи) чаще обнаруживаются на поверхности растворимых белков, где они могут взаимодействовать с водой, а неполярные (например, боковые цепи аминокислот) чаще обнаруживаются внутри, где они изолированы от воды.
 В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, тогда как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако есть исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в лигандсвязывающем кармане.
В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, тогда как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако есть исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в лигандсвязывающем кармане.
Глоссарий
- структура альфа-спирали ( α -спираль)
- тип вторичной структуры белков, образованный свертыванием полипептида в форму спирали с водородными связями, стабилизирующими структуру
- аминокислота
- мономер протеина; имеет центральный углерод или альфа-углерод, к которому присоединена аминогруппа, карбоксильная группа, водород и группа R или боковая цепь; группа R различна для всех 20 аминокислот
- бета-складчатый лист ( β -складчатый)
- вторичная структура, обнаруженная в белках, в которых «складки» образуются за счет водородных связей между атомами в основной цепи полипептида
- сопровождающий
- (также шаперонин) белок, помогающий формирующемуся белку в процессе сворачивания
- денатурация
- потеря формы белка в результате изменения температуры, pH или воздействия химических веществ
- фермент
- катализатор биохимической реакции, который обычно представляет собой сложный или конъюгированный белок
- гормон
- химическая сигнальная молекула, обычно белок или стероид, секретируемая эндокринными клетками, которая контролирует или регулирует определенные физиологические процессы
- пептидная связь
- связь, образованная между двумя аминокислотами в результате реакции дегидратации
- полипептид
- длинная цепь аминокислот, связанных пептидными связями
- основная конструкция
- линейная последовательность аминокислот в белке
- белок
- биологическая макромолекула, состоящая из одной или нескольких цепочек аминокислот
- четвертичная структура
- объединение дискретных полипептидных субъединиц в белок
- вторичное строение
- регулярная структура, образованная белками за счет внутримолекулярной водородной связи между атомом кислорода одного аминокислотного остатка и водородом, присоединенным к атому азота другого аминокислотного остатка
- третичная структура
- трехмерная конформация белка, включая взаимодействия между вторичными структурными элементами; образуется из взаимодействий между боковыми цепями аминокислот
Эта страница под названием 12. 1.5: Proteins распространяется по незаявленной лицензии и была создана, изменена и/или курирована OpenStax.
1.5: Proteins распространяется по незаявленной лицензии и была создана, изменена и/или курирована OpenStax.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Показать оглавление
- нет
- Включено
- да
- Теги
- альфа-спираль
- альфа-спиральная структура
- Аминокислота
- бета-складчатый лист
- Сопровождающие
- Денатурация
- фермент
- гормон
- Пептидная связка
- Полипептид
- первичная структура
- белок
- четвертичная структура
- вторичная структура
- источник[1]-био-1791
- третичная структура
Примеры белка в биологии и питании
ОПИСАНИЕ
продукты с высоким содержанием белка
ИСТОЧНИК
белковая молекула: JUAN GAERTTY / LIARY PHONERTO/Science Library0032
РАЗРЕШЕНИЕ
Используется по лицензии Getty Images
Белки являются основным компонентом живых клеток. Они состоят из углерода, водорода, кислорода, азота и одной или нескольких цепочек аминокислот. Три структуры белков: волокнистые, глобулярные и мембранные , которые также могут быть разрушены функцией каждого белка. Продолжайте читать примеры белков в каждой категории и в каких продуктах вы можете их найти.
Они состоят из углерода, водорода, кислорода, азота и одной или нескольких цепочек аминокислот. Три структуры белков: волокнистые, глобулярные и мембранные , которые также могут быть разрушены функцией каждого белка. Продолжайте читать примеры белков в каждой категории и в каких продуктах вы можете их найти.
Волокнистые белки
Также называемые склеропротеинами, волокнистые белки образуют мышечные волокна, сухожилия, соединительную ткань и кости. Они имеют вытянутую форму и играют множество структурных ролей в организме. Основные типы волокнистых белков включают структурных белка и запасных белков .
Структурные белки
Их можно найти в волокнах гладкой и скелетной мускулатуры, а также в сердечной мышце вокруг сердца. Коллаген , например, является наиболее распространенным белком в организме человека и животных. Некоторые структурные белки также имеют сократительные функции, которые помогают в движении мышц.
Реклама
Описание
Диаграмма Коллаген в человеческой коже
Источник
Art IS ME / ISTock / Getty Images Plus
.
OF EASTER
32033303303030303010301030101010101010103013 годы. белки этой категории включают:
- актин – содержится в мышечных клетках и используется во время клеточных процессов
- коллаген – содержится в соединительной ткани и хрящах по всему телу
- дистрофин – связывает актин с другими белками в мышечных волокнах
 по всему телу и используется для движения
по всему телу и используется для движенияРеклама
Белки для хранения
Некоторые волокнистые белки хранят аминокислоты и ионы металлов для последующего использования. И у растений, и у животных в клетках есть запасные белки, хотя многие из них уникальны для разных организмов.
Примеры запасных белков:
- казеин – запасает аминокислоты в молоке животных и женщин
- ферритин – запасает железо в растениях и животных
- глиадин – запасает белок в пшенице; компонент глютена
- kafirin – found in sorghum and millet
- oryzin – found in rice
- ovalbumin – stores amino acids in egg whites
- zein – found in corn
Globular Proteins
The other Основная структура белка глобулярная. Глобулярные белки имеют сферическую форму и более растворимы в воде, чем другие классы белков. Они выполняют несколько функций, включая транспортировку, катализ и регулирование в организме. Антитела , ферменты , транспортные белки и многие виды гормонов являются примерами глобулярных белков.
Глобулярные белки имеют сферическую форму и более растворимы в воде, чем другие классы белков. Они выполняют несколько функций, включая транспортировку, катализ и регулирование в организме. Антитела , ферменты , транспортные белки и многие виды гормонов являются примерами глобулярных белков.
Реклама
Белки антител
Антитела , которые называются иммуноглобулинами, представляют собой белки, созданные вашей иммунной системой для борьбы с вредоносными захватчиками. Существует пять основных типов антител; однако их сайт связывания предназначен для борьбы с конкретным патогеном, включая вирусы и бактерии.
Примеры белков антител включают:
- Иммуноглобин А (IgA) – обнаружен в слюне и слезах из тканей слизистой оболочки для работы
- Иммуноглобин Е (IgE) – начинается аллергическая реакция при контакте с аллергеном
- Иммуноглобин G (IgG) – белок в большом количестве, который помечает патогены и высвобождает токсины для их уничтожения
- Иммуноглобин M (IgM) – запускает «память» патогена в вашей иммунной системе
Реклама
Ферментные белки
Белки, которые осуществляют биохимические реакции, называются ферментами.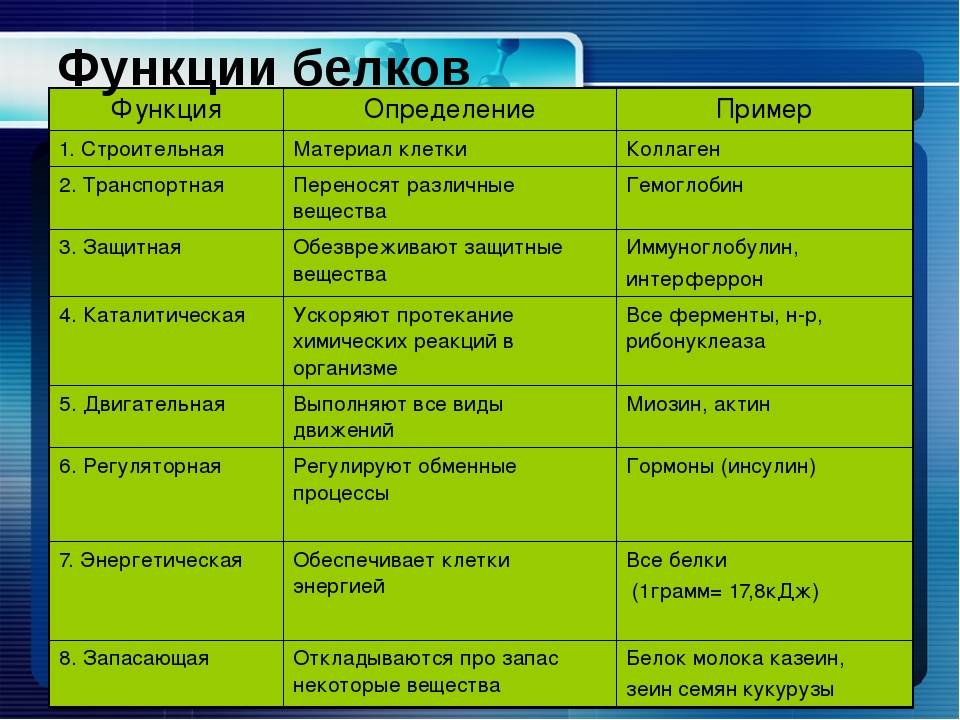 Они являются типом биологического катализатора, который поддерживает работу тела. Другие ферменты, называемые ингибиторами, замедляют реакции.
Они являются типом биологического катализатора, который поддерживает работу тела. Другие ферменты, называемые ингибиторами, замедляют реакции.
Некоторые примеры белков, выполняющих ферментативные функции, включают:
- c1-ингибитор – противовоспалительный белок
- Карбоксипептидаза – Создан в поджелудочной железе для пищеварительной помощи
- Гидролазы ферментов – Гидролиз катализируется в химических связях
- Helicase -DNASIPS DNA в течение 9000 3 333333333339 гг. липаза – расщепляет жиры в поджелудочной железе
- мальтаза – содержится в слюне; расщепляет сахара до глюкозы
- оксидоредуктазы – катализирует перенос электронов между молекулами
- тромбин – превращает белки крови в сгусток крови
- трипсин – расщепляет белки во время пищеварения
организме известны как белки-мессенджеры. Эти белки включают различные типы гормонов, которые могут передавать сигналы для координации процессов между частями тела. Они отличаются от стероидных гормонов, которые образуются из липидов, а не белков.
Эти белки включают различные типы гормонов, которые могут передавать сигналы для координации процессов между частями тела. Они отличаются от стероидных гормонов, которые образуются из липидов, а не белков.
Некоторые примеры белков-посредников включают:
- ангиотензин – поддерживает артериальное давление
- антидиуретический гормон (АДГ) – передает сигналы почкам для балансировки уровня воды в крови
- – контролирует дыхание и адреналин другие непроизвольные функции
- фолликулостимулирующий гормон (ФСГ) – контролирует стимуляцию яйцеклеток и сперматозоидов в женской и мужской репродуктивной системе
- инсулин – регулирует уровень глюкозы в крови
- норэпинефрин – контролирует реакцию организма на стресс
- окситоцин – регулирует эмоции, связанные с репродуктивной системой
- триптофан – регулирует цикл сна-бодрствования в организме
Транспортные белки
Когда атомы должны пройти через клеточную мембрану, это может сделать транспортная мембрана. Эти типы белков, также известные как эскорт-белки, помогают в клеточном транспорте.
Эти типы белков, также известные как эскорт-белки, помогают в клеточном транспорте.
They include:
- albumin – transports hormones and vitamins in the bloodstream
- alpha globulin – found in blood plasma
- beta globulin – functions as a transport and an enzyme
- hemoglobin – переносит кислород от легких к тканям тела
- гемопексин – переносит гем в плазме крови
- миоглобин – переносит и хранит кислород из гемоглобина
- трансферрин – доставляет железо к различным органам тела
Мембранные белки
Мембранные белки находятся внутри мембран клеток. Они помогают выполнять многие клеточные функции, включая транспортировку веществ через мембрану и прикрепление клеток к другим структурам.
(CC BY-ND 4.0)
ОПИСАНИЕ
диаграмма переносчика глюкозы
ИСТОЧНИК
Создано Beth Wiggins для YourDictionary
разрешение
, принадлежащая YourDictionary, Copyright Yourdictionary
Примеры мембранного белка –
- Переводящий.
 гормоном эстрогеном
гормоном эстрогеном - Forkhead Box P2 (FOXP2) – обнаружен в основных органах, включая мозг и сердце
- Forkhead Box P3 (FOXP3) – регулирует активацию Т-клеток
- переносчик глюкозы – переносит глюкозу через мембрану
- гистоны – упаковывает ДНК в клетки и хромосомы
- интегрин – прикрепляет клетки к другим клеткам 3 селектины клетки в другие клетки в кровотоке
Продукты с высоким содержанием белка
В вашем организме есть множество различных типов белков, которые естественным образом встречаются в вашем организме. Тем не менее, вам необходимо включить в свой рацион продукты, богатые белком, чтобы поддерживать баланс биологических белков.
Вот примеры белков в пищевых продуктах с указанием количества граммов белка на 100 граммов:
- Соевые бобы – 35,9г
- Сыр – 30,9г
- Оленина – 30,21
- Семена тыквы – 30,21
- Семена лобстера 60 9018г
- Консервированная рыба из тунца – 26,3 г
- Тунец рыба – 25,6 г
- Monkfish – 24G
- Хрустящий арахисовое масло – 24,9 г
- Тилапия – 24G
- Куриная грудь без кожи – 23,5G
- Семена подсолнека – 23.
 0010
0010 - Orange roughy – 22.64g
- Skinless turkey breast – 22.3g
- Boneless salmon fillets – 21.6g
- Sardines – 21.5g
- Almonds – 21.1g
- Beef fillet – 20.9
- Lamb steak – 19.9g
- Pork chops – 19.3g
- Crab meat – 18.1g
- Cod – 17.9g
- Shrimp – 17.0g
- Haddock – 16.4g
- Bacon – 15.9g
- Couscous – 15.1g
- Anchovies – 14.5g
- Свиные колбаски – 13,9g
- Eggs – 12.5g
- Pasta – 12.5g
- Goji berries – 12.3g
- Cottage cheese – 12.2g
- Tofu – 12.1g
- Pepperoni pizza – 11.4g
- Whole grain bread – 11.0g
- Porridge oats – 11.0g
- Baked beans – 9.5g
- Hummus – 7.4g
- Brown rice – 6.9g
- Peas – 5.9g
- Spaghetti – 5.1g
- Yogurt – 4.5g
- Broccoli – 4.2g
- Кокос — 3,33 г
- Цельное молоко — 3,3 г
- Аспарига – 2,9 г
- Шпинат – 2,8 г
- Картофель – 2,1 г
- Авокадо – 1,9 г
- бананы – 1,2 г
- Оранжевый – 1,1 г
Сборники и бобовые
Вы строгий веган, фасоль и бобовые – отличное место, где можно найти белок. Ознакомьтесь с этими простыми способами добавить белок в свой рацион.
Ознакомьтесь с этими простыми способами добавить белок в свой рацион.
- Тофу (½ чашки) — 20 г
- Соевое молоко (1 чашка) — от 6 до 10 г
- Соевые бобы (½ чашки, приготовленные) — 14 г
- Горох (½ стакана приготовленного) — 8 г
- Другие бобы, такие как черная, пинто, чечевица (1/2 стакана) — от 7 до 10 г
Яйца и молочные продукты
Возможно, вы знаете, что молочные продукты являются хорошими источниками кальция. , а белок тоже? И яйца, и молочные продукты являются полезными способами увеличить потребление белка.
- Яйцо (1 большое) — 6 г
- Творог (½ стакана) — 15 г
- Молоко (1 стакан) — 8 г
- Йогурт (1 стакан) — от 8 до 12 г 1 унция) – 6 г
- Средние сыры, такие как чеддер и швейцарский (1 унция) — от 7 до 8 г
- Твердые сыры, такие как пармезан (1 унция) — 10 г
- Йогурт — 4,5 г
Орехи и семена
Горсть орехов может вам помочь много! Эти орехи и семена являются отличными источниками белка, когда вы в пути.
- Миндаль (¼ чашки) — 8 г
- Кешью (¼ чашки) — 5 г
- Семена льна (¼ чашки) — 8 г
- Арахисовое масло (2 столовые ложки) — 8 гг
- Орехи пекан (¼ чашки) — 2,5 г
- Семена тыквы (¼ чашки) — 8 г
- Семечки подсолнуха (¼ чашки) — 6 г белка в вашем рационе. Если вы формируете диету без мяса, вам нужно заменить большое количество белка, содержащегося в небольшой порции мяса и птицы.
- Котлета для гамбургера (4 унции) — 28 г
- Стейк (6 унций) — 42 г
- Оленина (6 унций) — 30,21 г
- Куриная грудка (3,5 унции) – 30 г
- Куриное бедро – 10 г
- Голень – 11 г
- Крыло – 6 г
- Куриное мясо (4 унции приготовленное) – 35 г 9 0 9 0 30 Свиная отбивная (2 г среднего размера) Корейка или вырезка (4 унции) — 9 г
- Ветчина (3 унции) — 19 г
- Свиной фарш (3 унции, приготовленная) — 22 г
- Бекон, 1 ломтик — 3 г
- Бекон по-канадски (ломтик) — от 5 до 6 г
Рыба и морепродукты
Морепродукты — отличный источник нежирных жиров и белков.

 Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина;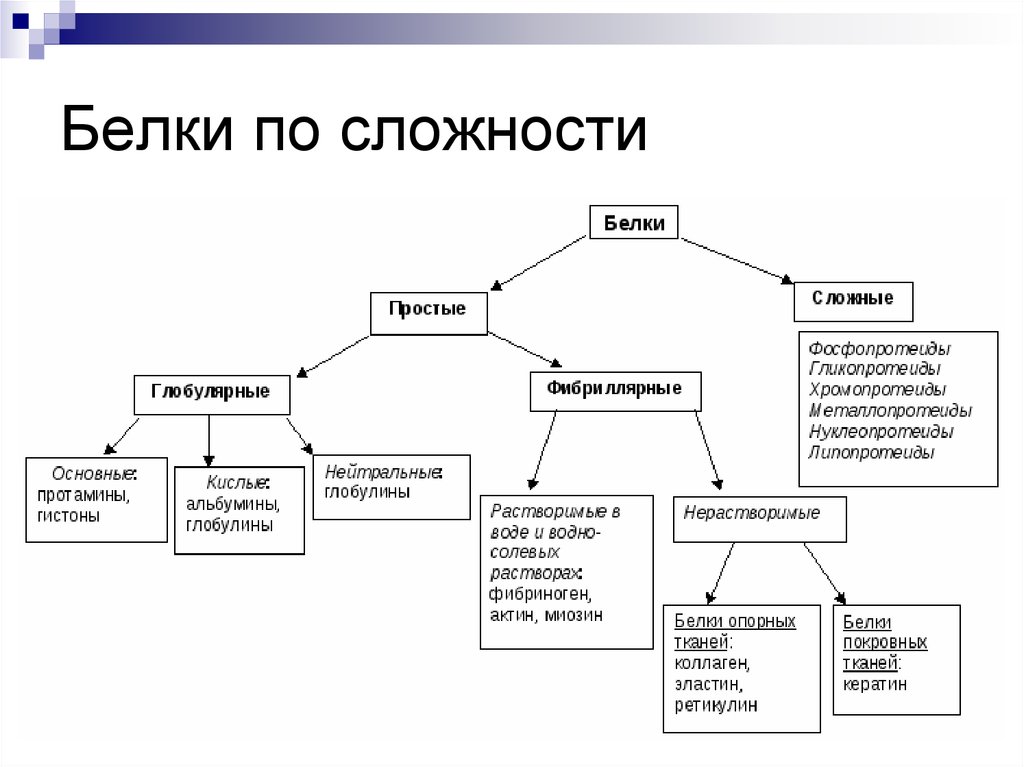 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.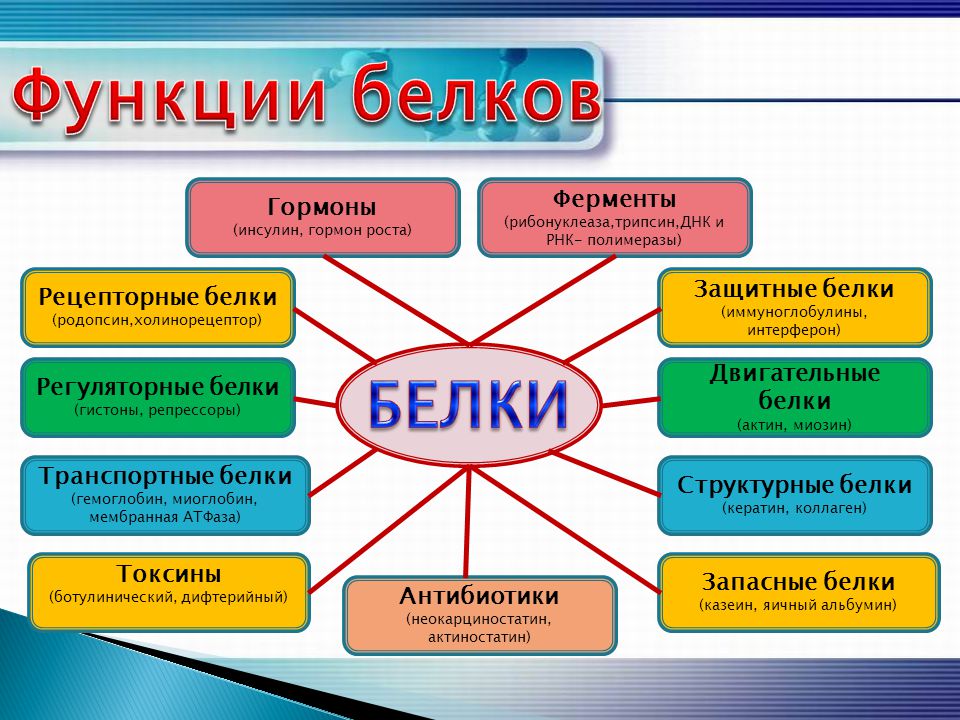 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде; Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа. Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы. В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, тогда как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако есть исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в лигандсвязывающем кармане.
В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, тогда как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако есть исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в лигандсвязывающем кармане. гормоном эстрогеном
гормоном эстрогеном 0010
0010