Характеристика аминокислоты: Общая характеристика. – Аминокислоты – Азотосодержащие органические соединения – Органическая химия
Общая характеристика. – Аминокислоты – Азотосодержащие органические соединения – Органическая химия
11 января 2007
Многие биологически активные молекулы включают несколько химически различных функциональных групп, способных к взаимодействию между собой или с функциональными группами других молекул. Один из примеров — моносахариды, в состав которых входят несколько гидроксильных групп и одна карбонильная группа. Другой важный пример бифункциональных природных соединений — аминокислоты.
Аминокислоты – это органические бифункциональные соединения, в состав которых входят карбоксильная группа -СООН и аминогруппа -NН2. В зависимости от взаимного расположения обеих функциональных групп различают α-, β-, γ-аминокислоты:
β α β α
α-аминопропионовая β-аминопропионовая
кислота кислота
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
В состав белков входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные названия.
Иминокислота пролин (молекулярная формула C5H9NO2) имеет структуру
Простейшая аминокислота — глицин (аминоуксусная кислота). Остальные природные аминокислоты можно разделить на следующие основные группы:
α-Аминокислоты общей формулы
| Аминокислота | Обозначение (трёх- и одно- буквенное) | –R | Молеку-лярная формула |
| Глицин | Gly(G) | -H | C2H5NO2 |
Аланин | Ala(A) | -CH3 | C3H7NO2 |
Валил | Val(V) | -CH(CH3)2 | C5H11NO2 |
Лейцин | Leu(L) | -CH2-CH(CH3)2 | C6H13NO2 |
Изолейцин | -CH2-CH(CH3)-C2H5 | C7H15NO2 | |
Цистеин | Cys(C) | -CH2-SH | C3H7SNO2 |
Метионин | Met(M) | -CH2-CH2-S-CH3 | C5H11SNO2 |
Серин | Ser(S) | -CH2-OH | C3H7NO3 |
Треонин | Thr(t) | -CH(OH)-CH3 | C4H9NO3 |
Фенилаланин | Phe(F) | -CH2-C6H5 | C9H11NO2 |
Тирозин | Tyr(Y) | C9H11NO3 | |
Триптофан | Trp(W) | C11H12N2O2 | |
Аспарагиновая кислота | Asp(D) | –CH2COOH | C4H7NO4 |
Глутаминовая кислота | Glu(E) | -CH2-CH2-COOH | C5H9NO4 |
Аспарагин | Asn(N) | -CH2-CO-NH2 | C4H8N2O3 |
Глутамин | Gln(Q) | -CH2-CH2-CO-NH2 | C5H10N2O3 |
Гистидин | His(H) | C6H9N3O2 | |
| Лизин | Lys(K) | -(CH2)4-NH2 | C6H14N2O2 |
Аргинин | Arg(R) | C6H14N4O2 |
1) гомологи глицина — аланин, валин, лейцин, изолейцин;
2) серосодержащие аминокислоты — цистеин, метионин;
3) аминокислоты с алифатической гидроксильной группой — серин, треонин;
4) ароматические аминокислоты — фенилаланин, тирозин, триптофан;
5) аминокислоты с кислотным радикалом — аспарагиновая и глутаминовая кислоты;
6) аминокислоты с амидной группой — аспарагин, глутамин;
7) аминокислоты с основным радикалом — гистидин, лизин, аргинин.
Аминокислоты для оптимального синтеза кишечного муцина (слизи) и защиты кишечника в здоровом и патологическом состояниях
Департамент питания и здравоохранения Лозанна, Швейцария
Электронная почта: [email protected]
Список сокращений
ASR: Cкорость абсолютного синтеза ( Absolute Synthesis Rate)
ВЗК: Воспалительные заболевания кишечника
FSR: Скорость фракционного синтеза (Fractional Synthesis Rate)
MUC2: муцин-2 ген
Muc2: муцин-2 протеин
Обзор
Требования к количественному и качественному аминокислотному составу определены для здоровых животных. В патологических ситуациях, включая воспаление кишечника, защита организма связана с анаболическими реакциями, вовлекающими внутренние органы и особенно кишечник. Процессы защиты и восстановления кишечника резко увеличивают скорость синтеза белков, участвующих в барьерной функции кишечника, таких как муцины.
Введение
Желудочно-кишечный тракт является одним из наиболее активных в метаболическом отношении органов организма, что отражает его многочисленные важнейшие биологические функции. В то время как желудочно-кишечный тракт составляет от 3% до 6% массы тела млекопитающих, на его долю приходится более 20% оборота белка всего тела. Это происходит главным образом из-за высокой скорости синтеза белка и непрерывной высокой секреторной активности. Таким образом повышается необходимость в определенных аминокислотах, необходимых для синтеза белка. Такое высокое требование было приписано поддержке неспецифического кишечного барьера, в частности синтеза кишечных муцинов.
Неиммунный кишечный барьер
Защита кишечника обеспечивается как кишечной иммунной системой, так и физическим, неиммунным кишечным барьером. Кишечный барьер обеспечивает защиту от внешней среды (кишечных патогенов, вредных агентов и др.) пока происходит адекватная абсорбция питательных веществ для снабжения ими всего организма. Нормальная функция барьера базируется на близком взаимодействии нескольких компонентов. Ключевыми компонентами являются: равновесие комменсальной кишечной микробиоты, которая противодействует адгезии потенциально патогенных бактерий; слой кишечной слизи, который покрывает и защищает эпителиальные клетки; сам кишечный эпителий, обеспечивающий разделение между внутрипросветным содержимым и нижележащими тканями; клетки Панэта, продуцирующие антимикробные пептиды; плотные контакты между эпителиальными клетками, способствующие модуляции парацеллюлярных путей; и кишечная нервная система, недавно признанная ключевым регулятором целостности эпителиального барьера.
Сложные регуляторные механизмы обеспечивают тонкое равновесие между различными компонентами неиммунного кишечного барьера. Оптимальная диетическая поддержка имеет решающее значение для обеспечения кишечного гомеостаза, способствуя поддержанию здоровья всего организма и предотвращая заболевания, связанные с желудочно-кишечным трактом.
Состав и роль кишечной слизи
Желудочно-кишечный эпителий покрыт вязкоупругим гелеобразным слоем слизи, состоящим из: сложной смеси гликопротеинов, называемых муцинами; пептидов, включая трефойловый пептид (фактор “трилистника”) и антимикробные пептиды; воды; макромолекул, таких как секреторный иммуноглобулин А; электролитов; микроорганизмов; и отшелушенных клеток. Гелеобразная слизь представляет собой первую линию врожденной защиты хозяина; одной из его основных функций является защита эпителиальных поверхностей от механических нагрузок и воздействия пищеварительных соков, микроорганизмов и токсинов. Ее защитный эффект напрямую связан с его толщиной и составом.
Толщина слоя слизи, ее состав и защитное действие изменяются в желудочно-кишечном тракте по всей его длине в результате дифференциальной выработки различных отдельных муцинов и динамического баланса между анаболическими (экспрессия, синтез и секреция из бокаловидных клеток) и катаболическими (физическая и протеолитическая деградация) процессами. В желудке и толстой кишке определяется самый толстый слой слизи, необходимый для того, чтобы обеспечить хорошую защиту от кислого субстрата (желудок) и микробиоты (толстая кишка). В тонком кишечнике – напротив, он самый тонкий, вероятно, чтобы не препятствовать усвоению питательных веществ.
Внутренний, прочно прикрепленный слой слизи, состоящий из мембраносвязанных муцинов, прилипает к апикальной стороне эпителиальных клеток и способствует образованию гликокаликса, полисахаридного матрикса, покрывающего поверхность эпителиальных клеток кишечника.
Растворимый, слабо прикрепленный наружный слой слизи, состоящий из секретируемых гелеобразующих муцинов, покрывает внутренний слой слизи. Этот растворимый слой способствует созданию и поддержанию баланса комменсальной микробиоты, которая противостоит потенциально патогенным бактериям.
Характеристика кишечных муцинов
На сегодняшний день идентифицирован 21 ген муцина, из которых 15 экспрессируются в желудочно-кишечном тракте человека. Муцины кишечника обладают некоторыми особенностями строения. Это обычно крупные полипептиды (10% -20% от общей массы муцина), которые очень сильно гликозилированы (до 80% -90% от массы муцина). Олигосахаридные боковые цепи в основном состоят из N-ацетилгалактозамина, N-ацетилглюкозамина, галактозы и фукозы, связанных преимущественно с сериновыми и треониновыми остатками муцинового полипептидного ядра через O-гликозидные связи. Посттрансляционные модификации, включая сиалирование и сульфатирование, завершают макромолекулу.
Размер полипептида муцина обычно колеблется от 200 КДА до 900 КДА, за исключением слюнной формы MUC7 (39 КДА). По сравнению с другими белками млекопитающих муцины особенно обогащены аминокислотами треонином, серином и пролином, которые составляют до 28%, 14% и 13% соответственно от общего аминокислотного состава муцинов. Для сравнения, среднее содержание треонина в белках организма колеблется от 3% до 7% от общего количества аминокислот. Остатки треонина, серина и пролина концентрируются в центральных тандемных повторах PTS (proline, threonine, serine), состоящих из консервативных последовательностей, повторенных примерно 100 раз. Насыщенные цистеином домены также присутствуют на полипептидах муцина. Они позволяют муцинам собираться в гомо-олигомеры через межмолекулярные дисульфидные связи, образованные между богатыми цистеином доменами, которые придают вязкоупругое защитное свойство гелеобразной слизи.
По сравнению с другими белками млекопитающих муцины особенно обогащены аминокислотами треонином, серином и пролином, которые составляют до 28%, 14% и 13% соответственно от общего аминокислотного состава муцинов. Для сравнения, среднее содержание треонина в белках организма колеблется от 3% до 7% от общего количества аминокислот. Остатки треонина, серина и пролина концентрируются в центральных тандемных повторах PTS (proline, threonine, serine), состоящих из консервативных последовательностей, повторенных примерно 100 раз. Насыщенные цистеином домены также присутствуют на полипептидах муцина. Они позволяют муцинам собираться в гомо-олигомеры через межмолекулярные дисульфидные связи, образованные между богатыми цистеином доменами, которые придают вязкоупругое защитное свойство гелеобразной слизи.
Среди 15 муцинов, экспрессируемых в желудочно-кишечном тракте человека, MUC2, MUC5AC, MUC5B, MUC6, MUC7 и MUC19 секретируются в основном специализированными бокаловидными клетками. В тонком и толстом кишечнике MUC2 является преобладающим гелеобразующим муцином. Его важная роль в защите эпителия толстой кишки от колита была четко продемонстрирована на модели мышей с дефицитом Muc2. MUC1, MUC3A, MUC3B, MUC4, MUC12, MUC13, MUC15, MUC16 и MUC17 являются мембраносвязанными муцинами, экспрессируемыми клетками эпителия слизистой оболочки желудочно-кишечного тракта человека.
Его важная роль в защите эпителия толстой кишки от колита была четко продемонстрирована на модели мышей с дефицитом Muc2. MUC1, MUC3A, MUC3B, MUC4, MUC12, MUC13, MUC15, MUC16 и MUC17 являются мембраносвязанными муцинами, экспрессируемыми клетками эпителия слизистой оболочки желудочно-кишечного тракта человека.
В тонком и толстом кишечнике MUC3, MUC4, MUC13 и MUC17 являются преобладающими мембраносвязанными формами. Они простираются над поверхностью клетки и образуют гликокаликс. Предполагается, что мембранные муцины занимают особое место в антиадгезивных и сигнальных механизмах, восстановлении клеток кишечника и защите эпителиальных клеток от инфекции.
Для обеспечения адекватной экспрессии и секреции муцина, необходимого для оптимальной защиты кишечника применяются сложные регуляторные механизмы. Было выявлено, что эти механизмы включают нейронные, гормональные и паракринные пути. Статус питания, который позволяет обеспечить достаточное количество аминокислот, необходимых для синтеза муцина и микробиоты также является ключевым регулятором защиты кишечника.
Нарушения обмена веществ при заболеваниях кишечника ослабляют выработку муцина и защиту кишечника
Многие кишечные заболевания, предполагающие хроническое воспаление, такие как воспалительные заболевания кишечника (ВЗК), связаны с дисфункцией кишечного барьера. Два основных типа ВЗК – язвенный колит и болезнь Крона, сопровождаются повышением проницаемости тонкой и толстой кишки. Среди изменений, наблюдаемых на уровне кишечного барьера, были отмечены изменение состава микробиоты кишечника и качественное и количественное ухудшение слизистого слоя и продукции муцина. В частности, синтез зрелой, гликозилированной формы MUC2, первичного муцина, секретируемого в толстой кишке, снижается у больных язвенным колитом, что ухудшает слизистый барьер.
Сообщалось также об аномальном выделении секретируемых в ЖКТ муцинов в подвздошной и ободочной кишках, что может отражать адаптивный ответ на усиление защитной реакции. Было отмечено, что ухудшение защиты эпителия сопровождалось снижением выделения мембраносвязанных муцинов MUC3, MUC4 и MUC17. Однако, и это интересно, экспрессия MUC13, выделяемого для ингибирования индуцированного токсинами апоптоза клеток эпителия толстой кишки, как было показано, увеличивается в биоптатах воспаленной слизистой оболочки толстой кишки, отражая защитный механизм, который, тем не менее, остается недостаточным для поддержания или восстановления функции кишечного барьера.
Однако, и это интересно, экспрессия MUC13, выделяемого для ингибирования индуцированного токсинами апоптоза клеток эпителия толстой кишки, как было показано, увеличивается в биоптатах воспаленной слизистой оболочки толстой кишки, отражая защитный механизм, который, тем не менее, остается недостаточным для поддержания или восстановления функции кишечного барьера.
Метаболические нарушения, связанные с острыми системными воспалительными реакциями, наблюдаемыми, например, при сепсисе, также влияют на барьерную функцию кишечника. Острое воспаление стимулирует синтез белков острой фазы в печени и слизистых оболочках, а также муцинов в кишечнике. Эти анаболические реакции являются важными адаптациями, направленными на обеспечение защиты организма от первичных и вторичных патологических воздействий. Таким образом, ключевым фактором инициации и поддержания подобных защитных сил организма является способность хозяина поддерживать стимуляцию синтеза белка. В этом контексте наблюдается сильное увеличение потребности в аминокислотах, особенно, присутствующих в муцинах в большом количестве.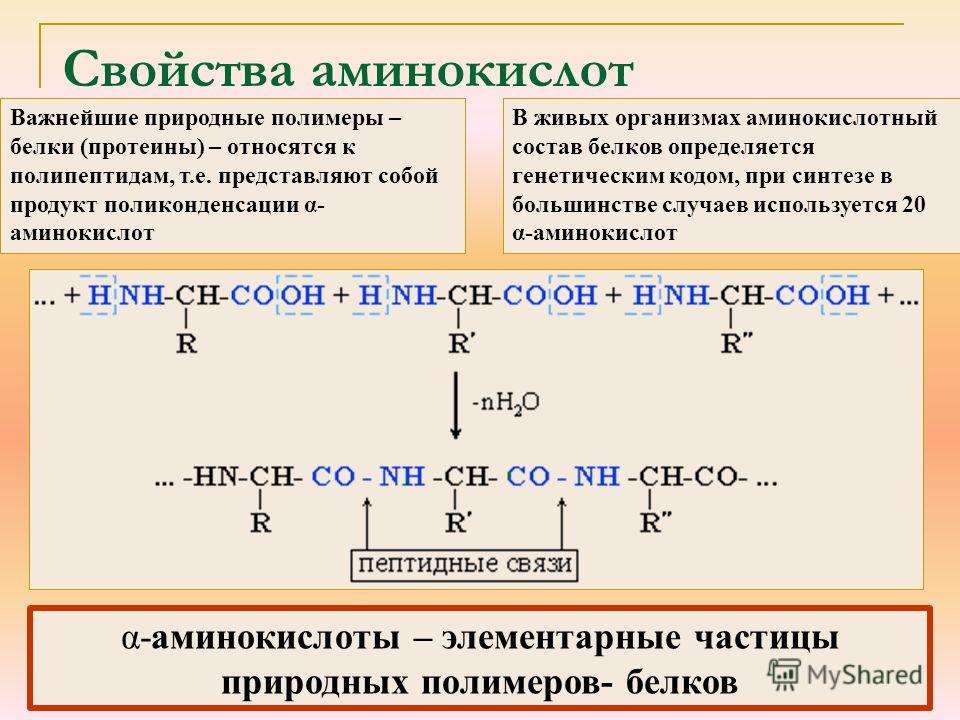 В болезненном состоянии потребление пищи часто снижается, и запас пищевых аминокислот слишком низок, чтобы удовлетворить метаболический спрос. При этом организм использует аминокислоты, полученные путем катаболизма мышц.
В болезненном состоянии потребление пищи часто снижается, и запас пищевых аминокислот слишком низок, чтобы удовлетворить метаболический спрос. При этом организм использует аминокислоты, полученные путем катаболизма мышц.
Требования к аминокислотам для оптимального синтеза муцина и защиты кишечника
Желудочно-кишечный тракт составляет от 3% до 6% массы тела млекопитающих, в то время как на его долю приходится более 20% всего оборота белка в организме. Это связано с его высокой пролиферативной и секреторной активностью, которые поддерживают неиммунную барьерную функцию кишечника, в частности быстрое обновление эпителиальных клеток и непрерывный синтез кишечных муцинов. Аминокислотный состав синтезируемых и секретируемых белков в значительной степени влияет на аминокислотные потребности кишечника, которые должны быть обеспечены при помощи питания и эндогенным синтезом (при недостатке аминокислот).
В нормальных условиях
Треонин является незаменимой аминокислотой, что означает, что он не может быть синтезирован организмом и поэтому должен поступать с пищей. В нормальных условиях треонин является ключевой аминокислотой для поддержания здоровья кишечника. Действительно, по сравнению с другими незаменимыми аминокислотами, большая доля пищевого треонина (до 60%) остается в здоровом кишечнике свиньи или человека. Поскольку основной белок кишечных муцинов содержит большое количество треонина (до 30% от их аминокислотного состава), их непрерывный синтез объясняет высокую скорость утилизации треонина желудочно-кишечным трактом. Размышляя в том же направлении, недостаток Muc2 у подопытных мышей действительно индуцирует метаболическое окисление неиспользованного треонина, которое связано с его избыточным поступлением, происходящим в отсутствие синтеза Muc2.
В нормальных условиях треонин является ключевой аминокислотой для поддержания здоровья кишечника. Действительно, по сравнению с другими незаменимыми аминокислотами, большая доля пищевого треонина (до 60%) остается в здоровом кишечнике свиньи или человека. Поскольку основной белок кишечных муцинов содержит большое количество треонина (до 30% от их аминокислотного состава), их непрерывный синтез объясняет высокую скорость утилизации треонина желудочно-кишечным трактом. Размышляя в том же направлении, недостаток Muc2 у подопытных мышей действительно индуцирует метаболическое окисление неиспользованного треонина, которое связано с его избыточным поступлением, происходящим в отсутствие синтеза Muc2.
И наоборот, когда поступление треонина с пищей ниже потребности, треонин может стать лимитирующей аминокислотой для синтеза кишечных муцинов, как показано на крысах и свиньях и поросятах. Действительно, было определено, что скорость фракционного синтеза муцина, определяемая как % муцинов, синтезируемых в сутки, уменьшается наполовину в верхней части тонкого кишечника крыс, получавших диету, покрывающую только 30% их потребности в треонине (Рис.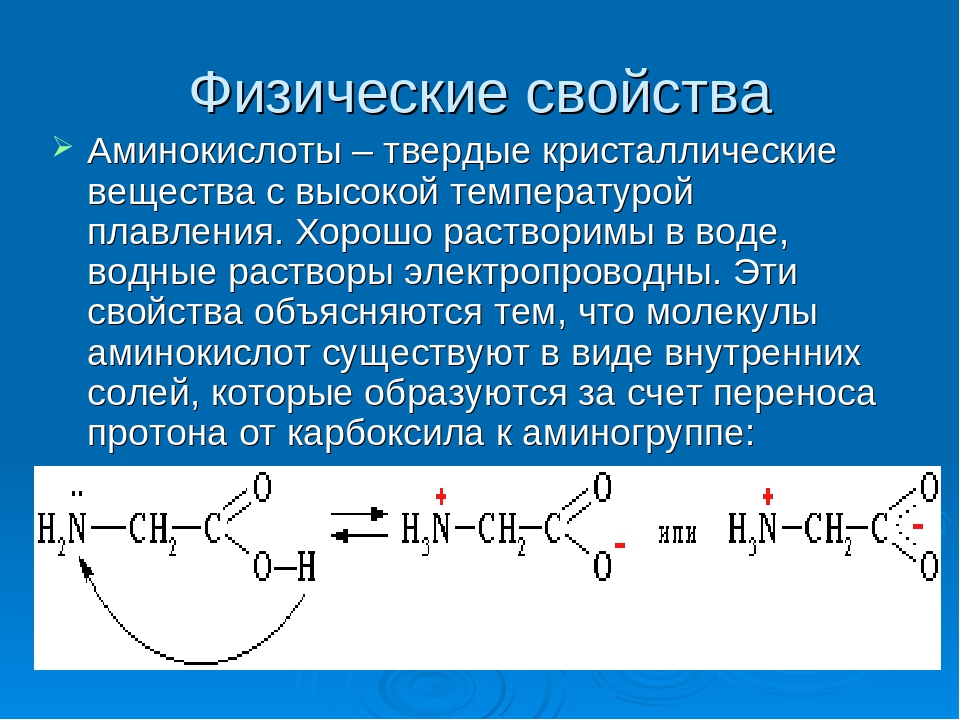 1). Тем не менее, такой дефицит не оказывает существенного ограничивающего влияния на общий синтез белка слизистой оболочки (Рис.1), причем эти остальные белки слизистой содержат примерно в семь раз меньше треонина, чем Muc2. Поскольку муцины особенно устойчивы к действию пищеварительных ферментов, рециркуляция треонина из муцинов, секретируемых в верхних отделах желудочно-кишечного тракта, очень низка, а его потеря очень высока по отношению к потребности в треонине всего организма. В здоровых условиях крайне важно, чтобы поступление треонина с пищей точно соответствовало потребностям в нем организма, поддерживая таким образом оптимальный синтез муцина и защиту кишечника, способствуя общему здоровому состоянию организма и предотвращая заболевания, связанные с кишечником.
1). Тем не менее, такой дефицит не оказывает существенного ограничивающего влияния на общий синтез белка слизистой оболочки (Рис.1), причем эти остальные белки слизистой содержат примерно в семь раз меньше треонина, чем Muc2. Поскольку муцины особенно устойчивы к действию пищеварительных ферментов, рециркуляция треонина из муцинов, секретируемых в верхних отделах желудочно-кишечного тракта, очень низка, а его потеря очень высока по отношению к потребности в треонине всего организма. В здоровых условиях крайне важно, чтобы поступление треонина с пищей точно соответствовало потребностям в нем организма, поддерживая таким образом оптимальный синтез муцина и защиту кишечника, способствуя общему здоровому состоянию организма и предотвращая заболевания, связанные с кишечником.
Схема 1. Скорость фракционного синтеза (FSR), выраженный в %/сутки, муцинов и общих белков слизистой оболочки в верхнем тонком кишечнике (а) и толстом кишке (Б) крыс, получавших полусинтетические диеты, удовлетворяющие 30%, 60% или 100% их потребности в треонине для роста. Рационы были изонитрогенными (скорректированными с аланином) и вводились крысам в течение 14 дней. Все группы крыс получали питание парно для усреднения потребления крысами из группы 30%. Синтез белка in vivo измеряли с использованием метода флудинг-доз после инъекции L-(1-13C) – валина. Значения-средние ± SEM, n=8. Для каждой составляющей кишечника (муцины или белки слизистой оболочки).
Рационы были изонитрогенными (скорректированными с аланином) и вводились крысам в течение 14 дней. Все группы крыс получали питание парно для усреднения потребления крысами из группы 30%. Синтез белка in vivo измеряли с использованием метода флудинг-доз после инъекции L-(1-13C) – валина. Значения-средние ± SEM, n=8. Для каждой составляющей кишечника (муцины или белки слизистой оболочки).
При воспалительных заболеваниях
Как показано на моделях животных и людях, воспалительные ситуации, такие как наблюдаемые при ВЗК (хроническое воспаление) и сепсис (острое воспаление), связаны с общей повышенной анаболической реакцией, происходящей в основном в кишечнике и печени, соответственно. Этот анаболический ответ увеличивает использование аминокислот, в частности, присутствующих в больших количествах в кишечных и печеночных протеинах. Поэтому потребности в треонине и других аминокислотах, таких как серин и цистеин, сильно повышаются. Доступность первично лимитирующих (треонин) и вторично лимитирующих (серин, цистеин) аминокислот для синтеза кишечных муцинов, может оказаться слишком низка из-за недостаточного качества питания (недостаточный уровень этих аминокислот) и количества (плохой аппетит) потребления пищи. Например, через два дня после заражения было показано, что использование треонина для синтеза муцинов в кишечнике крыс на 70% больше, чем у крыса контрольной группы. В целом, суточное абсолютное потребление треонина для синтеза белков кишечника (стенки кишечника) и белков плазмы (минус альбумин) увеличилось на 23%, что в 2,6 раза превышало пищевое потребление. Аналогичным образом, пролин, который хорошо представлен в составе кишечных муцинов (13% 3,48 по сравнению с 4% -7% в белках организма, кроме коллагена), также может служить вторичной лимитирующей аминокислотой для синтеза муцина.
Например, через два дня после заражения было показано, что использование треонина для синтеза муцинов в кишечнике крыс на 70% больше, чем у крыса контрольной группы. В целом, суточное абсолютное потребление треонина для синтеза белков кишечника (стенки кишечника) и белков плазмы (минус альбумин) увеличилось на 23%, что в 2,6 раза превышало пищевое потребление. Аналогичным образом, пролин, который хорошо представлен в составе кишечных муцинов (13% 3,48 по сравнению с 4% -7% в белках организма, кроме коллагена), также может служить вторичной лимитирующей аминокислотой для синтеза муцина.
Таким образом, при воспалительных состояниях необходима адекватная и хорошо сбалансированная нутритивная поддержка для стимуляции защитного ответа, механизмов регенерации и, следовательно, поддержания или восстановления эффективной барьерной функции кишечника. Определение “адекватного и хорошо сбалансированного питания” будет зависеть от метаболического состояния, связанного с болезнью, и определенно будет разниться с таковым для здорового состояния.
Как ранее наблюдалось в моделях животных с ВЗК, кишечная продукция муцина не усиливалась с помощью здорового, сбалансированного питания. Однако было показано, что увеличение содержания треонина, серина, пролина и цистеина в рационе крыс на модели колита эффективно способствует синтезу муцина толстой кишки в зависимости от дозы, не оказывая при этом влияния на общие белки слизистой оболочки (Рис.2).Более высокая доза аминокислот увеличивала присутствие Muc2-содержащих бокаловидных клеток в поверхностном эпителии изъязвленной области. Она также способствовала росту всех тестируемых популяций комменсальных бактерий, включая лактобацилл.
Схема 2. Скорость абсолютного синтеза (ASR), выраженные в мг/сут, муцинов и белков слизистой оболочки в толстой кишке крыс, получавших декстран сульфат натрия (DSS). Крыс кормили в течение 28 дней изонитрогенными (скорректированными с аланином) полусинтетическими порошковыми диетами, обеспечивающими следующие уровни состава по сравнению с потребностями крыс: DSSM1; двукратное увеличение треонина, пролина, серина и цистеина; DSSM2; четырехкратное увеличение треонина и пролина; и трехкратное увеличение серина и цистеина. Значения-средние ± SEM (n=8). Для каждой составляющей кишечника (муцины или белки слизистой оболочки) средства без общей буквы различаются, Р
Значения-средние ± SEM (n=8). Для каждой составляющей кишечника (муцины или белки слизистой оболочки) средства без общей буквы различаются, Р
Вывод
Содержание аминокислот треонина, серина, пролина и цистеина относительно высоки в составе кишечных муцинов, что отчасти объясняет их высокое потребление кишечником. А значит адаптированная диетическая поддержка с точным регулированием количества этих четырех аминокислот, имеет решающее значение для поддержания эффективной барьерной функции кишечника. Патологические ситуации, включая воспаление кишечника, процессы защиты кишечника и восстановление тканей, еще больше увеличивают потребность организма в перечисленных выше аминокислотах. В таких ситуациях рекомендуется увеличить поступление с пищей треонина, серина, пролина и цистеина, чтобы стимулировать синтез муцина, способствовать росту и равновесию комменсальной микробиоты и, таким образом усилить неспецифическую неиммунную функцию кишечного барьера.
Автор перевода: Анатолий Черников – главный ветеринарный врач, Клиника «101 Далматинец», Москва
Список литературы
1. Reeds PJ, Burin DG, Stoll B, van Goudoever JB. Consequences and regulation of gut metabolism. In Lobley GE, White A, MacRae JC (eds). Proceedings of the VIIIth International Symposium on Protein Metabolism and Nutrition. Aberdeen, UK. Wageningen Press, Wageningen, Netherlands. 1999:127–153.
Reeds PJ, Burin DG, Stoll B, van Goudoever JB. Consequences and regulation of gut metabolism. In Lobley GE, White A, MacRae JC (eds). Proceedings of the VIIIth International Symposium on Protein Metabolism and Nutrition. Aberdeen, UK. Wageningen Press, Wageningen, Netherlands. 1999:127–153.
2. Sharma R, Young C, Neu J. Molecular modulation of intestinal epithelial barrier: contribution of microbiota. J Biomed Biotechnol. 2010 (In press).
3. Neutra MR, Forstner JF. Gastrointestinal mucus: synthesis, secretion and function. In Leonard R.Johnson (eds). Physiology of the Gastrointestinal Tract. Raven Press, New York. 1987:975-1,009.
4. Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol. 2006;169:1,901-1,909.
5. Vereecke L, Beyaert R, Van Loo G. Enterocyte death and intestinal barrier maintenance in homeostasis and disease. Trends Mol Med. 2011;17:584-593.
6. Yu QH, Yang Q. Diversity of tight junctions (TJs) between gastrointestinal epithelial cells and their function in maintaining the mucosal barrier.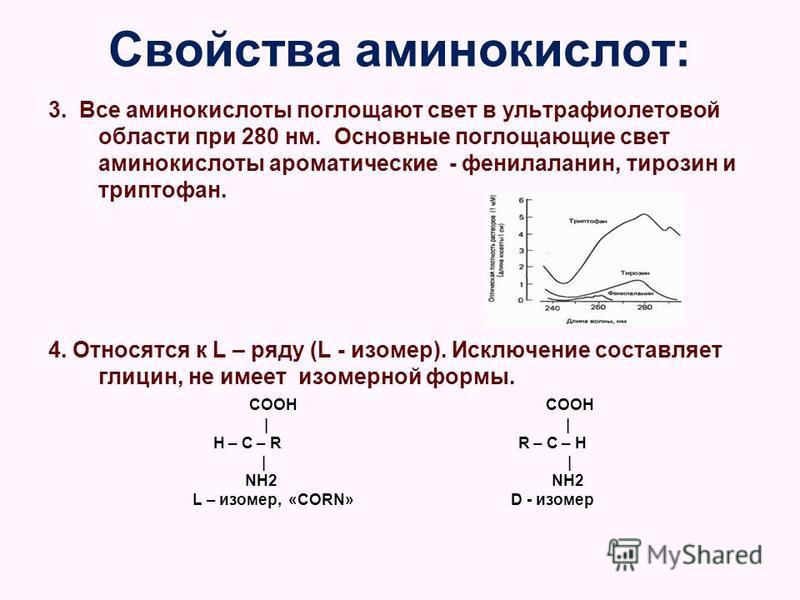 Cell Biol Int. 2009;33:78-82.
Cell Biol Int. 2009;33:78-82.
7. Snoek SA, Verstege MI, Boeckxstaens GE, et al. The enteric nervous system as a regulator of intestinal epithelial barrier function in health and disease. Expert Rev Gastroenterol Hepatol. 2010; 4:637-651.
8. Johansson ME, Ambort D, Pelaseyed T, et al. Composition and functional role of the mucus layers in the intestine. Cell Mol Life Sci. 2011;68:3,635-3,641.
9. Forstner JF, Oliver MG, Sylvester FA. Production, structure and biologic relevance of gastrointestinal mucins. In Blaser MJ, Smith PD, Ravdin JI, Greenberg HB, Guerrant RL (eds). Infections of the Gastrointestinal Tract. Raven Press, New York. 1995:71–88.
10. Atuma C, Strugala V, Allen A, Holm L. The adherent gastro – intestinal mucus gel layer: thickness and physical state in vivo. Am J Physiol Gastrointest Liver Physiol. 2001;280:G922-G929.
11. Johansson ME, Larsson JM, Hansson GC. The two mucus layers of colon are organized by the MUC2 mucin, whereas the outer layer is a legislator of host-microbial interactions. Proc Natl Acad Sci USA. 2011;108:4,659-4,665.
Proc Natl Acad Sci USA. 2011;108:4,659-4,665.
12. McGuckin MA, Lindén SK, Sutton P, Florin TH. Mucin dynamics and enteric pathogens. Nat Rev Microbiol. 2011;9:265-278.
13. Sheng YH, Hasnain SZ, Florin TH, McGuckin MA. Mucins in inflammatory bowel diseases and colorectal cancer. J Gastroenterol Hepatol. 2012;27:28-38
14.Van Klinken BJ, Einerhand AW, Büller HA, Dekker J. Strategic biochemical analysis of mucins. Anal Biochem. 1998;265:103-116.
15. Van der Sluis M, De Koning BA, De Bruijn AC, et al. Muc2- deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology. 2006;131:117-129.
16. Carraway KL, Theodoropoulos G, Kozloski GA, Carothers Carraway CA. Muc4/MUC4 functions and regulation in cancer. Future Oncol. 2009;5:1,631-1,640.
17. Luu Y, Junker W, Rachagani S, et al. Human intestinal MUC17 mucin augments intestinal cell restitution and enhances healing of experimental colitis. Int J Biochem Cell Biol. 2010;42:996-1,006.
2010;42:996-1,006.
18. Resta-Lenert S, Das S, Batra SK, Ho SB. Muc17 protects intestinal epithelial cells from enteroinvasive E. coli infection by promoting epithelial barrier integrity. Am J Physiol Gastrointest Liver Physiol. 2011;300:G1144-G1155.
19. Allen A. Gastrointestinal mucus. In Handbook of Physiology: The Gastrointestinal System. Salivary, Gastric, Pancreatic, and Hepatobiliary Secretion. Am Physiol Soc, Bethesda, MD. 1989:359-382.
20. Forstner G. Signal transduction, packaging and secretion of mucins. Annu Rev Physiol. 1995;57:585-605.
21. Plaisancié P, Barcelo A, Moro F, et al. Effects of neurotransmitters, gut hormones, and inflammatory mediators on mucus discharge in rat colon. Am J Physiol Gastrointest Liver Physiol. 1998;275:G1073-G1084.
22. Sherman P, Forstner J, Roomi N, et al. Mucin depletion in the intestine of malnourished rats. Am J Physiol. 1985;248:G418- G4123.
23. Faure M, Moennoz D, Montigon F, et al. Dietary threonine restriction specifically reduces intestinal mucin synthesis in rats. J Nutr. 2005;135:486-491.
J Nutr. 2005;135:486-491.
24. Law GK, Bertolo RF, Adjiri-Awere A, et al. Adequate oral threonine is critical for mucin production and gut function in neonatal piglets. Am J Physiol Gastrointest Liver Physiol. 2007;292: G1293-G1301.
25. Wang X, Qiao S, Yin Y, et al. A deficiency or excess of dietary threonine reduces protein synthesis in jejunum and skeletal muscle of young pigs. J Nutr. 2007;137:1,442-1,446.
26. Nichols NL, Bertolo RF. Luminal threonine concentration acutely affects intestinal mucosal protein and mucin synthesis in piglets. J Nutr. 2008;138:1,298-1,303.
27. Comelli EM, Simmering R, Faure M, et al. Multifaceted transcriptional regulation of the murine intestinal mucus layer by endogenous microbiota. Genomics. 2008;91:70-77.
28. Jenkins RT, Ramage JK, Jones DB, et al. Small bowel and colonic permeability to 51Cr-EDTA in patients with active inflammatory bowel disease. Clin Invest Med. 1988;11:151-155
29. Arslan G, Atasever T, Cindoruk M, Yildirim IS. (51)CrEDTA colonic permeability and therapy response in patients with ulcerative colitis. Nucl Med Commun. 2001;22:997-1,001.
(51)CrEDTA colonic permeability and therapy response in patients with ulcerative colitis. Nucl Med Commun. 2001;22:997-1,001.
30. Mahida YR, Rolfe VE. Host-bacterial interactions in inflammatory bowel disease. Clin Sci (Lond). 2004;107:331-431.
31. Ott SJ, Musfeldt M, Wenderoth DF, et al. Reduction in diversity of the colonic mucosa associated bacterial microflora in patients with active inflammatory bowel disease. Gut. 2004;53:685-693.
32. Kim YS, Ho SB. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr Gastroenterol Rep. 2010;12:319-330.
33. Sheng YH, Lourie R, Lindén SK, et al. The MUC13 cellsurface mucin protects against intestinal inflammation by inhibiting epithelial cell apoptosis. Gut. 2011;60:1,661-1,670.
34. Ruot B, Bechereau F, Bayle G, et al. The response of liver albumin synthesis to infection in rats varies with the phase of the inflammatory process. Clin Sci (Lond). 2002;102:107–114.
35. Faure M, Choné F, Mettraux C, et al. Threonine utilization for synthesis of acute phase proteins, intestinal proteins, and mucins is increased during sepsis in rats. J. Nutr. 2007;137:1,802–1,807.
Threonine utilization for synthesis of acute phase proteins, intestinal proteins, and mucins is increased during sepsis in rats. J. Nutr. 2007;137:1,802–1,807.
36. Reeds PJ, Jahoor F. The amino aicd requirements of disease. Clin Nutr. 2001;1:15-22.
37. Breuille D, Rose F, Arnal M, et al. Sepsis modifies the contribution of different organs to whole-body protein synthesis in rats. Clin Sci (Lond). 1994;86:663-669.
38. Stoll B, Henry J, Reeds PJ, et al. Catabolism dominates the first-pass intestinal metabolism of dietary essential amino acids in milk protein-fed piglets. J Nutr. 1998;128:606-614.
39. Fuller MF, Milne A, Harris CI, et al. Amino acid losses in ileostomy fluid on a protein-free diet. Am J Clin Nutr. 1994;59: 70-73.
40.Van der Sluis M, Schaart MW, de Koning BA, et al.Threonine metabolism in the intestine of mice: loss of mucin 2 induces the threonine catabolic pathway. J Pediatr Gastroenterol Nutr. 2009;49: 99-107.
41.Van Der Schoor SR, Reeds PJ, Stoll B, et al. The high metabolic cost of a functional gut. Gastroenterology. 2002;123:1,931-1,940.
The high metabolic cost of a functional gut. Gastroenterology. 2002;123:1,931-1,940.
42. Gaudichon C, Bos C, Morens C, et al. Ileal losses of nitrogen and amino acids in humans and their importance to the assessment of amino acid requirements. Gastroenterology. 2002;123:50-59.
43. Heys SD, Park KG, McNurlan MA, et al. Protein synthesis rates in colon and liver: stimulation by gastrointestinal pathologies. Gut. 1992;33:976-981.
44. Breuille D, Arnal M, Rambourdin F, et al. Sustained modifications of protein metabolism in various tissues in a rat model of long-lasting sepsis. Clin Sci (Lond). 1998;94:413-423.
45. Mercier S, Breuille D, Mosoni L, et al. Chronic inflammation alters protein metabolism in several organs of adult rats. J Nutr. 2002;132:1,921-1,928.
46. El Yousfi M, Breuille D, Papet I, et al. Increased tissue protein synthesis during spontaneous colitis in HLA-B27 rats implies different underlying mechanisms. Clin Sci (Lond). 2003;105:437-446.
47. Breuillé D, Bechereau F, Buffiere C, et al. Beneficial effect of amino acid supplementation, especially cysteine, on body nitrogen economy in septic rats. Clin Nutr. 2006;25:634-642.
Breuillé D, Bechereau F, Buffiere C, et al. Beneficial effect of amino acid supplementation, especially cysteine, on body nitrogen economy in septic rats. Clin Nutr. 2006;25:634-642.
48. Faure M, Moënnoz D, Montigon F, et al. Development of a rapid and convenient method to purify mucins and determine their in vivo synthesis rate in rats. Anal Biochem. 2002;15(307):244-251.
49.Tytgat KM, Van der Wal JW, Einerhand AW, et al. Quantitative analysis of MUC2 synthesis in ulcerative colitis. Biochem Biophys Res Commun. 1996;224:397-405.
50. Faure M, Moënnoz D, Montigon F, et al. Mucin production and composition is altered in dextran sulfate sodium-induced colitis in rats. Dig Dis Sci. 2003;48:1,366-1,373.
51. Faure M, Moënnoz D, Mettraux C, et al. The chronic colitis developed by HLA-B27 transgenic rats is associated with altered in vivo mucin synthesis. Dig Dis Sci. 2004;49:339-346.
52. Faure M, Mettraux C, Moennoz D, et al. Specific amino acids increase mucin synthesis and microbiota in dextran sulfate sodium-treated rats. J Nutr. 2006;136:1,558-1,564.
J Nutr. 2006;136:1,558-1,564.
Аминокислоты в питании человека Текст научной статьи по специальности «Фундаментальная медицина»
lectures
АМИНОКИСЛОТЫ В ПИТАНИИ ЧЕЛОВЕКА
Лысиков Ю.А.
ГУ Институт питания РАМН, Москва
Лысиков Юрий Александрович 109240 Москва, Устьинский проезд, д. 2/14 E-mail: [email protected]
РЕЗЮМЕ
В статье представлены данные о метаболизме аминокислот в организме человека. Рассмотрена структура и свойства аминокислот, критерии незаменимости, вклад аминокислот в энергетику организма, специфические функции аминокислот, потребность в аминокислотах.
SUMMARY
The article presents data on amino acids metabolism in human organism. The review described structure and function of amino acids, essentiality criteria, amino acids energy source role, amino acids specific functions, amino acids requirements.
The review described structure and function of amino acids, essentiality criteria, amino acids energy source role, amino acids specific functions, amino acids requirements.
CO CO
СТРУКТУРА И СВОЙСТВА АМИНОКИСЛОТ
Известно около 200 природных аминокислот, из них только 20 входят в состав белков. Эти аминокислоты называют протеиногенными — строящими белки. В организме человека наряду с протеиногенными аминокислотами можно найти и другие, которые играют иную роль, например, орнитин, в-аланин, таурин и др.. Многие из протеиноген-ных аминокислот в организме человека выполняют важные самостоятельные функции, например, глицин, глютаминовая и аспарагиновая кислоты являются биологически активными соединениями, фенилаланин, тирозин и триптофан служат источником образования биогенных аминов и других биорегуляторов, глицин и таурин входят в состав желчных кислот.
Первая аминокислота, аспарагин, была открыта еще в 1806 году. Последней из обнаруженных известных аминокислот оказался треонин, который
соон
Н — С — 1ЧН2
Рис. 1. Общая структурная формула аминокислоты
удалось выделить лишь в 1938 году. Каждая аминокислота имеет тривиальное (традиционное) название, иногда связанное с источником происхождения. Например, аспарагин впервые был обнаружен в аспарагусе, глютаминовая кислота — в клейковине (глютене) пшеницы. Глицин был назван так за сладкий вкус (от греческого glykos — сладкий). В пищевых продуктах наиболее распространены 22 аминокислоты.
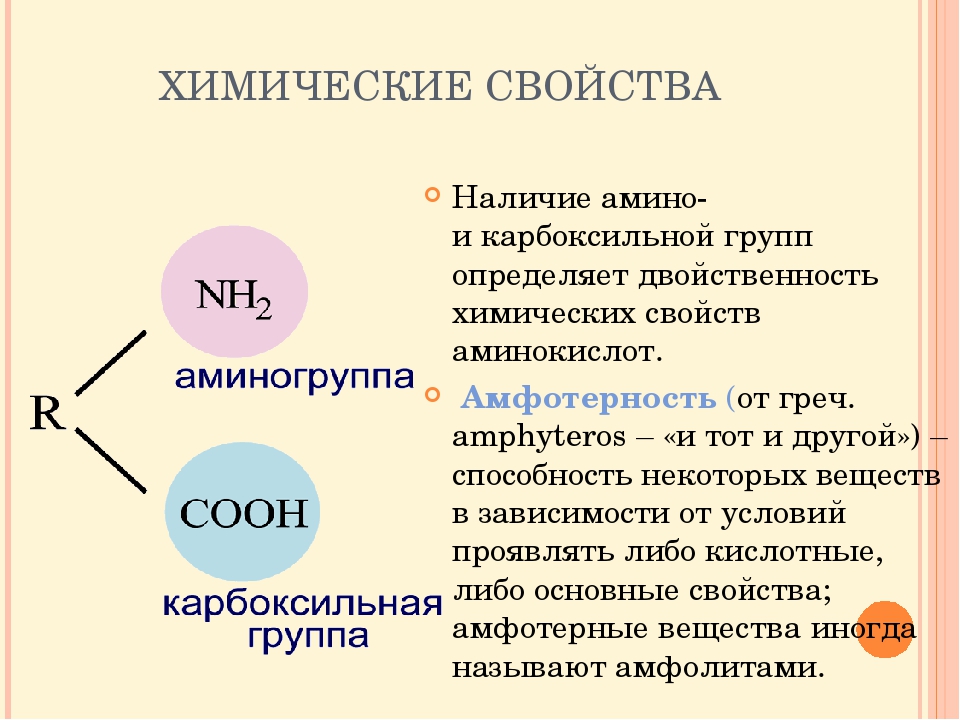
Все 20 аминокислот, которые входят в состав белка, характеризуются общей структурной особенностью — наличием карбоксильной группы (-СООН) и аминогруппы (-№И2), связанной с одним и тем же атомом углерода и различаются структурой боковых цепей групп) (рис. 1). Почти все аминокислоты содержат по одной карбоксильной и аминогруппе. Однако имеются аминокислоты, которые могут содержать две карбоксильные (дикарбоновые аминокислоты) или две аминогруппы (диаминоами-нокислоты). Большинство аминокислот являются а-аминокислотами, в отличие от в-аминокислот, таких как в-аланин и таурин.
1). Почти все аминокислоты содержат по одной карбоксильной и аминогруппе. Однако имеются аминокислоты, которые могут содержать две карбоксильные (дикарбоновые аминокислоты) или две аминогруппы (диаминоами-нокислоты). Большинство аминокислот являются а-аминокислотами, в отличие от в-аминокислот, таких как в-аланин и таурин.
Стереоизомеры аминокислот. Из-за асимметрии молекулы все а-аминокислоты, за исключением
глицина, могут существовать в форме двух Б- или Ь-стереоизомеров — оптических изомеров, которые представляют собой зеркальные изображения друг друга. В ходе биосинтеза белка в его состав попадают только Ъ-аминокислоты. Следует подчеркнуть, что присутствие в составе белка Ъ-аминокислот определяет его структуру и свойства. Б-аминокислоты никогда не включаются в белки в процессе биосинтеза. В то же время в составе белка можно обнаружить и Б-аминокислоты. Причина этого парадокса
заключается в том, что для аминокислот характерна медленная самопроизвольная неферментативная рацемизация, в результате которой в составе белка появляются Б-аминокислоты. По этой причине структура белка со временем начинает меняться, могут изменяться и его свойства. Это является одним из механизмов старения белков, что вызывает необходимость их непрерывного обновления.
По этой причине структура белка со временем начинает меняться, могут изменяться и его свойства. Это является одним из механизмов старения белков, что вызывает необходимость их непрерывного обновления.
Таблица 1
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ [2; 3]
Химическая структура Полярность боковой цепи Изоэлектри-ческая точка р! Молекулярная масса , г/моль Степень гидрофильности Полярность боковой цепи
1. Алифатические Высокогидрофильные
Алании -1,9 6,0 89 Глютамин +9,4
Валин* -2,0 6,0 117 Аспарагин +9,7
Глицин -2,4 6,0 75 Глютаминовая кислота +10,2
Изолейцин* -2,2 5,9 131 Гистидин +10,3
Лейцин* -2,3 6,0 131 Аспарагиновая кислота +11,0
2. Серосодержащие Лизин* +15,0
Серосодержащие Лизин* +15,0
Метионин* -1,5 5,7 149 Аргинин +20,0
Цистеин -1,2 5,0 121 Умеренно гидрофильные
3. Ароматические Треонин* +4,9
Тирозин +6,1 5,7 181 Серин +5,1
Триптофан* +5,9 5,9 204 Триптофан* +5,9
Фенилаланин* +0,8 5,5 165 Пролин +6,0
4. Оксиаминокислоты Тирозин +6,1
Серин +5,1 5,7 105 Высокогидрофобные
Треонин* +4,9 5,6 119 Цистеин -1,2
5. Дикарбоновые (кислые) Метионин* -1,5
Аспарагиновая кислота +11,0 2,8 133 Аланин -1,9
Глютаминовая кислота +10,2 3,2 147 Валин* -2,0
6. Амиды дикарбоновых кислот Изолейцин* -2,2
Амиды дикарбоновых кислот Изолейцин* -2,2
Аспарагин +9,7 5,4 132 Лейцин* -2,3
Глютамин +9,4 5,7 146 Глицин -2,4
7. Диаминоаминокислоты (основные) Фенилаланин* +0,8
Аргинин +20,0 10,9 174
Гистидин +10,3 7,6 155
Лизин* +15,0 9,7 146
8. Иминокислота
Пролин +6,0 6,3 115
о
СО
Примечание: * — незаменимые аминокислоты.
сэ
о
Биосинтез Ь-аминокислот в клетках организма происходит с помощью стереоспецифических ферментов, которые имеют асимметричные активные центры. При химическом синтезе аминокислот с одинаковой скоростью образуются как Б-, так и Ь-стереоизомеры. В результате получается рацемическая (одинаковая по составу) смесь разных стереоизомеров аминокислот. Рацемическую смесь аминокислот можно разделить на Б- и Ь-стереоизомеры, но это дорого. Поэтому полученные искусственным путем препараты аминокислот могут содержать не только необходимые организму Ь-аминокислоты, но и Б-стереоизомеры. Полные гидролизаты белков будут содержать только Ь-стереоизомеры аминокислот. В природе встречаются и некоторые Б-аминокислоты, которые входят в состав пептидных антибиотиков и клеточных стенок бактерий [1].
При химическом синтезе аминокислот с одинаковой скоростью образуются как Б-, так и Ь-стереоизомеры. В результате получается рацемическая (одинаковая по составу) смесь разных стереоизомеров аминокислот. Рацемическую смесь аминокислот можно разделить на Б- и Ь-стереоизомеры, но это дорого. Поэтому полученные искусственным путем препараты аминокислот могут содержать не только необходимые организму Ь-аминокислоты, но и Б-стереоизомеры. Полные гидролизаты белков будут содержать только Ь-стереоизомеры аминокислот. В природе встречаются и некоторые Б-аминокислоты, которые входят в состав пептидных антибиотиков и клеточных стенок бактерий [1].
По химической структуре можно выделить 8 классов аминокислот (табл. 1):
1. Алифатические аминокислоты (аланин, ва-лин, глицин, изолейцин и лейцин) отличаются тем, что их боковые цепи содержат лишь атомы углерода и водорода.
У валина, изолейцина и лейцина боковая цепь разветвляется, их еще называют аминокислотами с разветвленной цепью.
2. Серосодержащие аминокислоты (метионин и цистеин) содержат атомы серы. При этом место серы может занимать атом селена.
3. Ароматические аминокислоты (тирозин, триптофан и фенилаланин) содержат ароматические циклические группы.
4. Оксиаминокислоты (серин и треонин) содержат -ОН-группы.
5. Дикарбоновые аминокислоты (аспарагино-вая и глютаминовая кислоты) содержат две карбоксильные группы
6. Амиды дикарбоновых аминокислот (аспа-рагин и глютамин) содержат атом азота в составе второй карбоксильной группы.
7. Диамино-, или двуосновные, аминокислоты (аргинин, гистидин и лизин) содержат две аминогруппы.
8. «Аминокислота» пролин занимает особое положение, поскольку, аминокислотой не является. По своей структуре это иминокислота и включает циклическое имидазольное кольцо. Благодаря циклической группе пролин вызывает изгибы в полипептидной цепочке белка, что очень важно, например, для структуры белка соединительной ткани коллагена, где пролина очень много.
По своей структуре это иминокислота и включает циклическое имидазольное кольцо. Благодаря циклической группе пролин вызывает изгибы в полипептидной цепочке белка, что очень важно, например, для структуры белка соединительной ткани коллагена, где пролина очень много.
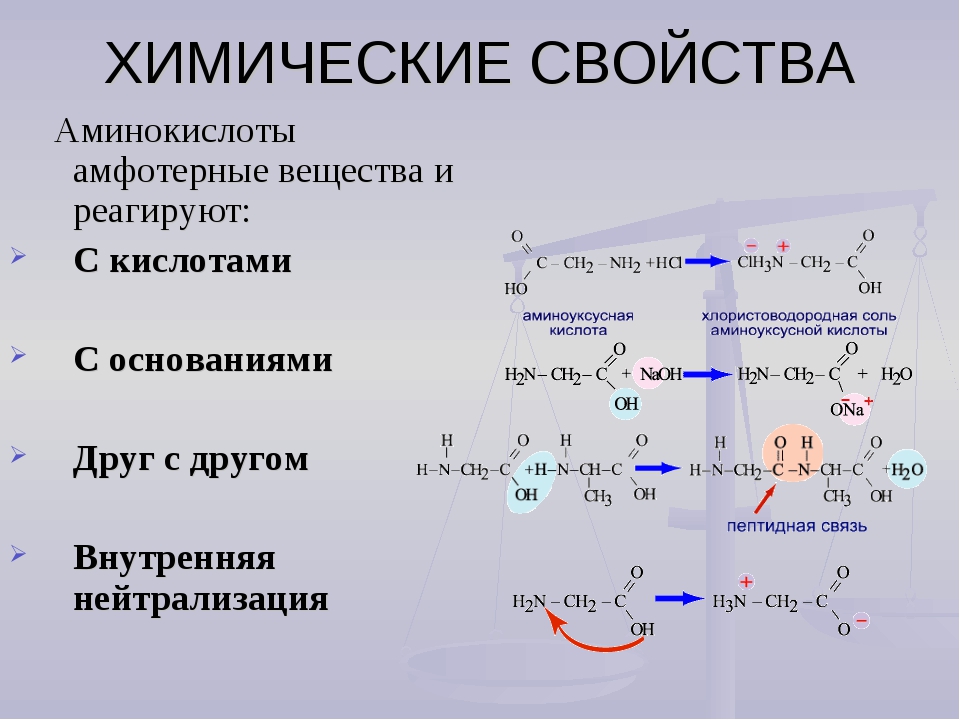
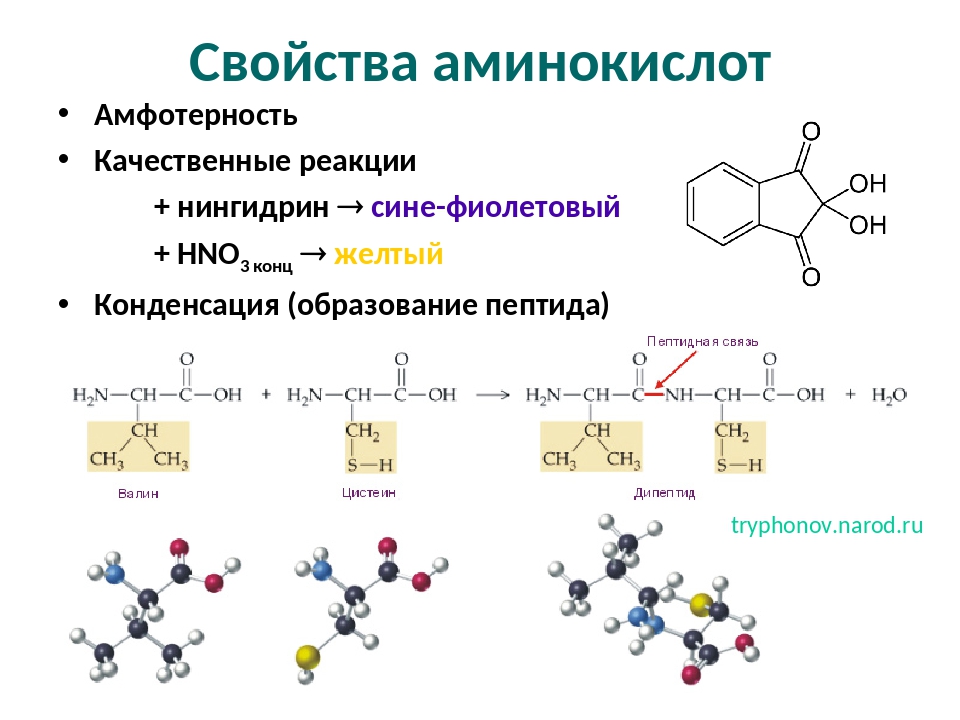
Благодаря наличию карбоксильной и аминогруппы в водных растворах все аминокислоты ионизированы и ведут себя одновременно как кислоты и как основания. В водной среде организма свободные аминокислоты играют роль буферных веществ, стабилизируя рН среды. При этом растворимость в воде и степень гидрофильности разных аминокислот существенно различается. По степени
гидрофильности — способности связывать молекулы воды аминокислоты можно разделить на [2]:
1. Высокогидрофильные: аспарагин, аспара-гиновая кислота, аргинин, гистидин, глютамин, глютаминовая кислота и лизин, которые почти всегда располагаются на внешней поверхности молекул белка.
2. Умеренно гидрофильные: пролин, серин, тирозин, треонин и триптофан. Они занимают промежуточное положение, отличаясь определенной гидрофильностью.
3. Гидрофобные: аланин, валин, глицин, изо-лейцин, лейцин, метионин, цистеин и фенилала-нин, которые располагаются в основном внутри молекул белка.
Гидрофильность аминокислот во многом зависит от их полярности, которая связана с величиной заряда их боковых групп. Пять алифатических аминокислот (аланин, валин, глицин, изолейцин и лейцин) содержат слабо полярные боковые группы. Слабую полярность имеют серосодержащие аминокислоты (метионин и цистеин), а также одна из ароматических аминокислот — фенилаланин. Благодаря гидрофобности эти аминокислоты плохо растворяются в воде. Остальные аминокислоты содержат заряженные положительно полярные боковые группы и поэтому они более гидрофильны и хорошо растворяются в воде. Полярность аминокислот оказывают существенное влияние на структуру белка, его свойства и функции. Следует подчеркнуть, что большинство гидрофобных аминокислот являются незаменимыми (валин, изолейцин, лейцин, метионин и фенилаланин). Две других незаменимых аминокислоты (треонин и триптофан) отличаются умеренной гидрофильностью.
Полярность аминокислот оказывают существенное влияние на структуру белка, его свойства и функции. Следует подчеркнуть, что большинство гидрофобных аминокислот являются незаменимыми (валин, изолейцин, лейцин, метионин и фенилаланин). Две других незаменимых аминокислоты (треонин и триптофан) отличаются умеренной гидрофильностью.
Онкотическое давление. Гидрофобные аминокислоты, как правило, располагаются внутри молекулы белка, тогда как гидрофильные — на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка. Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток. Гидрофильность белков крови обеспечивают онкотическое давление, которое удерживает жидкость в кровеносных сосудах. При уменьшении содержания белка в организме человека в первую очередь уменьшается количество плазменных белков, что приводит к снижению он-котического давления крови, выходу жидкости из кровеносной системы в межклеточное пространство, что может приводить к возникновению безбелковых (голодных) отеков. Гидрофильность пищевых белков обеспечивает их способность набухать, образовывать студни, эмульсии и пены. Гидрофильность белков клейковины злаков определяет качество зерна и его хлебопекарные свойства.
Гидрофильность пищевых белков обеспечивает их способность набухать, образовывать студни, эмульсии и пены. Гидрофильность белков клейковины злаков определяет качество зерна и его хлебопекарные свойства.
Нестандартные аминокислоты в составе белка. Кроме 20 стандартных аминокислот, которые присутствуют почти во всех белках, существуют так называемые нестандартные аминокислоты, которые
встречаются лишь в некоторых из них. Причем, каждая из этих аминокислот представляет собой производное одной из обычных. К нестандартным аминокислотам относят: производное пролина — 4-гидроксипролин и 5-гидроксипролин. Обе аминокислоты входят в состав коллагена. В мышечном белке миозине присутствует производное лизина — Nметиллизин. Другое производное лизина — аминокислота десмозин (комплекс из четырех молекул лизина — тетрапептид) содержится только в фибриллярном белке соединительной ткани — эластине. В белке протромбине, а также в некоторых других белках, которые активно связывают ионы кальция, присутствует у-карбоксиглютаминовая кислота.
В белке протромбине, а также в некоторых других белках, которые активно связывают ионы кальция, присутствует у-карбоксиглютаминовая кислота.
Особо следует остановиться на серосодержащей аминокислоте цистеине. Она может находиться в составе белка в двух формах: либо в форме цисте-ина, либо в форме дипептида — цистина, который представляет собой комплекс из двух молекул ци-стеина, ковалентно связанных друг с другом при помощи дисульфидного мостика. Благодаря этому свойству цистеин выполняет важную функцию по стабилизации структуры белковой молекулы. Цистеин играет ключевую роль в формировании инсулина и иммуноглобулинов (антител). В этих белках благодаря дисульфидным цистеиновым мостикам соединяются разные полипептидные цепи в одну молекулу белка. Такие поперечные связи обычно отсутствуют во внутриклеточных белках, но широко представлены в секреторных белках. Разрушение дисульфидных связей в кератине, формирующем структуру волос, лежит в основе процесса химической завивки. Для этого используют тиоловые соединения, под действием которых происходит разрыв поперечных дисульфидных связей в кератине. После укладки волос действие кислорода воздуха приводит к образованию новых поперечных связей, которые закрепляют новую форму волос.
Для этого используют тиоловые соединения, под действием которых происходит разрыв поперечных дисульфидных связей в кератине. После укладки волос действие кислорода воздуха приводит к образованию новых поперечных связей, которые закрепляют новую форму волос.
Функциональная классификация аминокислот. С физиологических позиций аминокислоты можно разделить на:
• Протеиногенные, которые входят в состав белка (20 аминокислот), и непротеиногенные, не входящие в состав белка, но выполняющие в организме человека другие важные функции.
• Заменимые (8 аминокислот) и незаменимые (12 аминокислот). О них мы будем говорить ниже.
• Глюкогенные, которые превращаются в глюкозу и далее в гликоген или расщепляются по пути метаболизма глюкозы с образованием АТФ. Глюкогенными, в той или иной степени, являются подавляющее большинство — 19 аминокислот, за исключением лейцина.
• Кетогенные, которые могут превращаться в кетоновые тела (короткоцепочечные жирные кислоты). Кетогенными являются 6 аминокислот: изолейцин, лейцин, лизин, тирозин, триптофан и фенилаланин.
АМИНОКИСЛОТЫ КАК ИСТОЧНИКИ ЭНЕРГИИ
Известно, что при полном окислении 1 г белка (или смеси аминокислот) в калориметрической бомбе в среднем образуется 5,65 ккал. Углерод аминокислот окисляется до СО2, водород — до Н2О, а азот — до NО2. Однако в организме человека энергию в форме АТФ можно получить только при окислении углеводородной составляющей аминокислот. Поэтому из 5,65 ккал организму будут доступны только 4,3 ккал, а оставшаяся часть (1,3 ккал) является энергией окисления азота. В настоящее время установлено, что действительная энергетическая ценность белка колеблется от 1,82 до 4,27 ккал/г, однако за эталон принимают цифру 4,0 ккал/г [4]. Существенные различия в энергетической ценности белка связаны, с одной стороны, с различной молекулярной массой аминокислот, а с другой — с разными путями и механизмами их окислительного метаболизма (рис. 2).
Существенные различия в энергетической ценности белка связаны, с одной стороны, с различной молекулярной массой аминокислот, а с другой — с разными путями и механизмами их окислительного метаболизма (рис. 2).
Считают, что белки (аминокислоты) могут обеспечить 11-14% энергии суточного рациона. Например, при суточной калорийности в 2500 ккал на белок может приходиться 275-350 ккал, что должно соответствовать 69-88 г белка. Однако все пищевые аминокислоты не могут полностью окисляться с образованием энергии. Значительная часть энергии теряется в процессе кругооборота и метаболизма аминокислот. Поэтому эффективность использования энергии пищи организмом человека, как полагают, составляет около 20-25% [4].
Аминокислоты мышечных белков, а также сывороточные и другие белки являются важным источником образования глюкозы и метаболической энергии в форме АТФ. При длительном голодании это приводит к массивному распаду мышечного белка и снижения содержания белка и его фракций в сыворотке крови. Диеты с низким (недостаточным) количеством углеводов также ведут к деградации мышечных и сывороточных белков.
Диеты с низким (недостаточным) количеством углеводов также ведут к деградации мышечных и сывороточных белков.
В биосинтезе глюкозы участвуют в основном заменимые аминокислоты — 10-25% и только 1% незаменимых аминокислот. В организме человека углеродные скелеты некоторых аминокислот могут непосредственно превращаться в пируват или в промежуточные продукты цитратного цикла (окса-лоацетат, сукцинил-КоА, кетоглутарат и фума-рат) с освобождением энергии в дыхательной цепи митохондрий (табл. 2). При этом оксалоацетат может превращаться в фосфоенолпируват и по пути глюконеогенеза — в глюкозу. Источником глюкозы может стать и пируват [5]. Таким образом, разные глюкогенные аминокислоты могут включаться в пути обмена глюкозы (гликолиз и глюконеогенез) на разных его этапах. Судьба разных аминокислот
го
О 2
ГЛЮКОЗА
ГЛИКОГЕН
фосфоенолп и руват
оксалоацетат
го
го
0 ^
2
го
1
I
ГЛЮКОЗА
ГЛИКОГЕН
фосфоенолпируват
оксалоацетат
Пируват
аминокислоты
Ацетил-КоА
I
ЦИТРАТНЫЙ ЦИКЛ сукцинил КоА, кетоглутарат, фумарат, оксалоацетат
ДЫХАТЕЛЬНАЯ ЦЕПЬ
ЭНЕРГИЯ
Рис. 2. Пути метаболизма глюкогенных аминокислот
2. Пути метаболизма глюкогенных аминокислот
о
неодинакова: одни из них могут превращаться в глюкозу и далее в гликоген, тогда как другие, минуя глюкозу, могут непосредственно окисляться до СО2 и Н2О с образованием АТФ.
Установлено, что из 100 г аминокислот может образовываться только 57 г глюкозы. При голодании в первые 3-4 дня из аминокислот в среднем в сутки образуется около 41 г глюкозы, а спустя несколько недель голодания образование глюкозы снижается до 16 г в сутки. При сахарном диабете 2-го типа превращение глюкогенных аминокислот в глюкозу происходит с гораздо большей скоростью, чем у здоровых людей [5]. Как следствие этого у больных диабетом с мочой выводится большое количество мочевины, которая образуется при дезаминировании глюкогенных аминокислот. В критических состояниях скорость глюконеогенеза с использованием аминокислот также существенно возрастает.
Среди аминокислот наиболее эффективно превращаются в глюкозу серин, аланин и пролин, тогда как глютамин, который широко используется в энтеральном и парентеральном питании, стоит на четвертом месте (табл. 3).
Важную роль в процессах глюконеогенеза играет так называемый цикл аланина, который характерен для мышечной ткани (рис. 3). При дефиците глюкозы в организме или при голодании усиливается катаболизм мышечных белков с освобождением свободных аминокислот, около 50% которых составляет аланин [2]. Аланин поступает в печень, где из него образуется пируват, который включается в глюконеогенез. Когда в мышечной ткани возобновляется биосинтез белка, возникает потребность в аланине, который начинает синтезироваться из пирувата. В свою очередь источником пирувата является глюкоза, из которой он образуется в результате гликолиза. Таким образом, аланин завершает свой кругооборот:
НЕЗАМЕНИМОСТЬ АМИНОКИСЛОТ
Говоря о значении различных аминокислот для организма человека, необходимо рассмотреть понятие незаменимости. Основным критерием в определении биологической ценности аминокислот является их способность поддерживать рост животных и человека, что связано с биосинтезом белка в организме. Исключение из пищевого рациона хотя бы одной из таких аминокислот, при сохранении содержания остальных, влечет за собой задержку роста и снижение массы тела растущего организма. Поэтому незаменимыми аминокислотами считают такие, которые «либо не синтезируются в организме, или синтезируются со скоростью, недостаточной или не соответствующей обмену веществ,
Основным критерием в определении биологической ценности аминокислот является их способность поддерживать рост животных и человека, что связано с биосинтезом белка в организме. Исключение из пищевого рациона хотя бы одной из таких аминокислот, при сохранении содержания остальных, влечет за собой задержку роста и снижение массы тела растущего организма. Поэтому незаменимыми аминокислотами считают такие, которые «либо не синтезируются в организме, или синтезируются со скоростью, недостаточной или не соответствующей обмену веществ,
S Lr
обеспечивающих пластические и регенера- sj
тивные процессы, связанные с образованием ц
новых клеток и тканей» [6]. <
Согласно классическим исследованиям Rose, для взрослого здорового человека жизненно необходимыми являются 8 аминокислот, которые стали считать незаменимыми (табл.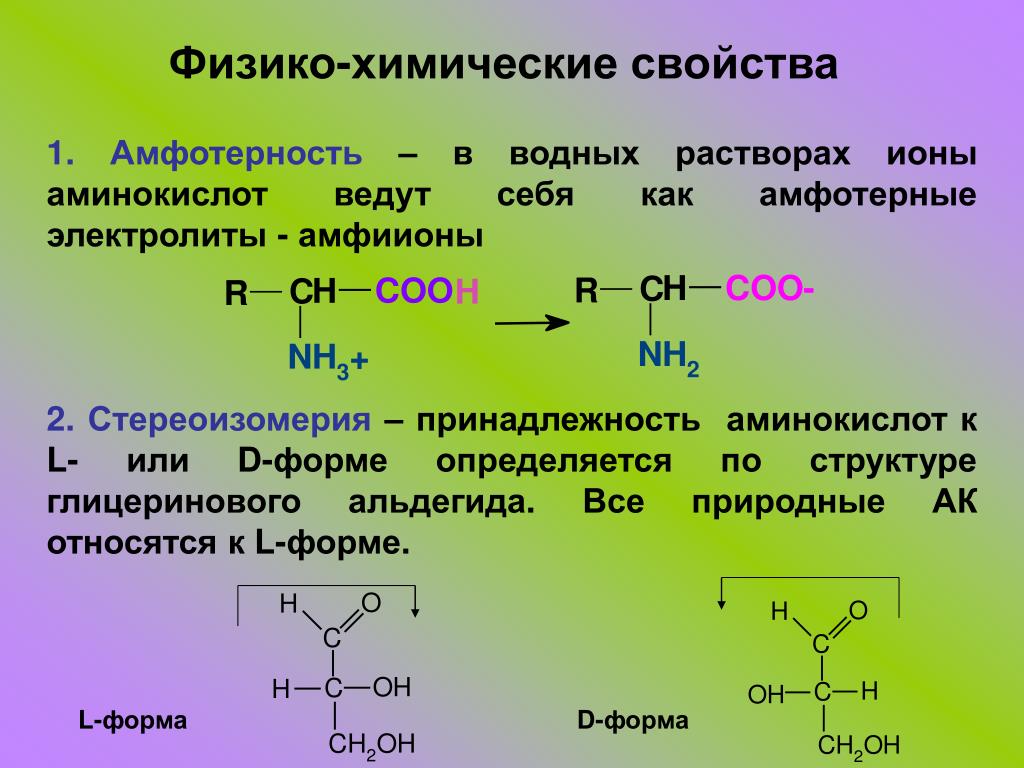 4). Полагают, что эти аминокислоты не образуются в организме человека и обязательно должны поступать с пищей.
4). Полагают, что эти аминокислоты не образуются в организме человека и обязательно должны поступать с пищей.
Остальные 12 аминокислот считают заменимыми. К ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, гистидин, глицин, глютамин, глютами-новую кислоту, пролин, серин, тирозин и цистеин. Эти аминокислоты, как полагают,
катаболизм белка t! глюконеогенез
БЕЛОК аланин пируват ГЛЮКОЗА
анаболизм белка МЫШЕЧНАЯ ТКАНЬ гликолиз ПЕЧЕНЬ
Рис. 3. Цикл аланина Таблица 2
СУДЬБА ГЛЮКОГЕННЫХ АМИНОКИСЛОТ [5]
Аминокислоты Превращаются в: Результат
Аланин, глицин, серин, треонин, цистеин Пируват Глюкоза/АТФ
Аспарагин, аспарагиновая кислота Оксалоацетат Глюкоза/АТФ
Валин, изолейцин, метионин, триптофан Сукцинил-КоА АТФ
Аргинин, гистидин, глутамин, глутаминовая кислота, пролин Кетоглутарат АТФ
Аспарагиновая кислота, тирозин, фенилаланин Фумарат АТФ
Таблица 3
СКОРОСТЬ ГЛЮКОНЕОГЕНЕЗА В ПЕЧЕНИ ИЗ РАЗЛИЧНЫХ ПРЕДШЕСТВЕННИКОВ [5]
Предшественник Образование глюкозы мк моль/мин г ткани Предшественник Образование глюкозы, мкмоль/мин г ткани
Фруктоза 2,68 Глутамин 0,45
Диоксиацетон 2,07 Треонин* 0,40
Лактат 1,06 Глутамат 0,31
Пируват 1,02 Аргинин 0,27
Серин 0,98 Аспартат 0,23
Аланин 0,66 Изолейцин* 0,22
Пролин 0,55 Орнитин 0,19
Глицерин 0,48 Валин* 0,12
Примечание: * — незаменимые аминокислоты.
m
о
способны синтезироваться в организме человека в достаточном количестве. Наряду с этим выделяют группу аминокислот, которые необходимы человеку в определенные периоды развития и в некоторых физиологических и клинических ситуациях. Эти аминокислоты относят к условно незаменимым (табл. 5).
Другим критерием значимости и биологической ценности аминокислот считают степень их участия в обеспечении азотистого равновесия. Имеются данные о целесообразности выделения третьей группы аминокислот, обладающих свойствами ускорять рост. К их числу относят 7 аминокислот: аргинин, глютаминовую кислоту, пролин, серин, тирозин, триптофан и цистеин.
Заслуживает внимание классификация аминокислот, предложенная Josue de Castro, который разделил их на две группы.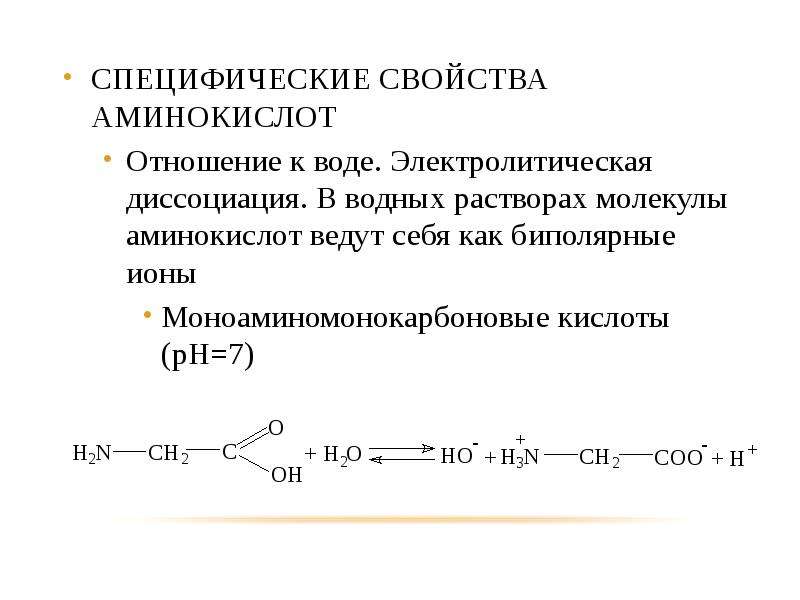 В первую группу вошли 5 аминокислот, обеспечивающие рост: аргинин, гистидин, лизин, пролин и цистеин. Во вторую — другие 5 аминокислот, которые необходимы для регенерации тканей: аспарагиновая и глютаминовая кислоты, тирозин, триптофан и фенилаланин [6].
В первую группу вошли 5 аминокислот, обеспечивающие рост: аргинин, гистидин, лизин, пролин и цистеин. Во вторую — другие 5 аминокислот, которые необходимы для регенерации тканей: аспарагиновая и глютаминовая кислоты, тирозин, триптофан и фенилаланин [6].
А.Э. Шарпенак относил к незаменимым 12 аминокислот: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, тирозин, треонин, триптофан, фенилаланин и цистеин. По данным Eagle, для культивирования клеток животных и человека необходимы те же 12 аминокислот, но с заменой треонина на глютамин [6].
Таблица 4
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ [6]
Автор Rose Условно незаменимые Ускоряют рост Jose de Castro А.Э. Шарпенак Eagle, 1958
Число 8 6 7 10 12 12
Валин Аспартат Аргинин Рост Аргинин Аргинин
Изолейцин Гистидин Глютамат Аргинин Валин Валин
Лейцин Глютамин Пролин Гистидин Гистидин Гистидин
ЛИЗИН* Таурин Серин Лизин Изолейцин Изолейцин
Метионин Тирозин Тирозин Пролин Лейцин Лейцин
Ами- ТРЕОНИН* Цистеин Триптофан Цистеин Лизин Лизин
лоты Триптофан Цистеин Регенерация Метионин Метионин
Фенилаланин Аспартат Тирозин Тирозин
Абсолютно Глютамат Треонин Глютамин
заменимые Тирозин Триптофан Триптофан
ГЛЮТАМАТ Триптофан Фенилаланин Фенилаланин
СЕРИН Фенилаланин Цистеин Цистеин
Примечание: * — абсолютно незаменимые аминокислоты.
Таблица 5
ФУНКЦИИ УСЛОВНО НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
Аминокислота Функции в организме
Аспартат Необходим для процессов регенерации
Гистидин Необходим для маленьких детей, у которых эндогенный синтез недостаточен
Глютамин Необходим для процессов регенерации, является важным энергетическим субстратом в критических состояниях
Таурин Необходим для новорожденных, у которых эндогенный синтез недостаточен, а также для больных в критических состояниях. Дефицит возникает при недостатке метионина и цистеина
Тирозин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. При нарушении функции почек снижено образование тирозина из фенилаланина
При нарушении функции почек снижено образование тирозина из фенилаланина
Цистеин Необходим для маленьких детей, у которых эндогенный синтез недостаточен. Дефицит возникает при недостаточном содержании метионина в питании. Крайне необходим при нарушениях функции печени и для больных в критических состояниях
В основе разноголосицы в определении важности и незаменимости тех или иных аминокислот лежат особенности их биосинтеза и метаболизма в организме человека. За исключением двух аминокислот — лизина и треонина, которые являются у человека абсолютно незаменимыми, остальные «незаменимые» аминокислоты в определенных количествах могут синтезироваться за счет реакций трансаминирования, но объем их синтеза является недостаточным.
Ряд незаменимых аминокислот являются предшественниками для синтеза заменимых. Например, из незаменимой аминокислоты фенилаланина синтезируется заменимая аминокислота тирозин, а из незаменимого метионина — заменимый цистеин. Установлено, что до 80-89% метионина может трансформироваться в цистеин, а 70-75% фенилаланина — в тирозин [2]. По этой причине незаменимых аминокислот метионина и фенилаланина требуется больше, так как существенная их часть должна расходоваться на образование цистеина и тирозина. Аминокислоты цистеин и тирозин по своему физиологическому значению близки к незаменимым аминокислотам, к которым их относили ранее. Таким образом, поступление с пищей цистеина и тирозина позволяют сократить потребность в незаменимых аминокислотах мети-онине и фенилаланине.
Установлено, что до 80-89% метионина может трансформироваться в цистеин, а 70-75% фенилаланина — в тирозин [2]. По этой причине незаменимых аминокислот метионина и фенилаланина требуется больше, так как существенная их часть должна расходоваться на образование цистеина и тирозина. Аминокислоты цистеин и тирозин по своему физиологическому значению близки к незаменимым аминокислотам, к которым их относили ранее. Таким образом, поступление с пищей цистеина и тирозина позволяют сократить потребность в незаменимых аминокислотах мети-онине и фенилаланине.
С метаболических позиций абсолютно заменимыми являются глютаминовая кислота и серин, которые в необходимых количествах синтезируются из кетокислот. Биосинтез остальных «заменимых» аминокислот в организме человека ограничен. По этой и другим причинам полностью обеспечить потребность организма только за счет биосинтеза большинства заменимых аминокислот невозможно. Важно подчеркнуть, что потребность организма в белке, а, стало быть, в аминокислотах — есть величина переменная, которая изменяется на протяжении жизни и может резко возрастать при очень многих физиологических и патологических состояниях.
Подводя итог спорам о важности и незаменимости тех или иных аминокислот, следует подчеркнуть:
• Во-первых, ценность тех или иных аминокислот определяется возможностью их биосинтеза в организме. При этом часть незаменимых аминокислот может синтезироваться в организме, но объем их биосинтеза недостаточен. Разумеется, те аминокислоты, которые ни при каких условиях не образуются в организме и являются абсолютно незаменимыми, должны непрерывно поступать с пищей. Возможности запасания и резервирования лимитирующих аминокислот в составе мышечных белков, альбумина или других белков ограничены.
• Во-вторых, некоторая часть незаменимых аминокислот, помимо пищи, может образовываться при микробиологическом синтезе кишечной микрофлорой и поступать во внутреннюю среду организма.
• В-третьих, физиологическая потребность в незаменимых аминокислотах есть величина переменная и может изменяться в зависимости от активности процессов анаболизма и катаболизма белка, которые, в свою очередь, зависят от уровня физической активности, особенностей обмена веществ, состояния здоровья.
• В-четвертых, обеспечение организма белком и незаменимыми аминокислотами зависит не только от качества, но и режима питания, а также от содержания других компонентов пищевого рациона, например, углеводов. Заменимые аминокислоты занимают
достаточно большой удельный вес в составе белков пищи — до 2/3 суммы аминокислот. В организме человека они выполняют весьма важные функции, причем многие из них играют не меньшую роль, чем незаменимые аминокислоты. Следует подчеркнуть, что хотя заменимые аминокислоты могут образовываться в организме, однако за счет эндогенного биосинтеза обеспечивается лишь минимальная потребность организма. Более того, установлено, что при небольшом потреблении белка в том случае, когда потребность в незаменимых аминокислотах удовлетворяется полностью, лимитирующими становятся заменимые аминокислоты I II [6]. Для обеспечения стабильного азотистого равновесия в организме необходимо примерно в 2 раза больше качественного белка, чем для того, чтобы закрыть потребность в незаменимых аминокислотах. Таким образом, хотя заменимые аминокислоты не являются лимитирующим фактором в белковом питании, но их присутствие в питании также является обязательным. Поступление достаточного количества заменимых аминокислот в составе белков пищи является тем путем, с помощью которого можно обеспечить их оптимальную физиологическую потребность, более легкое и быстрое использования для нужд организма.
Таким образом, хотя заменимые аминокислоты не являются лимитирующим фактором в белковом питании, но их присутствие в питании также является обязательным. Поступление достаточного количества заменимых аминокислот в составе белков пищи является тем путем, с помощью которого можно обеспечить их оптимальную физиологическую потребность, более легкое и быстрое использования для нужд организма.
ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОТДЕЛЬНЫХ АМИНОКИСЛОТ
В организме человека аминокислоты, помимо строительства белковых молекул, выполняют еще целый ряд важных функций:
• Участвуют в образовании других аминокислот.
• Входят в состав разных природных соединений — коферментов, желчных кислот, антибиотиков.
• Участвуют в образовании гормонов, медиаторов и нейротрансмиттеров.
• Являются источниками метаболитов, принимающих участие в обмене веществ.
К числу медиаторов относятся некоторые аминокислоты (глютаминовая и аспарагиновая кислоты, глицин и дофа), а также биогенные амины.
1-Л
о
<3
о
Биогенные амины образуются при отщеплении от аминокислот карбоксильной группы (реакция декарбоксилирования). К их числу относятся: у-аминомасляная кислота, дофамин, норадреналин, адреналин, серотонин, гистамин. Из триптофана через промежуточный продукт 5-гидрокситриптофан образуется нейромедиатор серотонин. Из глютамино-вой кислоты образуется у-аминомасляная кислота.
Гистамин — важнейший медиатор и нейромедиатор, образуется в основном в тучных клетках и нейтрофильных лейкоцитах и участвует в развитии аллергических и воспалительных реакций. При аллергических реакциях высвобождение гистамина происходит под действием аллергенов, лекарств, некоторых тканевых гормонов. В ЦНС гистамин действует как нейромедиатор. Важным системным эффектом гистамина является расширение кровеносных сосудов, снижение артериального давления и частоты сердечных сокращений. Гистамин также стимулирует секрецию соляной кислоты.
При аллергических реакциях высвобождение гистамина происходит под действием аллергенов, лекарств, некоторых тканевых гормонов. В ЦНС гистамин действует как нейромедиатор. Важным системным эффектом гистамина является расширение кровеносных сосудов, снижение артериального давления и частоты сердечных сокращений. Гистамин также стимулирует секрецию соляной кислоты.
Таблица 6
Адреналин — гормон коры надпочечников, где он образуется из аминокислоты тирозина. Адреналин является ключевым гормоном стресса — «аварийным гормоном» и действует на обмен веществ и сердечно-сосудистую систему: повышает сердечную функцию; сужает сосуды, повышая артериальное давление; расширяет бронхи, увеличивая снабжение кислородом; ускоряет расщепление гликогена до глюкозы, обеспечивая энергией мышечную ткань.
Катехоламины — группа биогенных аминов, которые содержат в качестве общего фрагмента производное фенилаланина — катехол. Все эти вещества берут свое начало от аминокислоты тирозина, из которой первоначально образуется аминокислота дофа (3,4-дигидроксифенилаланин). При ее декар-боксилировании образуется дофамин, который в дальнейшем может превращаться в норадреналин и далее в адреналин. Адреналин выполняет функции, как медиатора, так и гормона [2].
Все эти вещества берут свое начало от аминокислоты тирозина, из которой первоначально образуется аминокислота дофа (3,4-дигидроксифенилаланин). При ее декар-боксилировании образуется дофамин, который в дальнейшем может превращаться в норадреналин и далее в адреналин. Адреналин выполняет функции, как медиатора, так и гормона [2].
ПРОДУКТЫ МЕТАБОЛИЗМА И СПЕЦИФИЧЕСКИЕ ФУНКЦИИ ОТДЕЛЬНЫХ АМИНОКИСЛОТ [8]
Аминокислота Метаболиты аминокислот Физиологическая функция
Аргинин Образования N0 Креатин Полиамины Молекулярный биорегулятор Предшественник креатинфосфата Экспрессия генов
Аспарагиновая кислота Основа нуклеотида пиримидина Входит в состав нуклеотидов и нуклеиновых кислот
Гистидин Гистамин Нейромедиатор, медиатор воспаления, стимуляция секреции соляной кислоты
Глицин Основа нуклеотида пурина Порфирин Креатин Гиппуровая кислота Гликохолевая желчная кислота Входит в состав нуклеотидов и нуклеиновых кислот Входит в состав гемоглобина и цитохрома Предшественник креатинфосфата Связывание токсических соединений — детоксикация Эмульгирование липидов
Глютаминовая кислота Глютамин у-аминомасляная кислота Транспорт азота в организме, важный источник энергии, предшественник глутатиона Нейромедиатор
Лизин Гидроксилизин Карнитин Составная часть коллагена Транспорт жирных кислот в клетке
Метионин Холин Составная часть фосфолипидов
Серин Этаноламин Холин-ацетилхолин Составная часть фосфолипидов Нейромедиатор
Тирозин Норадреналин-адреналин Тироксин Меланин Нейромедиатор, гормон Гормон щитовидной железы Пигмент кожи и волос
Триптофан Серотонин Никотиновая кислота Нейромедиатор Витамин, составная часть пуриновых нуклеотидов, NAD и NADH
Цистеин Таурин Таурохолевая желчная кислота Антиокислительная активность Предшественник глутатиона
В процессе обмена веществ отдельные аминокислоты превращаются в метаболиты, которые выполняют важные функции в организме человека. -имидазолилпролиновая кислота) выделен в 1896 году. В значительном количестве содержится в гемоглобине, а также входит в состав карнозина и ансерина. По этой причине недостаток гистидина приводит к снижению уровня гемоглобина. Гемоглобин является одним из резервов гистидина в организме и при недостатке гистидина происходит повышенное разрушение гемоглобина, в результате которого высвобождается гистидин. При декарбоксилировании гистидина образуется гистамин. В ряде продуктов при их хранении, например в рыбе и сыре, происходит микробиологическое декарбоксилирование гисти-дина с образованием и накоплением больших количеств гистамина, что может иметь клинические последствия.
-имидазолилпролиновая кислота) выделен в 1896 году. В значительном количестве содержится в гемоглобине, а также входит в состав карнозина и ансерина. По этой причине недостаток гистидина приводит к снижению уровня гемоглобина. Гемоглобин является одним из резервов гистидина в организме и при недостатке гистидина происходит повышенное разрушение гемоглобина, в результате которого высвобождается гистидин. При декарбоксилировании гистидина образуется гистамин. В ряде продуктов при их хранении, например в рыбе и сыре, происходит микробиологическое декарбоксилирование гисти-дина с образованием и накоплением больших количеств гистамина, что может иметь клинические последствия.
Лейцин (а-аминоизокапроновая кислота) впервые получен из сыра в 1819 году. Его много в составе белка (в среднем 10%). При недостатке лейцина в
Таблица 7
питании у детей происходит задержка роста и снижение массы тела, отмечают изменения в почках и щитовидной железе.
Лизин (а,е-диаминокапроновая кислота) выделен в 1889 году из казеина. Недостаточное содержание лизина в широко распространенных зерновых продуктах и сравнительно высокая потребность в нем организма (3-5 г в сутки) делают его одной из наиболее важных незаменимых аминокислот. Его недостаток в питании приводит к уменьшению числа эритроцитов и снижению гемоглобина, возникают дистрофические изменения в мышцах, в печени и в легких, нарушается кальцификация костей. Наиболее богат лизином мышечный белок — миозин, а также гемоглобин.
Метионин (а-амино-у-метилтиомасля-ная кислота) впервые был выделен в 1922 году из казеина. Метионин относится к серосодержащим аминокислотам и играет исключительно важную роль в обмене веществ и в процессах метилирования и трансметилирования. Метионин является основным донатором метильных групп. В процессе деметилирования метионина образуется гомоцистеин. Метильные группы метионина используются для синтеза хо-лина, который участвует в обмене липидов. Метионин, также как и холин, относится к липотропным веществам, оказывая влияние на обмен липидов и фосфолипидов, он важен в профилактике атеросклероза. При высоком уровне метионина наиболее полно проявляется
Метионин, также как и холин, относится к липотропным веществам, оказывая влияние на обмен липидов и фосфолипидов, он важен в профилактике атеросклероза. При высоком уровне метионина наиболее полно проявляется
I
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Валин Легко переаминируется и теряется, восстанавливает мышцы после физической нагрузки Гипертензия, атаксия
Гистидин Синтез фолиевой кислоты, нуклеиновых кислот, гемоглобина и карнозина, важна при уремии, усиливает секрецию соляной кислоты и пепсина Анемия, нехватка карнози-на, нарушение умственного развития у детей
Изолейцин Много в составе иммуноглобулинов, ключевая роль в утилизации пищи Потеря массы тела, высокий диурез
Лейцин Активирует эндокринную систему, важная роль для иммунной системы Задержка роста и физического развития
Лизин Содержится во всех белках, обеспечивает рост костной ткани, стимулирует митозы, поддерживает половую функцию у женщин, снижает уровень триглицеридов, противовирусное действие Головная боль, тошнота, снижение слуха, медленный рост костной ткани
Метионин Защита печени, детоксикация организма, защита от токсикоза беременных, антиоксидантное действие, синтез гемоглобина, функция щитовидной железы, рост Ожирение, цирроз печени, анемия, кровотечения, атрофия мышц
Треонин Усвоение пищевого белка, липотропное действие, обмен коллагена и эластина, повышает иммунитет Потеря веса, высокий диурез
Фенилала-нин 50% идет на синтез белка, синтез адреналина и тирозина, умственная активность, память, улучшает работу печени и поджелудочной железы Нарушение функции щитовидной железы и надпочечников, гипотония
г^.
о
СО
о
биологическое действие витамина В и фолиевой кислоты. В свою очередь эти витамины стимулируют деметилирование метионина и образование холина. Метионин играет важную роль в функции надпочечников, он необходим для синтеза адреналина. Имеются данные о профилактическом действии метионина при лучевых поражениях и бактериальной интоксикации.
Треонин (а-амино-в-оксимасляная кислота) получен в 1935 году из фибрина. Дефицит треонина вызывает задержку роста и снижение массы тела.
Триптофан (а-амино-в-индолилпропионовая кислота) выделен в 1901 году. Важнейшая из незаменимых аминокислот необходим для роста и поддержания азотистого равновесия, участвует в биосинтезе белков сыворотки крови и гемоглобина. Триптофан играет важную роль в образовании никотиновой кислоты (витамина РР).
Триптофан играет важную роль в образовании никотиновой кислоты (витамина РР).
Фенилаланин (а-амино-в-фенилпропионовая кислота) выделен в 1879 году. Фенилаланин регулирует функцию щитовидной железы и надпочечников. Из него образуется гормон тироксин, а также аминокислота тирозин, из которого, в свою очередь, образуется адреналин. Тирозин может образовываться из фенилаланина, однако обратного образования фенилаланина из тирозина не происходит.
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ЗАМЕНИМЫХ АМИНОКИСЛОТ
Аргинин (амино-$-гуанидин валериановая кислота) открыт в 1886 году. Играет очень важную роль в обмене веществ. Белки ядер сперматозоидов содержат до 80% аргинина. Аргинин является предшественником оксида азота (N0), который является важным молекулярным биорегулятором. Введение аргинина приводит к расширению сосудов и существенному снижению артериального давления при гипертонической болезни. Регулярное назначение аргинина способствует улучшению клинического состояния больных ишемической болезнью сердца. Помимо этого он снижает вязкость крови и уменьшает риск тромбоза сосудов. При физической нагрузке аргинин способствует улучшению кровотока в коронарных артериях. Аргинин ускоряет регенерацию печени при ее токсическом поражении и может применяться при лечении цирроза печени и жирового гепатоза. Ингаляционное назначение аргинина при муковис-цидозе приводит к быстрому улучшению функции легких, он помогает при астматическом бронхите.
Регулярное назначение аргинина способствует улучшению клинического состояния больных ишемической болезнью сердца. Помимо этого он снижает вязкость крови и уменьшает риск тромбоза сосудов. При физической нагрузке аргинин способствует улучшению кровотока в коронарных артериях. Аргинин ускоряет регенерацию печени при ее токсическом поражении и может применяться при лечении цирроза печени и жирового гепатоза. Ингаляционное назначение аргинина при муковис-цидозе приводит к быстрому улучшению функции легких, он помогает при астматическом бронхите.
Известно, что аргинин стимулирует активность Т-лимфоцитов, предотвращает возрастное угнетение фагоцитоза макрофагами. Неспецифическая стимуляция иммунной функции аргинином сопровождается снижение частоты рака толстой кишки и молочной железы у экспериментальных животных. Назначение аргинина больным сахарным диабетом 2-го типа существенно повышает чувствительность к инсулину рецепторов клеток организма. У пациентов
У пациентов
с сахарным диабетом он ингибирует гликозилиро-вание гемоглобина, снижая развитие осложнений. У лиц с повышенной физической нагрузкой аргинин усиливает действие инсулина и увеличивает рост кровеносных капилляров в скелетных мышцах. Аргинин стимулирует выработку соматотропного гормона (гормона роста), способствует уменьшению жировых отложений, росту мышечной массы, увеличивает активность и физическую выносливость, улучшает настроение. Он повышает половую функцию, увеличивают выработку сперматозоидов.
Аргинин не рекомендуют беременным и кормящим женщинам, больным шизофренией. Он может стимулировать свободнорадикальные процессы, поэтому его следует принимать в сопровождении антиоксидантов.
Глицин (аминоуксусная кислота) — наиболее простая из аминокислот, в большом количестве содержится в клетках головного и спинного мозга. Он является метаболитом широкого спектра действия, специфическим регулятором активности нервных клеток, тормозным медиатором. Глицин способен связывать различные эндогенные и экзогенные (лекарства) соединения. В настоящее время его применяют как успокаивающее (седативное) средство, он улучшает мозговую функцию. Менее известна его способность нормализовать синтез коллагена и соединительной ткани.
Он является метаболитом широкого спектра действия, специфическим регулятором активности нервных клеток, тормозным медиатором. Глицин способен связывать различные эндогенные и экзогенные (лекарства) соединения. В настоящее время его применяют как успокаивающее (седативное) средство, он улучшает мозговую функцию. Менее известна его способность нормализовать синтез коллагена и соединительной ткани.
Глютамин (8-амид-а-аминоглутаровая кислота) — самая распространенная свободная аминокислота в организме человека (в мышечной ткани содержание свободного глютамина составляет 67%). Очень активно обменивается в организме и является наиболее важной для переноса азота в печень и другие органы. Однако содержание глютамина в составе белка сравнительно небольшое — 5-7% (на лейцин приходится 10%). Глютамин является важным энергетическим субстратом для клеток печени, эпителиальных клеток тонкой кишки и иммунных клеток. Введение глютамина тяжелым больным ослабляет потерю мышечной массы улучшает функцию всасывания. Наличие глютамина является необходимым условием синтеза нуклео-тидов — пиринов и пиримидинов.
Наличие глютамина является необходимым условием синтеза нуклео-тидов — пиринов и пиримидинов.
Глютамин играет ключевую роль в регуляции синтеза глутатиона — трипептида, состоящего из глютаминовой кислоты, цистеина и глицина. Глутатион является важнейшим эндогенным анти-оксидантом и защищает клетки от окислительного повреждения. Потребность в глютамине возрастает при окислительном стрессе.
Глютаминовая кислота (аминоглютаровая кислота) выделена в 1866 году из эндосперма пшеницы. Глютаминовая кислота играет активную роль в обмене белка и в удалении из организма продуктов распада. Глютаминовая кислота является единственной аминокислотой, поддерживающей дыхание клеток головного мозга. Аминокислоту применяют при лечении некоторых нервных и психических заболеваний. Глютаминовая кислота
участвует в поддержании кислотно-щелочного го-меостаза в крови и тканях.
Пролин (пирролидин-а-карбоновая кислота) — способствует заживлению ран, укрепляет сухожилия, связки и суставы, увеличивает физическую работоспособность, укрепляет сердечную мышцу.
Тирозин (а-амино-в-параоксифенилпропионовая кислота) — способствует функционированию щитовидной железы (синтез тироксина), гипофиза, надпочечников, снижает раздражительность, усталость, стресс, укрепляет сон.
Цистеин (ди-а-амино-в-тиопропионовая кислота) — способствует заживлению ожогов и ран, регенерации кожи, активирует иммунную систему, обладает антиоксидантной активностью.
ПОТРЕБНОСТЬ В АМИНОКИСЛОТАХ
Физиологическая потребность в аминокислотах окончательно не установлена. Проведенные исследования позволили выявить ориентиры потребности в незаменимых аминокислотах, отражающие минимальную потребность, «безусловно достаточное количество» и минимальные показатели суточной потребности [6]. Считают, что может быть «только один уровень физиологической потребности в незаменимых аминокислотах для здорового человека, хотя этот уровень для разных людей и в разное время может быть различным». ФАО/ВОЗ предложил в качестве идеального белка аминокислотную шкалу, в которой представлены незаменимые аминокислоты в расчете на 100 г стандартного белка. Однако данная шкала далека от идеального белка, о чем мы будем говорить ниже.
Считают, что может быть «только один уровень физиологической потребности в незаменимых аминокислотах для здорового человека, хотя этот уровень для разных людей и в разное время может быть различным». ФАО/ВОЗ предложил в качестве идеального белка аминокислотную шкалу, в которой представлены незаменимые аминокислоты в расчете на 100 г стандартного белка. Однако данная шкала далека от идеального белка, о чем мы будем говорить ниже.
Поскольку заменимые аминокислоты могут образовываться в организме, определение их физиологической потребности также непросто. В 2004 году в РФ предложены (на основе расчета) значения адекватного и верхнего уровня потребности для заменимых и незаменимых аминокислот, табл. 9.
Как видно из таблицы, в 2004 году по сравнению с 1971-м суточная потребность примерно для половины аминокислот была пересмотрена как в сторону повышения (аспарагиновая кислота, серин и аланин), так и в сторону снижения (фенилаланин, валин, метионин, триптофан и глютами-новая кислота).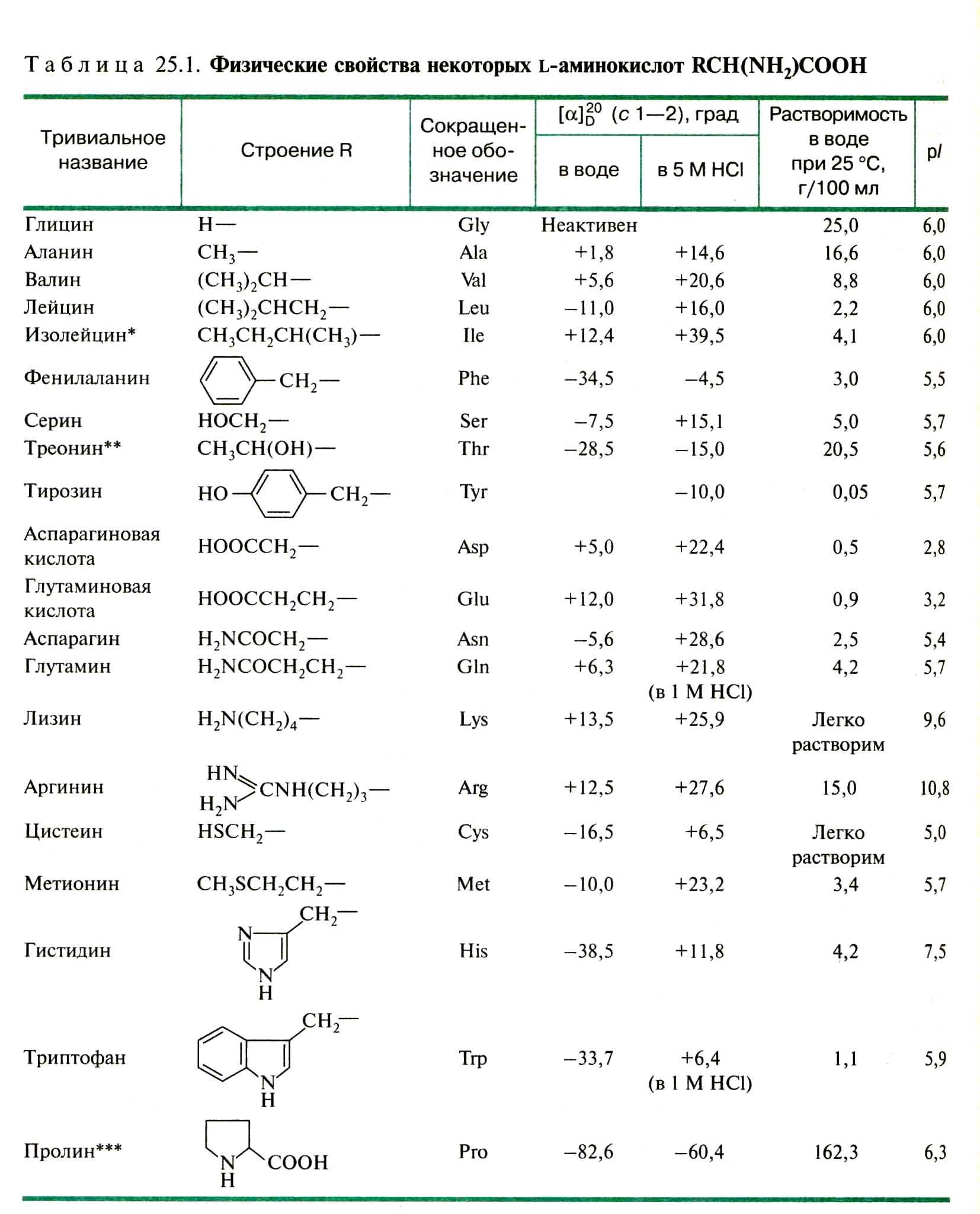 При этом суточная потребность в заменимых аминокислотах выше (в 2,5 раза), чем в незаменимых, и в настоящее время составляет 56,9 г/сутки (72%), против 22,6 г/сутки (28%) для незаменимых аминокислот. В соответствии с современными нормами потребности среди незаменимых аминокислот доминируют: лейцин, фенилаланин и лизин, тогда как среди заменимых: глютамин (включая глютамат), аспарагин (включая аспартат) и серин. Следует подчеркнуть, что в соответствии с нормами потребности заменимых аминокислот должно быть в 2-2,5 раза больше, чем незаменимых.
При этом суточная потребность в заменимых аминокислотах выше (в 2,5 раза), чем в незаменимых, и в настоящее время составляет 56,9 г/сутки (72%), против 22,6 г/сутки (28%) для незаменимых аминокислот. В соответствии с современными нормами потребности среди незаменимых аминокислот доминируют: лейцин, фенилаланин и лизин, тогда как среди заменимых: глютамин (включая глютамат), аспарагин (включая аспартат) и серин. Следует подчеркнуть, что в соответствии с нормами потребности заменимых аминокислот должно быть в 2-2,5 раза больше, чем незаменимых.
Аминокислотный скор. Качество белка можно оценивать, сравнивая его аминокислотный состав с составом стандартного (идеального) белка. Такой расчет называют аминокислотным скором (оценкой). Аминокислотный скор определяют по формуле:
I
Таблица 8
ФУНКЦИИ И ПРИЗНАКИ НЕДОСТАТОЧНОСТИ ЗАМЕНИМЫХ АМИНОКИСЛОТ [6]
Аминокислота Функция Признаки недостаточности
Аргинин Образование мочевины, регулирует рост, тормозит рост опухолей за счет стимуляции иммунитета, детоксикация печени Нарушение роста, риск развития сахарного диабета, эректильная дисфункция
Глицин Синтез коллагена и соединительной ткани, седативное действие, нормализует мозговую функцию и сон, связывание аммиака. Увеличивает синтез лецитина Артрозы и артриты Повышенная возбудимость
Увеличивает синтез лецитина Артрозы и артриты Повышенная возбудимость
Глютамин Переносчик аминных групп, важный энергетический субстрат для печени, тонкой кишки и иммунной системы, играет ключевую роль в регуляции синтеза глутатиона Быстрая потеря мышечной массы у больных, окислительный стресс
Пролин Синтез коллагена и соединительной ткани
Таурин Незаменим у детей, необходим в критических состояниях Нарушение развития мозга, миокарда, ЖКТ
Тирозин Синтез тироксина, пигмента кожи меланина, норадренали-на и адреналина Нарушение пигментации кожи
Триптофан Образование альбумина, выработка серотонина, снижает содержание жира, гипотензивное действие, синтез альбумина и глобулинов, гормона роста, антидепрессант, улучшает сон, снижает аппетит Анемия, стерильность, выпадение волос, депрессия, тревожность
Цистеин Процессы регенерации и заживления ожогов и ран Длительное заживление ран
о о
CD CD
(содержание аминокислоты данного белка (г/100 г) / содержание аминокислоты стандартного белка (г/100 г)) х 100.
Если в исследуемом белке содержание какой-либо аминокислоты будет менее 100%, то эта аминокислота окажется лимитирующей. Для взрослого человека в качестве идеального белка применяют шкалу ФАО/ВОЗ, в которой указано содержание каждой из незаменимых аминокислот в расчете на 100 г белка. Однако для человека и животных существует другие белки, которые в определенные периоды жизни являются единственным источником аминокислот для растущего организма. Среди белков животного происхождения к ним относятся белки молока и яйца. Среди растительных белков
Таблица 9
такими белками являются, например, белки сои, орехов, зародыша пшеницы и др. Сравним состав незаменимых аминокислот женского молока, который можно считать эталонным, с составом аминокислот известных животных (табл. 10) и растительных (табл. 11) белков [9].
Как видно из таблицы, состав незаменимых аминокислот женского молока является достаточно уникальным и не похожим как по составу, так и по соотношению аминокислот среди аналогичных по значимости белков коровьего молока и куриного яйца. В составе коровьего молока незаменимых аминокислот на 11% меньше, чем в женском молоке, в белке коровьего молока на 30% меньше валина, хотя метионина на 61% больше. Куриное яйцо по
В составе коровьего молока незаменимых аминокислот на 11% меньше, чем в женском молоке, в белке коровьего молока на 30% меньше валина, хотя метионина на 61% больше. Куриное яйцо по
РЕЙТИНГ ПОТРЕБНОСТИ ВЗРОСЛОГО ЧЕЛОВЕКА В АМИНОКИСЛОТАХ (г/сутки)
Аминокислоты А.Э. Шарпенак [6] Rous, Mesy, Block [6] ФАО/ВОЗ г/100 г белка [4] О.П. Молчанова, 1971 [6] Адекватный уровень (РФ, 2004) Верхний уровень (РФ, 2004)
Незаменимые
Лейцин 10,0*** 9,1 6,6 4-6 4,6 7,3
Фенилаланин 4,5 4,4 6,3* 2-4 4,4* 6,9*
Лизин 8,0 5,2 5,8 3-5 4,1 6,4
Валин 6,0 3,8 3,5 4,0 2,5 3,9
Треонин — 3,5 3,4 2-3 2,4 3,7
Изолейцин — 3,3 2,8 3-4 2,0 3,1
Метионин 2,5 3,8** 2,5** 2-4 1,8** 2,8**
Триптофан 1,6 1,1 1,1 1,0 0,8 1,2
Суммарно, г/сутки 32,6 34,2 32,0 26 22,6 35,3
% аминокислот 32% 34% 28% 28%
Заменимые
Глютамин + глютаминовая кислота 16,0 13,6 21,8
Аспарагин + аспарагиновая кислота 6,0 12,2 19,9
Серин 3,0 8,3 13,3
Аланин 3,0 6,6 10,6
Аргинин 6,0 6,1 9,8
Пролин 5,0 4,5 7,2
Глицин 3,0 3,5 5,6
Гистидин 2,0 2,1 3,4
Тирозин 3-4
Цистеин 2-3
Суммарно, г/сутки 68 50 56,9 91,6
% аминокислот 68% 66% 72% 72%
Сумма всех аминокислот 100 76 79,5 126,9
заменимые : незаменимые 2,12 1,92 2,5 2,6
Примечание:* — фенилаланин + тирозин; ** — метионин + цистеин; *** — лейцин + изолейцин.
Таблица 10
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И ЖИВОТНЫХ БЕЛКОВ
Аминокислоты Женское молоко Коровье молоко Куриное яйцо Рыба Мясо ФАО/ВОЗ
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 9,7 95 9,2 90 9,1 89 8,7 85 6,6 65
Валин 9,9 6,9 70 7,3 74 6,1 62 5,9 60 3,5 35
Лизин 8,5 7,5 88 7,9 93 9,5 112 8,6 101 5,8 68
Изолейцин 7,6 6,2 82 8,0 105 6,0 79 4,5 59 2,8 37
Фенилаланин 5,9 5,7 97 7,3 124 4,8 81 4,5 76 6,3* —
Треонин 5,0 4,6 92 5,9 118 5,1 102 5,3 106 3,4 68
Метионин 2,3 3,7 161 4,1 178 2,6 113 3,2 139 2,5** —
Триптофан 1,9 1,6 84 1,5 79 0,8 42 1,2 63 1,1 58
Аргинин*** 5,0 4,3 86 6,5 130 8,1 162 6,5 130 — —
Гистидин*** 2,7 2,5 93 2,1 78 2,6 96 3,0 111 — —
Суммарно 51,3 45,9 89 51,2 100 44,0 86 41,9 82 32,0 62
Заменимые 48,7 54,1 48,8 56,0 58,1 68,0
Заменимые : незаменимые 0,94 1,18 0,95 1,27 1,39 2,13
Примечание: * — фенилаланин + тирозин; ** — метионин + цистеин; *** — заменимые аминокислоты.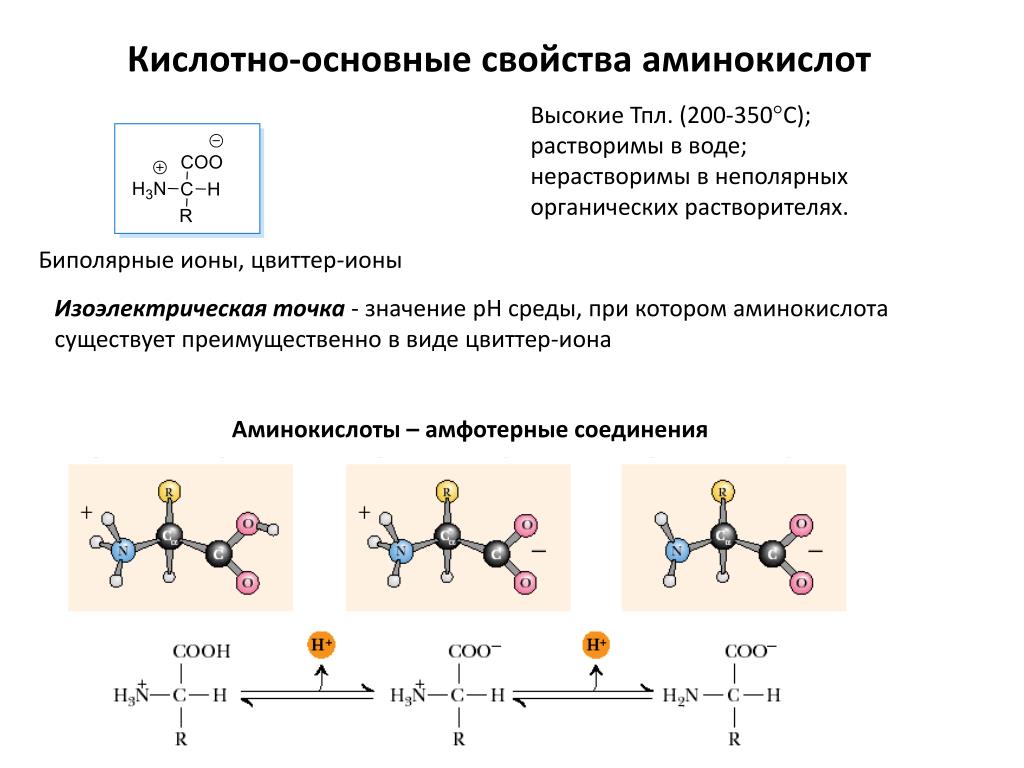
Таблица 11
СРАВНИТЕЛЬНЫЙ СОСТАВ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ ЖЕНСКОГО МОЛОКА
И РАСТИТЕЛЬНЫХ БЕЛКОВ
Аминокислоты Женское молоко Соевые бобы Овсяные хлопья Пшеничная мука Картофель
Незаменимые г/100 г г/100 г % г/100 г % г/100 г % г/100 г %
Лейцин 10,2 7,7 75 7,7 75 6,2 61 10* 56
Валин 9,9 5,3 54 5,3 54 4,3 43 4,0 40
Лизин 8,5 6,9 81 3,0 35 2,5 29 2,6 31
Изолейцин 7,6 5,8 76 5,3 70 3,1 41
Фенилаланин 5,9 5,0 85 4,6 78 4,8 81 6,4 108
Треонин 5,0 4,4 88 3,5 70 2,8 56 3,1 62
Метионин 2,3 1,3 57 1,2 52 1,2 52 1,5 65
Триптофан 1,9 1,3 68 1,3 68 1,3 68 0,6 32
Аргинин** 5,0 7,3 146 7,4 148 4,5 90 1,4 28
Гистидин** 2,7 2,5 93 2,0 74 2,0 74 0,6 22
Суммарно 51,3 37,7 73 31,9 62 26,2 51 28,2 55
Заменимые 48,7 62,3 68,1 73,8 71,8
Заменимые : незаменимые 0,94 1,65 2,13 2,82 2,55
Примечание: * — лейцин + изолейцин; ** — заменимые аминокислоты. а белку женского молока, и кроме фенилаланина, ™ являются дефицитными практически по всем не° а__заменимым аминокислотам, особенно по лизину
а белку женского молока, и кроме фенилаланина, ™ являются дефицитными практически по всем не° а__заменимым аминокислотам, особенно по лизину
(29-35%), валину (40-54%) и метионину (52-65%). Среди наиболее распространенных растительных белков, безусловно, лучшим является белок сои, который содержит существенно больше незаменимых аминокислот, чем другие растительные белки. Однако белок сои дефицитен по валину (54%), метионину (57%) и изолейцину (76%). Обращает на себя внимание доминирование в растительном белке заменимых аминокислот, которых больше чем незаменимых в 1,6-2,5 раза.
Сравнивая состав незаменимых аминокислот «идеального» белка ФАО/ВОЗ с белками женского или коровьего молока, а также яйца, можно увидеть, что последние отличаются принципиально иным составом и соотношением заменимых и незаменимых аминокислот близким к 1,0. Тогда как в «идеальном» белке ФАО/ВОЗ, а также в современных отечественных нормах это соотношение больше 2,0 (2,12-2,5), что характерно для белков растительного происхождения. Таким образом, по составу незаменимых аминокислот к идеальному белку наиболее близки белки яиц и молока. Белки рыбы
Таким образом, по составу незаменимых аминокислот к идеальному белку наиболее близки белки яиц и молока. Белки рыбы
и мяса по содержанию аминокислот существенно отличаются от идеала, а растительные белки имеют еще более низкую биологическую ценность.
Биологическая ценность белка — доля задержки азота в организме от всего белка, попавшего в кровь. Мерой биологической ценности является такое количество белка, которое необходимо для поддержания азотистого равновесия в организме человека или животных. Если в белке есть все необходимые организму незаменимые и заменимые аминокислоты в нужном количестве и в необходимых пропорциях, и они полностью всасываются в желудочно-кишечном тракте, то его биологическая ценность будет равна 100. Когда в составе белка соотношение аминокислот неоптимальное, имеется дефицит отдельных незаменимых аминокислот или если белок плохо усваивается, то его биологическая ценность будет заведомо ниже (табл. 12).
12).
Кругооборот белка в организме человека — явление физиологическое и связано с необходимостью обновления белка. Дело в том, что большинство белков и, прежде всего ферменты, живут недолго и могут разрушаться через несколько часов после биосинтеза. Значительно более долговечны структурные белки, гистоны, гемоглобин или компоненты цитоскелета клетки. Полупериод жизни белков в организме человека в среднем составляет 2-8 дней. Постоянное обновление белка играет важную роль в обмене веществ и является весьма эффективным механизмом регуляции активности ферментов, обновления пула иммуноглобулинов, удаления дефектных и ненужных в данное время белков. Быстрое разрушение требуется для удаления из организма биологически активных пептидов и пептидных гормонов. Постоянное разрушение и ресинтез новых белков позволяет клеткам «быстро приводить в соответствие с метаболическими потребностями уровень и активность наиболее важных ферментов» [2]. Ориентировочно в организме взрослого человека ежедневно в результате протеолиза деградирует до аминокислот 300-400 г белка. В то же время примерно столько же аминокислот включается во вновь
В то же время примерно столько же аминокислот включается во вновь
Таблица 12
ОЛ
сэ
КАЧЕСТВО НЕКОТОРЫХ ПИЩЕВЫХ БЕЛКОВ ОТНОСИТЕЛЬНО БЕЛКОВ ЖЕНСКОГО МОЛОКА
Пищевой белок Химическая ценность, % Биологическая ценность, % Дефицитные аминокислоты
Женское молоко 100 95 Нет
Яйцо куриное 100 87 Валин (74%), триптофан (79%)
Говядина 98 93 Изолейцин (59%), валин (60%), триптофан (63%), фенилала-нин (76%)
Коровье молоко 95 80-82 Валин (70%)
Рыба 61-86 Триптофан (42%), валин (62%), изолейцин (79%)
Соя 61-73 Валин (64%), метионин (57%), лейцин (75%), изолейцин (76%)
Белый хлеб 47 30 Лизин (29%), изолейцин (41%), валин (43%), метионин (52%), треонин (56%), лейцин (61%), триптофан (68%)
образованные белки. Оба эти процесса формируют кругооборот белка в организме. Учитывая, что в организме содержится около 10 кг различных белков, текущий протеолиз затрагивает всего 3% белка [2].
Оба эти процесса формируют кругооборот белка в организме. Учитывая, что в организме содержится около 10 кг различных белков, текущий протеолиз затрагивает всего 3% белка [2].
В результате протеолиза образуются аминокислоты, которые могут быть использованы клеткой для биосинтеза новых белков или поступают в кровь, формируя пул свободных аминокислот, объем которого составляет около 100 г. Деградация белка в клетках осуществляется с помощью двух специализированных систем: лизосом и протеосом. Важную роль в осуществлении деградации белков организма играет система пищеварения, в которой переваривается, а затем реутилизируется значительная часть плазматических и других эндогенных белков, а также белки, которые попадают в просвет кишки при слущивании завершивших свою работу эпителиальных клеток. В ходе деградации белка может накапливаться аминный азот, который, в отличие от углеводородной части аминокислот, непригоден для получения энергии. Поэтому аминогруппы, которые не могут быть использованы повторно, например, в реакциях трансаминирования, превращаются в аммиак, а затем — в мочевину.
Поэтому аминогруппы, которые не могут быть использованы повторно, например, в реакциях трансаминирования, превращаются в аммиак, а затем — в мочевину.
В организме человека существует весьма эффективный механизм регуляции уровня белка. Чем выше дефицит белка в организме, тем лучше
Таблица 13
усваивается пищевой белок, и тем меньше будут потери аминокислот с калом и мочой. С другой стороны, чем больше белка содержится в пище, тем хуже он будет усваиваться. При отсутствии дефицита белка в организме его усвоение в желудочно-кишечном тракте также снижается. Механизм регуляции уровня белка в организме человека также связан с увеличением кругооборота белка и аминокислот при его дефиците и снижением кругооборота и усилением катаболизма белка при его избыточном поступлении с пищей. Таким образом, организм способен в определенной степени сглаживать дефицит белка, в то же время препятствуя перегрузке организма пищевым белком. Например, после приема пищи с высоким содержанием белка более половины аминокислот (57%), поступающих в печень, превращается в мочевину, 14% аминокислот остаются в печени и 23% — выходят в кровь и поступают в пул свободных аминокислот. Только 6% аминокислот используется печенью для синтеза белков [2].
Например, после приема пищи с высоким содержанием белка более половины аминокислот (57%), поступающих в печень, превращается в мочевину, 14% аминокислот остаются в печени и 23% — выходят в кровь и поступают в пул свободных аминокислот. Только 6% аминокислот используется печенью для синтеза белков [2].
Свободные аминокислоты, находящиеся в крови, захватываются печенью, почками, поджелудочной железой, тонкой кишкой,
РЕЙТИНГ СОДЕРЖАНИЯ АМИНОКИСЛОТ В КРОВИ И В МОЧЕ ЧЕЛОВЕКА [10]
Аминокислота Содержание в крови, мг/100 мл Экскреция с мочой в сутки, мг
Незаменимые диапазон в среднем
Валин 2,88 4-6 5,0
Лизин 2,72 7-48 27,5
Лейцин 1,86 9-26 17,5
Треонин 1,67 15-53 34,0
Изолейцин 1,34 14-28 21
Триптофан 1,27
Метионин 0,52 5-10 7,5
Заменимые
Аланин 3,40 21-71 46
Пролин 2,36 Менее 10 10
Аргинин 1,62
Глицин 1,50 21-71 46
Цистеин 1,47 10-21 15,5
Гистидин 1,38 113-320 217
Серин 1,12 27-73 50
Тирозин 1,04 15-49 32
Глютамат 0,70 8-40 24
Аспартат 0,03 Менее 10 10
т
сэ
более 85% свободных аминокислот покидает систему кровообращения в течение 5-15 минут, поэтому концентрация аминокислот в крови достаточно низкая — 35-70 мг/100 мл [2] (табл. 13).
13).
ЗАКЛЮЧЕНИЕ
Таким образом, потребность человека в белке во многом зависит от качественного состава аминокислот, и прежде всего незаменимых. Поэтому белков животного происхождения, которые наиболее близки по составу аминокислот к белкам организма человека, требуется меньше, чем белков растительных, аминокислотный состав которых существенно отличается от оптимального для человека. Например, при употреблении белков с высокой биологической ценностью (мяса, молока, яиц) для удовлетворения потребности взрослого человека достаточно 0,75 г/ кг массы тела (52,5 г белка/сутки). При употреблении смешанного рациона (белки животного и растительного происхождения) потребность в белке будет составлять 0,85-1,0 г кг массы тела (59,5-70,0 г белка/сутки). Более того, при потреблении животных белков с калом теряется 2,5-3,0% азота, тогда как употреблении в пищу растительных продуктов, богатых клетчаткой (овощи, зерновые) — до 40% пищевого азота [6].
Низкие нормы потребности в белке, которые в свое время предлагали Ро и Читтенден, а затем и Вильямс, были основаны на классических представлениях об азотистом балансе (равновесии). Согласно этим представлениям для поддержания азотистого (белкового) равновесия в организме большинства взрослых людей, которые здоровы и находятся в покое, может быть достаточно 30 г белка/сутки. Читтенден, который изучал белковый обмен у молодых людей (студентов, солдат, спортсменов), показал, что азотистое равновесие вполне может обеспечить 55-60 г белка/сутки [7].
В принципе для поддержания азотистого равновесия у взрослого и здорового человека на минимальном уровне достаточно 36,9 г молочного белка/ сутки. С учетом высокого качества белка куриного яйца минимальная потребность в белке для поддержания азотистого равновесия может составлять 0,34-0,43 г белка/кг массы тела в сутки, или 28 г яичного белка в сутки [11]. Однако для обеспечения «надежного уровня потребления», белка требуется больше — 56,25-57,5 г белка казеина в сутки при калорийности пищевого рациона около 3000 ккал/ сутки. Для нормального физического развития, повышения работоспособности и устойчивости к неблагоприятным внешним воздействиям, а также сопротивляемости организма к инфекции белка нужно еще больше, чем то количество, которое всего лишь «обеспечивает поддержание азотистого равновесия». В этой связи выделяют «оптимальную потребность человека в белке», которая должна превышать надежный уровень на 50% и будет составлять 84,4-87,5 г белка/сутки [7].
Однако для обеспечения «надежного уровня потребления», белка требуется больше — 56,25-57,5 г белка казеина в сутки при калорийности пищевого рациона около 3000 ккал/ сутки. Для нормального физического развития, повышения работоспособности и устойчивости к неблагоприятным внешним воздействиям, а также сопротивляемости организма к инфекции белка нужно еще больше, чем то количество, которое всего лишь «обеспечивает поддержание азотистого равновесия». В этой связи выделяют «оптимальную потребность человека в белке», которая должна превышать надежный уровень на 50% и будет составлять 84,4-87,5 г белка/сутки [7].
Таким образом, потребность в белке должна складываться из некоего минимального количества — «безопасного уровня белка», который обеспечивает «надежный уровень потребления», и «дополнительного количества белка», который учитывает особенности обмена веществ, состояние здоровья и качественный состав пищевого рациона. Безопасный уровень белка обеспечивает надежное поддержание азотистого равновесия в организме определенного числа людей, а введение дополнительного количества белка необходимо для заполнения так называемых «лабильныхрезервов белка».
В 1973 году ФАО/ВОЗ путем расчета определило, что величина средней потребности в белке населения развитых стран должно составлять 48,5-56,6 г/ сутки (при относительной биологической ценности 70-80%). Для развивающихся стран, в питании которых присутствует большая доля низкокачественного растительного белка (относительная биологическая ценность — 60-70%), средняя потребность в белке была определена равной 56,6-65,5 г в сутки [11].
Чем ниже биологическая ценность белка, тем больше его требуется. Однако в этом случае некоторые аминокислоты будут поступать в организм человека в избыточном количестве, превышающем текущие потребности, связанные с биосинтезом белка и специфическим метаболизмом отдельных аминокислот. Белки и аминокислоты не способны запасаться в организме, поэтому лишние аминокислоты будут либо выводиться из организма, либо подвергаться метаболической деградации. Содержащийся в аминокислотах азот будет превращаться в мочевину и креатинин и выделяться с почками, углеродный скелет — использоваться для биосинтеза глюкозы или жирных кислот, а другая его часть — окисляться до углекислого газа и воды с образованием АТФ.
Потребность в белке во многом зависит от калорийности и состава других компонентов пищевого рациона — углеводов и липидов (табл. 14). Низкокалорийные диеты или диеты с недостаточным количеством углеводов увеличивают потребность в белке, поскольку часть белка начинает расходоваться для образования глюкозы и кетоновых тел. При отсутствии в пищевом рационе углеводов и жиров для достижения азотистого равновесия пищевого белка требуется в 5 раз больше [6]. С увеличением калорийности пищевого рациона потребность в белке снижается.
Таким образом, рассматривая потребность организма в белке и аминокислотах, можно сделать следующие выводы:
• Белок пищи необходим не только для биосинтеза белков организма, но и для решения энергетических проблем, особенно в критических ситуациях.
• Отдельные аминокислоты пищевого белка выполняют в организме самостоятельную функцию, что необходимо учитывать при назначении
Таблица 14
ВЛИЯНИЕ КАЛОРИЙНОСТИ РАЦИОНА НА ПОТРЕБНОСТЬ В БЕЛКЕ ДЛЯ ПОДДЕРЖАНИЯ АЗОТИСТОГО РАВНОВЕСИЯ [12]
Калорийность рациона Потребность в белке для нулевого баланса Безопасный уровень потребления белка
ккал/кг кал/70 кг г/кг г/70 кг г/кг г/70 кг
40 2800 0,78 54,6 1,02 71,4
45 3150 0,56 39,2 0,74 51,8
48 3360 0,51 35,7 0,62 43,4
57 4000 0,42 29,4 0,50 35
Рекомендуемая норма потребления 0,80 56
I
аминокислот, используя отдельные аминокислоты для коррекции питания.
• Идеальными белками по составу и пропорциям незаменимых аминокислот являются белки молока и куриного яйца и в меньшей степени — белки мяса. Растительные белки содержат аминокислоты в иных пропорциях и дефицитны по большинству незаменимых аминокислот.
• Избыточное потребление белковой пищи «не идет нам впрок», поскольку лишние аминокислоты пищи будут разрушаться, а белковый азот удаляться из организма. Потребление белка
должно быть равномерным на протяжении суток, что позволяет оптимизировать его всасывание и утилизацию, а также свести к минимуму потери аминокислот.
• Умеренное потребление белка не является столь катастрофичным для организма человека, поскольку при этом снижаются потери аминокислот.
• Для достижения разных целей необходимы белковые модули с разным количеством и соотношением как заменимых, так и незаменимых аминокислот.
ЛИТЕРАТУРА
1. ЛенинджерА.Л. Основы биохимии. — М.: Мир, 1985. — Т. 1. — 365 с.
2. КольманЯ., РемК.-Г. Наглядная биохимия. — М.: Мир, 2000. — 469 с.
3. Попова Т.С., Шестопалов А.Е., Тамазашвили Т.Ш., Лейдерман И.Н. Нутритивная поддержка больных в критических состояниях. — М., 2002. — 320 с.
4. Мартинчик А.Н., Маев И.В., Петухов А.Б. Питание человека (основы нутрициологии). — М.: ГОУ ВУНМЦ МЗ РФ, 2002. — 572 с.
5. Ньюсхолм Э., Старт К. Регуляция метаболизма. — М.: Мир, 1977. — 408 с.
6. Гигиена питания / Под ред. К.С. Петровского. — М.: Медицина, 1971.— Т. 1. — 511 с.
7. Высоцкий В.Г. К оценке потребности человека в белке // Вопросы питания. — 1978. — № 6. — С. 8-17.
Высоцкий В.Г. К оценке потребности человека в белке // Вопросы питания. — 1978. — № 6. — С. 8-17.
8. Основы клинического питания. — Петрозаводск: ИнтелТек, 2003. — 412 с.
9. Химический состав пищевых продуктов. Книга 2. — М.: ВО Агропромиздат, 1987. — 360 с.
10. Большая медицинская энциклопедия. — М.: Медицина, 1974. — Т. 1. — С. 364-371.
11. Energy and Protein Requirements // WHO Tech. Rep. Ser. — 1973. — No 522. — P. 40-72.
12. Общая нутрициология. — М.: МЕДпресс-информ, 2005. — 392 с.
LЛ
CD
Общая характеристика аминокислот — Аминокислоты — Статьи
Аминокислоты — органические кислоты, молекулы которых содержат одну или несколько аминогрупп (NH2-группы). Представляют основные структурные элементы белков. Белки пищи в организме человека расщепляются до аминокислот. Определенная часть аминокислот, в свою очередь, расщепляется до органических кетокислот, из которых в организме вновь синтезируются новые аминокислоты, а затем белки. В природе обнаружено свыше 20 аминокислот.
Представляют основные структурные элементы белков. Белки пищи в организме человека расщепляются до аминокислот. Определенная часть аминокислот, в свою очередь, расщепляется до органических кетокислот, из которых в организме вновь синтезируются новые аминокислоты, а затем белки. В природе обнаружено свыше 20 аминокислот.
Аминокислоты всасываются из желудочно-кишечного тракта и с кровью поступают во все органы и ткани, где используются для синтеза белков и подвергаются различным превращениям. В крови поддерживается постоянная концентрация аминокислот. Из организма выделяется около 1 г азота аминокислот в сутки. В мышцах, ткани головного мозга и печени содержание свободных аминокислот во много раз выше, чем в крови, и менее постоянно. Концентрация аминокислот в крови позволяет судить о функциональном состоянии печени и почек. Содержание аминокислот в крови может заметно нарастать при нарушениях функции почек, лихорадочных состояниях, заболеваниях, связанных с повышенным содержанием белка.
Аминокислоты подразделяются на незаменимые (валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин), частично заменимые (аргинин и гистидин) и заменимые (аланин, аспарагин, аспарагиновая кислота, глицин, глутамин, глутаминовая кислота, пролин, серин, тирозин, цистеин).
Незаменимые аминокислоты не синтезируются в организме человека, но необходимы для нормальной жизнедеятельности. Они должны поступать в организм с пищей. При недостатке незаменимых аминокислот задерживается рост и развитие организма. Оптимальное содержание незаменимых аминокислот в пищевом белке зависит от возраста, пола и профессии человека, а также от других причин. Заменимые аминокислоты синтезируются в организме человека.
Аминокислоты представляют собой структурные химические единицы, образующие белки.
Любой живой организм состоит из белков. Разнообразные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками.
В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками.
Дефицит белков в организме может привести к нарушению водного баланса, что вызывает отеки. Каждый белок в организме уникален и существует для специальных целей. Белки не являются взаимозаменяемыми. Они синтезируются в организме из аминокислот, которые образуются в результате расщепления белков, находящихся в пищевых продуктах. Таким образом, именно аминокислоты, а не сами белки являются наиболее ценными элементами питания.
Какие еще функции выполняют аминокислоты?
Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма так некоторые из них:
- Выполняют роль нейромедиаторов или являются их предшественниками. Нейромедиаторы — это химические вещества, передающие нервный импульс с одной нервной клетки на другую.
 Таким образом, некоторые аминокислоты необходимы для нормальной работы головного мозга.
Таким образом, некоторые аминокислоты необходимы для нормальной работы головного мозга.
- Аминокислоты способствуют тому, что витамины и минералы адекватно выполняют свои функции.
- Некоторые аминокислоты непосредственно снабжают энергией мышечную ткань.
Что будет, если аминокислот не хватает?
В организме человека многие из аминокислот синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей. К таким незаменимым аминокислотам относятся:
- гистидин,
- изолейцин,
- лейцин,
- лизин,
- метионин,
- фенилаланин,
- треонин,
- триптофан,
- валин.
Аминокислоты, которые синтезируются в печени, включают:
- аланин,
- аргинин,
- аспарагин,
- аспарагиновую кислоту,
- цитруллин,
- цистеин,
- гамма-аминомасляную кислоту,
- глютамовую кислоту,
- глютамин,
- глицин,
- орнитин,
- пролин,
- серин,
- таурин,
- тирозин.

Процесс синтеза белков постоянно идет в организме. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным нарушениям — от расстройств пищеварения до депрессии и замедления роста.
Многие факторы приводят к этому, даже, если ваше питание сбалансировано, и вы потребляете достаточное количество белка. Нарушение всасывания в желудочно-кишечном тракте, инфекция, травма, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме — все это может привести к дефициту незаменимых аминокислот.
Какие аминокислоты следует принимать?
В настоящее время можно получать незаменимые и заменимые аминокислоты в виде биологически активных пищевых добавок. Это особенно важно при различных заболеваниях и при применении редукционных диет. Вегетарианцам необходимы такие добавки, содержащие незаменимые аминокислоты, чтобы организм получал все необходимое для нормального синтеза белков.
При выборе добавки, содержащей аминокислоты, предпочтение следует отдавать продуктам, содержащим L-кристаллические аминокислоты. Большинство аминокислот существует в виде двух форм, химическая структура одной является зеркальным отображением другой. Они называются D- и L-формами, например D-цистин и L-цистин. D означает dextra (правая на латыни), a L — levo (соответственно, левая). Эти термины обозначают пространственное строение данной молекулы. Белки животных и растительных организмов созданы L-формами аминокислот (за исключением фенилаланина, который представлен D,L- формами). Таким образом, только L-аминокислоты являются биологически активными участниками метаболизма.
Свободные, или несвязанные, аминокислоты представляют собой наиболее чистую форму. Они не нуждаются в переваривании и абсорбируются непосредственно в кровоток. После приема внутрь всасываются очень быстро и, как правило, не вызывают аллергических реакций.
Войдите на сайт, чтобы оставлять комментарии
Классификация аминокислот | Химия онлайн
Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серусодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серусодержащие: метионин
— иминокислота: пролин.
2. Полярные незаряженные
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
3. Заряженные отрицательно при рН-7 (кислые)
Заряженные отрицательно при рН-7 (кислые)
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.
В ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:
VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека.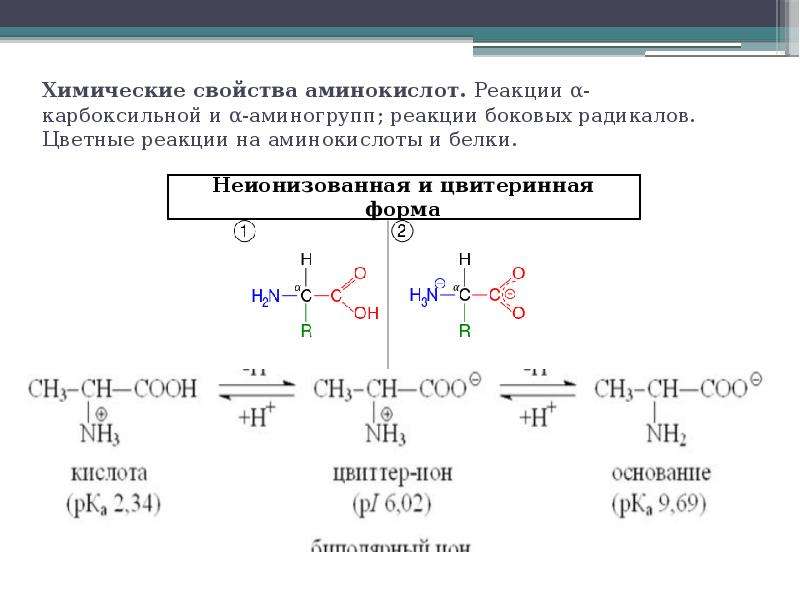 К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.
Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Качество некоторых пищевых белков относительно белков женского молока
Аминокислоты
Аминовен инструкция по применению: показания, противопоказания, побочное действие – описание Aminoven р-р д/инф. 15%: фл. 500 мл 10 шт. с держателями пластиковыми или без них (12829)
Внутривенно. Выбор центральной или периферической вены для введения Аминовена 5% и 10% зависит от конечной осмолярности при совместном введении с другими растворами. Аминовен 15% следует вводить только в центральные вены. Инфузию можно продолжать столько времени, сколько этого требует клиническое состояние больного, исходя из суточной потребности в аминокислотах.
Аминовен 5%
Взрослые:
Средняя суточная доза: 16-20 мл Аминовена 5% на кг массы тела (эквивалентно 0.8-1.0 г аминокислот на кг массы тела), что соответствует 1120-1400 мл Аминовена 5% для больного с массой тела 70 кг .
Максимальная суточная доза: 20 мл Аминовена 5% на кг массы тела (эквивалентно 1.0 г аминокислот на кг массы тела), что соответствует 1400 мл Аминовена 5% для больного с массой тела 70 кг.
Максимальная скорость инфузии: 2.0 мл Аминовена 5% на кг массы тела в час (эквивалентно 0.1 г аминокислот на кг массы тела/ч).
Дети:
Максимальная суточная доза для детей от 2 лет -16-20 мл Аминовена 5% на кг массы тела (эквивалентно 0.8-10 г аминокислот на кг массы тела).
Максимальная скорость введения для детей от 2 лет не отличается от максимальной скорости для взрослых.
Аминовен 10%
Взрослые:
Средняя суточная доза: 10-20 мл Аминовена 10% на кг массы тела (эквивалентно 1. 0-2.0 г аминокислот на кг массы тела), что соответствует 700 -1400 мл Аминовена 10% для больного с массой тела 70 кг .
0-2.0 г аминокислот на кг массы тела), что соответствует 700 -1400 мл Аминовена 10% для больного с массой тела 70 кг .
Максимальная суточная доза: 20 мл Аминовена 10% на кг массы тела (эквивалентно 2.0 г аминокислот на кг массы тела), что соответствует 1400 мл Аминовена 5% для больного с массой тела 70 кг.
Максимальная скорость инфузии: 1.0 мл Аминовена 10% на кг массы тела/ч (эквивалентно 0.1 г аминокислот на кг массы тела/ч).
Дети:
Максимальная суточная доза для детей от 2 лет – 10-20 мл Аминовена 10% на кг массы тела (эквивалентно 1.0-2.0 г аминокислот на кг массы тела).
Максимальная скорость введения для детей от 2 лет не отличается от максимальной скорости для взрослых.
Аминовен 15%
Взрослые:
Средняя суточная доза: 6.7-13.3 мл Аминовена 15% на кг массы тела (эквивалентно 1.0-2.0 г аминокислот на кг массы тела), что соответствует 470-930 мл Аминовена 5% для больного с массой тела 70 кг.
Максимальная суточная доза: 13. 3 мл Аминовена 15% на кг массы тела (эквивалентно 2.0 г аминокислот на кг массы тела), что соответствует 930 мл Аминовена 15% для больного с массой тела 70 кг.
3 мл Аминовена 15% на кг массы тела (эквивалентно 2.0 г аминокислот на кг массы тела), что соответствует 930 мл Аминовена 15% для больного с массой тела 70 кг.
Максимальная скорость инфузии: 0.67 мл Аминовена 15% на кг массы тела в час (эквивалентно 0.1 г аминокислот на кг массы тела/ч).
Дети:
Не рекомендуется использовать Аминовен 15% у детей (до 18 лет).
характеристики, функции, использование в спорте
Многие физиологические процессы, протекающие в организме человека, не могут осуществляться без наличия аминокислот. Это расщепленные белки, которые всасываются в кровь. Организм человека нуждается во всех видах аминокислот.
Аминокислоты могут быть заменимыми (их синтез происходит в организме человека) и незаменимыми (мы получаем их вместе с едой). Обычным людям нет необходимости следить за присутствием тех или иных аминокислот в организме, но атлеты и спортсмены должны это делать, т.к. потребность в различных видах расщепленных белков существенно возрастает.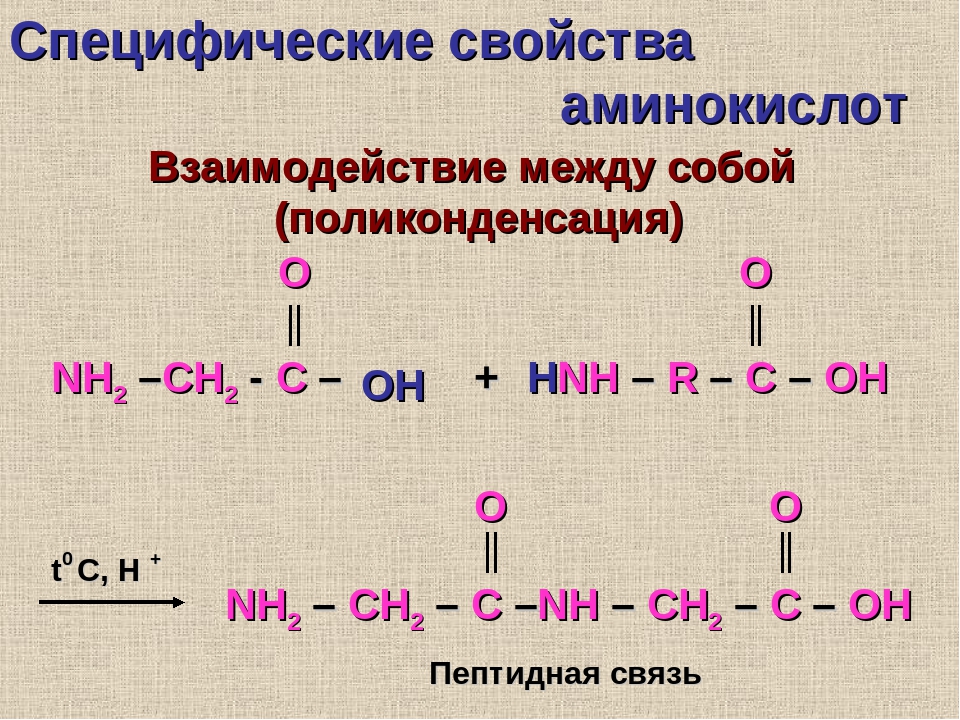 Поэтому они должны приниматься в виде спортивного питания.
Поэтому они должны приниматься в виде спортивного питания.
Одной из наиболее важных аминокислот является орнитин, который выполняет множество функций.
Общая информация
Орнитин относится к группе заменимых аминокислот – такие вещества имеются в организме человека, где и происходит их синтез. В больших количествах он присутствует в соединительной ткани. Орнитин может преобразовываться в аргинин. Несмотря на присутствие данной аминокислоты в организме человека, всем тем, кто занимается бодибилдингом или фитнесом, требуется дополнительный прием этого вещества.
Функции орнитина
К основным свойствам орнитина можно отнести:
- Стимуляция выработки соматотропина (гормона роста). Синтез соматотропина происходит в гипофизе (принято считать, что во время сна). Интенсивные нагрузки помогают его выработке. За счет продукции соматотропина наблюдается увеличение мышечной ткани и сжигание жира. Орнитин аналогичен по действию с аргинином, поэтому рекомендован его прием перед сном.

- Проявление гепатопротектроных свойств. Орнитин обеспечивает защиту печени от негативного воздействия всевозможных токсинов, содержащихся в медикаментозных препаратах и пище. Аминокислота помогает в процессах восстановления печеночных клеток, что крайне важно для всех людей, страдающих от разных патологий печени. Исследования показывают, что постоянное употребление орнитина позволяет существенно улучшить движение крови по сосудам печени.
- Стимуляция синтеза инсулина. Важным свойством орнитина является возможность его использования в бодибилдинге за счет стимулирования синтеза инсулина, являющегося мощным анаболическим гормоном (важнейший гормон, если проводятся тренировки на массу).
- Участие в процессах мочеобразования. Орнитин участвуют в процессах образования и выведения мочи, способствуя тем самым выведению токсинов (в частности аммиака, токсичного вещества, образуемого в процессе белкового распада). Происходит это благодаря орнитиновому циклу, во время которого наблюдается преобразование аммиака в печени в мочевину и ее дальнейший вывод из организма почками.

- Участие в процессах расщепления жирных кислот. Орнитин способен расщеплять жирные кислоты, что позволяет получать дополнительную энергию (крайне важно для тех, кто «сушится» или худеет). Также орнитин, как уже было отмечено ранее, улучшает выработку соматотропина, который сам по себе хорошо сжигает жир даже в ночные часы.
Орнитин также обладает массой положительных характеристик, за счет которых данная аминокислота часто применяется в терапии иммунной системы:
- Укрепление сухожилий и связок.
- Ускорение процессов заживления соединительной ткани (при порезах, ранах).
- Улучшение работы иммунной системы за счет усиления синтеза глютамина.
- Нормализация кислотно-щелочного баланса.
Дозы и использование
Орнитин – крайне актуальная добавка в сфере современного фитнеса и бодибилдинга. Он применяется для следующих целей:
- Расщепление жирных кислот (во время «сушки).
- Ускорение окисления.
- Увеличение мышечной массы.

- Поддержка нормальной работы иммунной системы.
Рекомендованная ежедневная доза для спортсменов варьируется от 500 до 2000 мг (в зависимости от ряда факторов). Необходимо принимать орнитин на голодный желудок и перед отходом ко сну.
Зачастую, чтобы достигнуть большего эффекта, происходит комбинированный прием орнитина и аргинина. На современном рынке можно найти множество продуктов, в составе которых присутствуют орнитин и аргинин одновременно в разных соотношениях. Яркими примерами таких препаратов являются:
- Dynamic Development Night Amino. Оптимальный вариант для применения перед сном. Содержит лизин, орнитин, аргинин, витамин В6. Концентрация всех веществ максимальная.
- Maxler Arginine/Ornithine/Lysine. Лизин, орнитин и аргинин в этом продукте представлены в соотношении 1:1:1.
- Twinlab L-Arginine L-Ornithine. Орнитин и аргинин в соотношении 1:2.
- NOW: L-Ornithine 500 mg. В продукте орнитин содержится в чистом виде без добавок.

Орнитин не рекомендовано принимать беременным женщинам (возникают спазмы кишечника, тошнота). Иных противопоказаний аминокислота не имеет.
Общая характеристика. – Аминокислоты – Азотосодержащие органические соединения – Органическая химия
11 января 2007
Многие биологически активные молекулы включают в себя химически различные функциональные группы, способные к взаимодействию между собой или функциональными группами других молекул. Один из примеров – моносахариды, в состав которых входят несколько гидроксильных групп и одна карбонильная группа. Другой важный пример бифункциональных соединений – аминокислоты.
Аминокислоты – это органические бифункциональные соединения, в состав которых входят карбоксильная группа -СООН и аминогруппа -NН 2 . В зависимости от взаимного расположения функциональных групп различают α-, β-, γ-аминокислоты:
β α β α
α-аминопропионовая β-парапропионовая
кислота кислота
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Здесь будут рассматриваться только α-аминокислоты, поскольку другие аминокислоты в природе не встречаются.
Здесь будут рассматриваться только α-аминокислоты, поскольку другие аминокислоты в природе не встречаются.
В состав компонентов входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные названия.
Иминокислота пролин (молекулярная формула C 5 H 9 NO 2 ) имеет структуру
Простейшая аминокислота – глицин (аминоуксусная кислота). Остальные природные аминокислоты можно разделить на следующие основные группы:
α-Аминокислоты общей формулы
| Аминокислота | Обозначение (трёх- и одно- буквенное) | – р. | Молеку-лярная формула |
| Глицин | Гли (G) | -H | C 2 H 5 НЕТ 2 |
Аланин | Ала (А) | -CH 3 | C 3 H 7 НЕТ 2 |
Валил | Вал (В) | -КАНАЛ (КАНАЛ 3 ) 2 | C 5 H 11 НЕТ 2 |
Лейцин | Лей (L) | -КАНАЛ 2 -КАНАЛ (Канал 3 ) 2 | C 6 H 13 НЕТ 2 |
Изолейцин | Иль (И) | -CH 2 -CH (CH 3 ) -C 2 H 5 | C 7 H 15 НЕТ 2 |
Цистеин | Cys (C) | -CH 2 -SH | C 3 H 7 SNO 2 |
Метионин | Мет (М) | -КАНАЛ 2 -КАНАЛ 2 -С-КАНАЛ 3 | C 5 H 11 SNO 2 |
Серин | Ser (S) | -CH 2 -OH | C 3 H 7 НЕТ 3 |
Треонин | Thr (т) | -CH (OH) -CH 3 | C 4 H 9 НЕТ 3 |
Фенилаланин | Phe (F) | -CH 2 -C 6 H 5 | C 9 H 11 НЕТ 2 |
Тирозин | тир (г) | C 9 H 11 НЕТ 3 | |
Триптофан | Trp (Вт) | C 11 H 12 N 2 O 2 | |
Аспарагиновая кислота | Асп (D) | –CH 2 COOH | C 4 H 7 НЕТ 4 |
Глутаминовая кислота | Glu (E) | -CH 2 -CH 2 -COOH | C 5 H 9 НЕТ 4 |
Аспарагин | Asn (N) | -CH 2 -CO-NH 2 | C 4 H 8 N 2 O 3 |
Глутамин | Gln (Q) | -CH 2 -CH 2 -CO-NH 2 | C 5 H 10 N 2 O 3 |
Гистидин | Гис (H) | C 6 H 9 N 3 O 2 | |
Лизин | Лис (К) | – (CH 2 ) 4 -NH 2 | C 6 H 14 N 2 O 2 |
Аргинин | Арг (П) | C 6 H 14 N 4 O 2 |
1) гомологи глицина – аланин, валин, лейцин, изолейцин;
2) серосодержащие аминокислоты – цистеин, метионин;
3) аминокислоты с алифатической гидроксильной группой – серин, треонин;
4) ароматические аминокислоты – фенилаланин, тирозин, триптофан;
5) аминокислоты с кислотным радикалом – аспарагиновая и глутаминовая кислоты;
6) аминокислоты с амидной группой – аспарагин, глутамин;
7) аминокислоты с основным радикалом – гистидин, лизин, аргинин.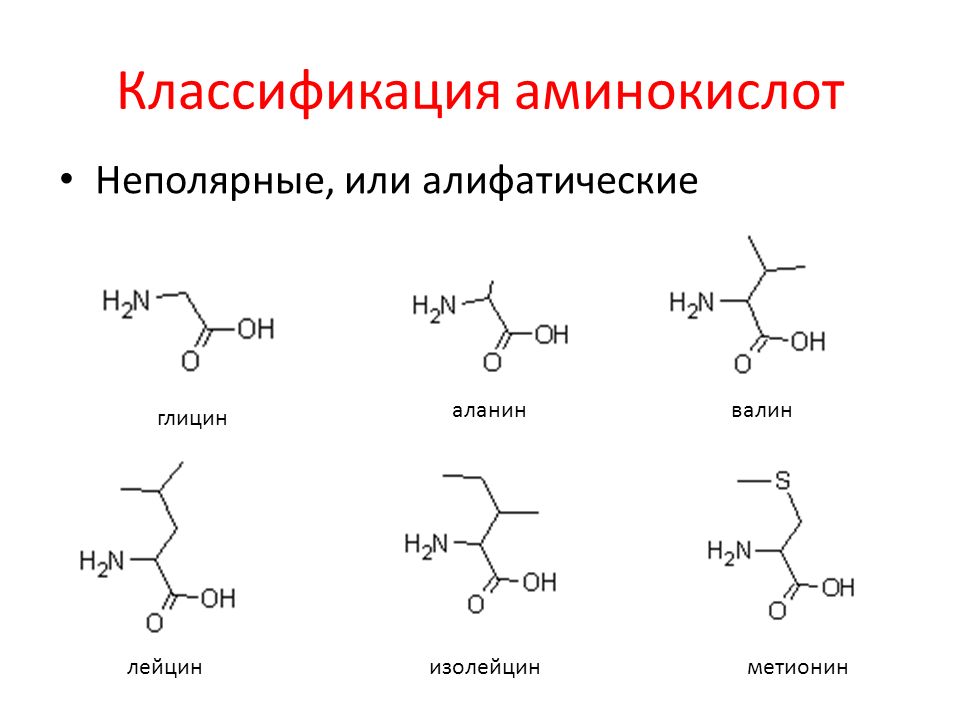
Рынок кормовых аминокислот в России в 2017 г .: лизин, метионин, треонин
Актуальность: декабрь 2017 г.
Аналитический материал подготовлен на основе ежемесячного отчета по импорту кормов и кормовых продуктов в Россию, а также исследования по российскому рынку кормов и добавок. В статье представлен обзор импорта кормового лизина, кормового метионина и кормового треонина в Россию в 2016 – 2017 гг.
Рынок кормовых аминокислот в России в 2017 г .: лизин, метионин, треонин
Производство кормовых аминокислот одно из источников, в которых действует курс импортозамещения. Основными аминокислотами выступают лизин, метионин и треонин. Внутри страны долгое время аминокислоты являлся АО «Волжский оргсинтез», производящий метионин. По ID оценке-Marketing, в 2016 году компания выпустила 29,3 тыс. Руб.тонн метионина, что на 5% выше уровня 2015 года. При этом импорт кормового метионина в 2016 году составил 19,6 тыс. Руб. тонн, увеличившись до 32,7 тыс. тонн в 2017 году. Повлиявшим на рост импорта кормового метионина в 2017 году Основным фактором увеличения объема ввоза представителем Evonik в России продукции с завода Evonik Degussa Antwerpen NV почти в два раза по сравнению с 2016 годом. Всего же на долю кормового метионина производства заводов Evonik почти 74% поставок в 2017 году.Также стоит отметить рост объема внедрения кормового метионина производства Adisseo по с 2016 годом в 2017 на 54%. Доля Adisseo в импорте кормового метионина в 2017 году составила, по оценкам ID-Marketing, 17,5%.
Руб. тонн, увеличившись до 32,7 тыс. тонн в 2017 году. Повлиявшим на рост импорта кормового метионина в 2017 году Основным фактором увеличения объема ввоза представителем Evonik в России продукции с завода Evonik Degussa Antwerpen NV почти в два раза по сравнению с 2016 годом. Всего же на долю кормового метионина производства заводов Evonik почти 74% поставок в 2017 году.Также стоит отметить рост объема внедрения кормового метионина производства Adisseo по с 2016 годом в 2017 на 54%. Доля Adisseo в импорте кормового метионина в 2017 году составила, по оценкам ID-Marketing, 17,5%.
В сегменте кормового лизина, спрос на который наиболее велик, в России одним из первых запущена линия по производству L-лизин сульфат 65% мощностью 57 тыс. Руб. тонн на ЗАО «Завод Премиксов № 1» (ГК «Приосколье») в Белгородской области. В мае 2015 года заводом была произведена первая партия, а в начале 2017 года завод вышел на постоянные объемы.Еще одним успешно реализованным проектом является запуск в Тюменской области 1 декабря 2017 года цеха по производству сульфата лизина компании «АминоСиб» (Агрохолдинг «Юбилейный»). Запуск производства лизина является третьим и заключительным этапом в реализации проекта по глубокой переработке зерна. Мощность по производству лизина в Тюменской области составляет 30 тысяч тонн в год. Несмотря на наличие других проектов по глубокой переработке зерна, в том числе «Донбиотех» и Evonik (Ростовская область), АО «Биотех Росва» (Калужская область), пока полностью реализованы только два.
Запуск производства лизина является третьим и заключительным этапом в реализации проекта по глубокой переработке зерна. Мощность по производству лизина в Тюменской области составляет 30 тысяч тонн в год. Несмотря на наличие других проектов по глубокой переработке зерна, в том числе «Донбиотех» и Evonik (Ростовская область), АО «Биотех Росва» (Калужская область), пока полностью реализованы только два.
Импорт кормового лизина в Россию, по оценкам ID-Marketing, в 2016 году составил 90,6 тыс. Руб. тонн, в 2017 снизился на 8,7% до 82,7 тыс. тонн. Если рассматривать ретроспективный период, то стоит отметить, что в 2016 году лизина в достигли максимума и двукратного роста 2011 года. В структуре ввоза лизина в 2017 году 78% пришлось на импорт моногидрохлорида, остальной объем занял лизин сульфат. При этом импорте лизина в страну в 2017 году был введен запрет на поставку лизина Россельхознадзором ряда китайских компаний, в том числе заводов компании EPPEN: Внутренняя Монголия EPPEN Biotech Co.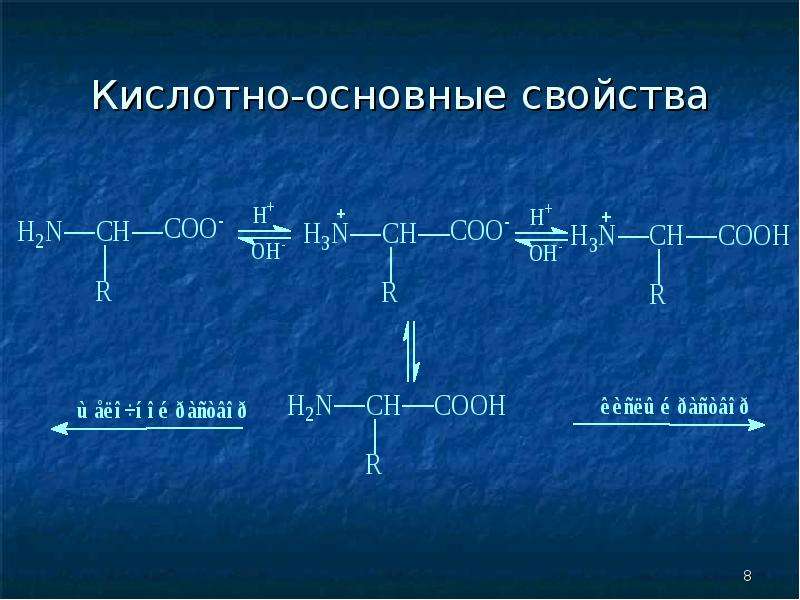 , ООО и Ningxia EPPEN Biotech Co, Ltd, занимающая первое место по объемам поставок в РФ.
, ООО и Ningxia EPPEN Biotech Co, Ltd, занимающая первое место по объемам поставок в РФ.
Доли заводов производителей в импорте кормового лизина в Россию в 2017 году,% (натур. Выраж.)
Импорт треонина в Россию также растет из года в год. По оценкам ID-Marketing, в 2017 году ввоз составил 28,4 тыс. Руб. тонн, увеличившись на 12,5% по сравнению с 2016 годом. Всего с 2011 года, по данным ID-Marketing, импорт кормового треонина вырос в 2,7 раза.По объемам поставок первое место занимает продукция завода Hulunbeier Northeast Fufeng Biotechnologies Co., Ltd., на долю которого в 2017 году пришлось 57,5% поставок в натуральном выражении. Внутреннее производство треонина в России отсутствует. Однако о проекте по выпуску треонина мощностью 18 тыс. Руб. тонн заявило ЗАО «Завод премиксов №1», реализовать который планируется к 2020 году. При этом крупный производитель аминокислот на мировом рынке Evonik объявил о закрытии завода в венгерском городе Каба, причиной закрытия озвучив растущую конкуренцию на рынке треонина, по мнению компании.
В целом, по оценкам ID-Marketing, объем импорта в 2017 году кормовых аминокислот составил 148,5 тыс. Руб. тонн, из которого 97% пришлось на кормовой лизин, метионин и треонин.
Примечание: анализ проводится без учета оборота со стран Таможенного Союза.
В начало
Аминокислоты для оптимального синтеза кишечного тракта (слизи) и защиты кишечника в здоровом и патологическом состоянии
Департамент питания и здравоохранения Лозанна, Швейцария
Электронная почта: [email protected]
Список сокращений
ASR : Cкорость абсолютного синтеза (Absolute Synthesis Rate)
ВЗК: Воспалительные заболевания кишечника
FSR : Скорость фракционного синтеза (Fractional Synthesis Rate)
MUC2 9: муцин-2 9: муцин-2 Muc2 : муцин-2 протеин
Обзор
Требования к количеству и качественному аминокислотному составу для здоровых животных. В патологических ситуациях, воспалительных заболеваниях организма, воспалительных заболеваниях кишечника, участвуют анаболические реакции, вовлекающие внутренние органы и кишечник. Процессы защиты и восстановления кишечника резко увеличивают скорость синтеза, участвующих в барьерных функциях кишечника, как муцины. Увеличивает потребность в специфических аминокислотах, в частности тех которые в муцинах. Питание для здоровых животных в этой ситуации не подходит. Увеличение содержания треонина, серина, пролина и цистеина в питании необходимо для того, чтобы повысить синтез муцина и усилить неспецифическую кишечную барьерную функцию.
В патологических ситуациях, воспалительных заболеваниях организма, воспалительных заболеваниях кишечника, участвуют анаболические реакции, вовлекающие внутренние органы и кишечник. Процессы защиты и восстановления кишечника резко увеличивают скорость синтеза, участвующих в барьерных функциях кишечника, как муцины. Увеличивает потребность в специфических аминокислотах, в частности тех которые в муцинах. Питание для здоровых животных в этой ситуации не подходит. Увеличение содержания треонина, серина, пролина и цистеина в питании необходимо для того, чтобы повысить синтез муцина и усилить неспецифическую кишечную барьерную функцию.
Введение
Желудочно-кишечный тракт является одним из наиболее активных в метаболическом отношении органов организма, что отражает его многочисленные важнейшие биологические функции. В то время как желудочно-кишечный тракт составляет от 3% до 6% массы тела млекопитающих, на его долю приходится более 20% белка всего тела. Это происходит главным образом из-за высокой скорости синтеза и непрерывной высокой секреторной активности. Таким образом, повышается потребность в аминокислотах, необходимых для синтеза белка.Такое высокое требование было приписано неспецифического кишечного барьера, в частности синдрома кишечных муцинов. Воспаление повышения эффективности белка в кишечнике и, как следствие, потребление аминокислот. В этом контексте для поддержания или восстановления целостности и функций кишечного барьера требуется адекватный контроль питания.
Таким образом, повышается потребность в аминокислотах, необходимых для синтеза белка.Такое высокое требование было приписано неспецифического кишечного барьера, в частности синдрома кишечных муцинов. Воспаление повышения эффективности белка в кишечнике и, как следствие, потребление аминокислот. В этом контексте для поддержания или восстановления целостности и функций кишечного барьера требуется адекватный контроль питания.
Неиммунный кишечный барьер
Защита кишечника обеспечивается таковым и физическим, неиммунным кишечным барьером.Кишечный барьер обеспечивает защиту от внешней среды (кишечных патогенов, вредных агентов и др.) Пока происходит адекватная абсорбция питательных веществ для снабжения ими всего организма. Нормальная функция барьера базируется на близком взаимодействии нескольких компонентов. Ключевыми компонентами являются: равновесие комменсальной кишечной микробиоты, которая противодействует адгезии других патогенных бактерий; слой кишечной слизи, который покрывает и защищает эпителиальные клетки; сам кишечный эпителий, обеспечивающий раздел между внутрипросветным содержимым и нижележащими тканями; клетки Панэта, продуцирующие антимикробные пептиды; плотные контакты между эпителиальными клетками, способствующие модуляции парацеллюлярных путей; и кишечная нервная система, недавно признанная регулятором целостности эпителиального барьера.
Сложные регуляторные механизмы обеспечивают тонкое равновесие между различными компонентами неиммунного кишечного барьера. Оптимальная диетическая поддержка имеет решающее значение для кишечного тракта, способствуя поддержанию здоровья всего организма и предотвращающим заболеваниям, связанным с желудочно-кишечным трактом.
Состав и роль кишечной слизи
Желудочно-кишечный эпителий покрыт вязкоупругим гелеобразным слоем слизи, состоящий из: сложной смеси гликопротеинов, называемых муцинами; пептидов, включая трефойловый пептид (фактор “трилистника”) и антимикробные пептиды; воды; макромолекул, таких как секреторный иммуноглобулин А; электролитов; микроорганизмов; и отшелушенных клеток.Гелеобразная слизь представляет собой первую линию врожденной защиты хозяина; одной из его основных функций защита эпителиальных поверхностей от механических нагрузок и воздействия пищеварительных соков, микроорганизмов и токсинов. Ее защитный эффект связан напрямую с его толщиной и составом. Уникальная защитная способность гелеобразной слизи обусловлена, в частности, высокой концентрации гликопротеинов, которые непрерывно синтезируются и секретируются бокаловидными клетками кишечника и эпителиальными клетками слизистой оболочки по всему желудочно-кишечному тракту.
Уникальная защитная способность гелеобразной слизи обусловлена, в частности, высокой концентрации гликопротеинов, которые непрерывно синтезируются и секретируются бокаловидными клетками кишечника и эпителиальными клетками слизистой оболочки по всему желудочно-кишечному тракту.
Толщина слоя слизи, ее защитное действие, изменяются в желудочно-кишечном тракте по всей его длине в различных формах различных муцинов и динамического баланса между анаболическими (экспрессия, синтез и секреция из бокаловидных клеток) и катаболическими (физическая и протеолитическая деградация) процессами. В желудке и толстой кишке определен самый толстый слой слизи, необходимый для того, чтобы обеспечить хорошую защиту от кислого субстрата (желудок) и микробиоты (толстая кишка).В тонком кишечнике – напротив, он самый тонкий, вероятно, препятствовать усвоению питательных веществ.
Внутренний, прочно прикрепленный слой слизи, состоящий из мембраносвязанных муцинов, прилипает к апикальной стороне эпителиальных клеток и образование гликокаликса, полисахаридного матрикса, покрывающего поверхность эпителиальных клеток.
Растворимый, слабо прикрепленный наружный слой слизи, состоящий из секретируемых гелеобразующих муцинов, покрывает внутреннюю оболочку слизи.Этот растворимый слой обеспечивает создание и поддержание баланса микробиоты, которая противостоит положению патогенным бактериям.
Характеристика кишечных муцинов
На сегодняшний день идентифицирован 21 ген муцина, из которых 15 экспрессируются в желудочно-кишечном тракте человека. Муцины кишечника имеют особенности строения. Это обычно крупные полипептиды (10% -20% от общей массы муцина), которые очень сильно гликозилированы (до 80% -90% от массы муцина).Олигосахаридные боковые цепи в основном состоят из N-ацетилгалактозамина, N-ацетилглюкозамина, галактозы и фукозы, связанных преимущественно с сериновыми и треониновыми остатками муцинового полипептидного ядра через O-гликозидные связи. Посттрансляционные модификации, включая сиалирование и сульфатирование, завершают макромолекулу.
Размер полипептида муцина обычно колеблется от 200 КДА до 900 КДА, за исключением слюнной формы MUC7 (39 КДА). По сравнению с другими белками млекопитающих обогащение аминокислотами треонином, серином и пролином, которые составляют 28%, 14% и 13% соответственно от общего состава муцинов.Для сравнения, среднее содержание треонина в белках организма колеблется от 3% до 7% от общего количества аминокислот. Остатки треонина, серина и пролина концентрируются в центральных тандемных повторах PTS (пролин, треонин, серин), состоящих из консервативных последовательностей, повторенных примерно 100 раз. Насыщенные цистеином домены также присутствуют на полипептидах муцина. Они позволяют муцинам собираться в гомо-олигомеры через межмолекулярные дисульфидные связи, образованные между богатыми цистеином доменами, которые придают вязкоупругое защитное свойство гелеобразной слизи.
По сравнению с другими белками млекопитающих обогащение аминокислотами треонином, серином и пролином, которые составляют 28%, 14% и 13% соответственно от общего состава муцинов.Для сравнения, среднее содержание треонина в белках организма колеблется от 3% до 7% от общего количества аминокислот. Остатки треонина, серина и пролина концентрируются в центральных тандемных повторах PTS (пролин, треонин, серин), состоящих из консервативных последовательностей, повторенных примерно 100 раз. Насыщенные цистеином домены также присутствуют на полипептидах муцина. Они позволяют муцинам собираться в гомо-олигомеры через межмолекулярные дисульфидные связи, образованные между богатыми цистеином доменами, которые придают вязкоупругое защитное свойство гелеобразной слизи.
Среди 15 муцинов, экспрессируемых в желудочно-кишечном тракте человека, MUC2, MUC5AC, MUC5B, MUC6, MUC7 и MUC19 секретируются в основном специализированными бокаловидными клетками. В тонком и толстом кишечнике MUC2 является преобладающим гелеобразующим муцином. Его важная роль в защите эпителия кишки от колита была установлена на модели мышей с дефицитом Muc2. MUC1, MUC3A, MUC3B, MUC4, MUC12, MUC13, MUC15, MUC16 и MUC17 являются мембраносвязанными муцинами, экспрессируемыми клетками эпителия слизистой оболочки желудочно-кишечного тракта человека.
Его важная роль в защите эпителия кишки от колита была установлена на модели мышей с дефицитом Muc2. MUC1, MUC3A, MUC3B, MUC4, MUC12, MUC13, MUC15, MUC16 и MUC17 являются мембраносвязанными муцинами, экспрессируемыми клетками эпителия слизистой оболочки желудочно-кишечного тракта человека.
В тонком и толстом кишечнике MUC3, MUC4, MUC13 и MUC17 являются преобладающими мембраносвязанными формами. Они простираются над поверхностью клетки и образуют гликокаликс. Предполагается, что мембранные муцины занимают особое место в антиадгезивных и сигнальных механизмах, восстановлении клеток кишечника и защите эпителиальных клеток от инфекции.
Для обеспечения адекватной экспрессии и секреции муцина, необходимого для оптимальной защиты кишечника применяются сложные регуляторные механизмы.Было обнаружено, что эти механизмы включают нейронные, гормональные и паракринные пути. Статус питания, который позволяет обеспечить необходимое количество аминокислот, необходимых для синтеза муцина и микробиоты, также является регулятором кишечника.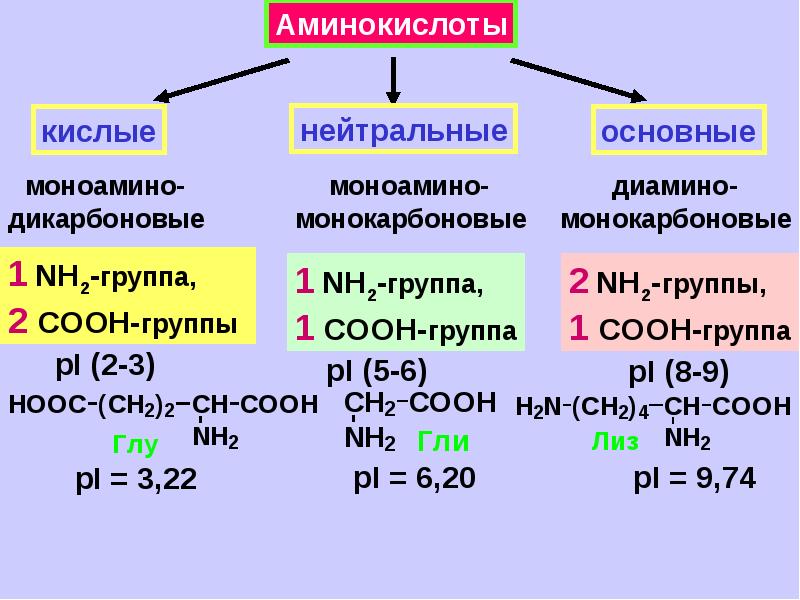
Нарушения обмена веществ при заболеваниях кишечника ослабляют выработку муцина и защиту кишечника
Многие кишечные заболевания, предполагающие хроническое воспаление, такие как воспалительные заболевания кишечника (ВЗК), связаны с дисфункцией кишечного барьера.Два основных типа ВЗК – язвенный колит и болезнь Крона, сопровождающиеся повышением проницаемости тонкой и толстой кишки. Среди изменений, наблюдаемых на уровне кишечного барьера, были внесены изменения в состав микробиоты кишечника и качественное и количественное изменение слизистого слоя и продукции муцина. В частности, синтез зрелой, гликозилированной формы MUC2, первичного муцина, секретируемого в толстой кишке, снижается у больных язвенным колитом, что ухудшает слизистый барьер.
Сообщалось также об аномальном выделении секретируемых в ЖКТ муцинов в подвздошной и ободочной кишках, что может отражать адаптивный ответ на усиление защитной реакции.Было отмечено ухудшение защиты эпителия выделением мембранных муцинов MUC3, MUC4 и MUC17.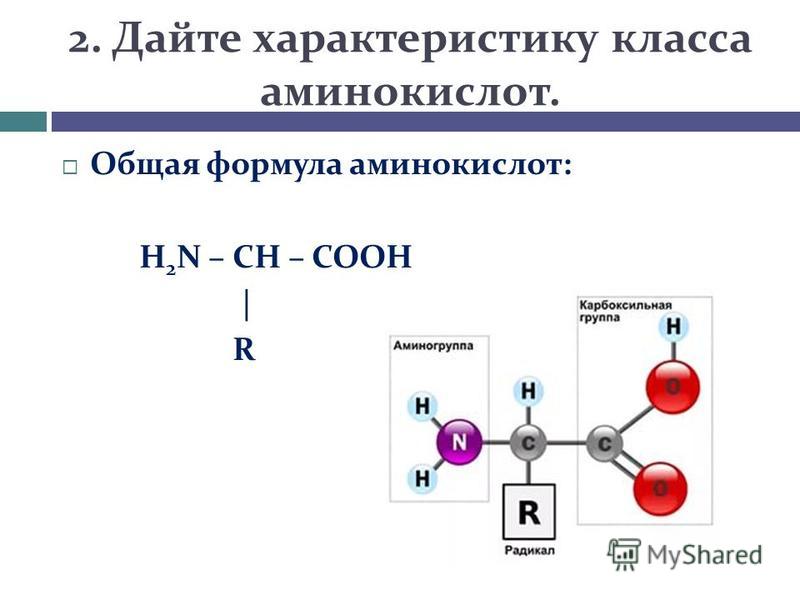 , И это интересно, экспрессия MUC13, выделяемого для ингибирования индуцированного токсинами апоптоза клеток эпителия толстой кишки, как было показано, увеличивает биоптаты воспаленной оболочки толстой кишки, отражающий защитный механизм, который, не менее, остается недостаточным для поддержания или восстановления функций. кишечного барьера.
, И это интересно, экспрессия MUC13, выделяемого для ингибирования индуцированного токсинами апоптоза клеток эпителия толстой кишки, как было показано, увеличивает биоптаты воспаленной оболочки толстой кишки, отражающий защитный механизм, который, не менее, остается недостаточным для поддержания или восстановления функций. кишечного барьера.
Метаболические нарушения, связанные с острыми системными воспалительными реакциями, наблюдаемыми, например, при сепсисе, также влияют на барьерную функцию кишечника.Острое воспаление стимулирует синтез белков острой фазы в печени и слизистых оболочках, а также муцинов в кишечнике. Эти анаболические реакции являются важными адаптациями, направленными на обеспечение организма от первичных и вторичных патологических воздействий. Таким образом, стимулирует стимуляцию синтеза белка. В этом контексте наблюдается сильное увеличение потребности в аминокислотах, особенно, присутствующих в муцинах в большом количестве.Потребление пищи, употребляемой в пищу, снижается, и запасы пищевых аминокислот слишком низко, чтобы удовлетворить потребности организма в пищевом потреблении. При этом организм использует аминокислоты, полученные путем катаболизма мышц.
При этом организм использует аминокислоты, полученные путем катаболизма мышц.
Требования к аминокислотам для оптимального синтеза муцина и защиты кишечника
Желудочно-кишечный тракт составляет от 3% до 6% массы тела млекопитающих, в то время как на его долю приходится более 20% всего оборота белка в организме. Это неиммунная барьерная функция кишечника, в частности быстрое обновление эпителиальных клеток и непрерывный синтез кишечных муцинов.Анококислотный состав синтезируемых и секретируемых степени степени влияет на аминокислотные потребности кишечника, которые должны быть обеспечены при помощи питания и эндогенным синтезом (при недостатке аминокислот).
В нормальных условиях
Треонин является незаменимой аминокислотой, что означает, что он не может быть синтезирован организмом и должен поэтому поступать с пищей. В нормальных условиях треонин является ключевой аминокислотой для поддержания здоровья кишечника.По сравнению с другими незаменимыми аминокислотами, большая доля пищевого треонина (до 60%) остается в здоровом кишечнике свиньи или человека. Как белок кишечных муцинов содержит большое количество белков кишечного тракта (до 30% от их аминокислотного состава), их непрерывный синтез обеспечивает высокую скорость использования треонина желудочно-кишечного тракта. Размышляя в том же направлении, недостаток Muc2 у подопытных мышей действительно индуцирует метаболическое инициирование неиспользованного треонина, что вызывает его избыточное управление, вызывающее отсутствие использования Muc2.
Как белок кишечных муцинов содержит большое количество белков кишечного тракта (до 30% от их аминокислотного состава), их непрерывный синтез обеспечивает высокую скорость использования треонина желудочно-кишечного тракта. Размышляя в том же направлении, недостаток Muc2 у подопытных мышей действительно индуцирует метаболическое инициирование неиспользованного треонина, что вызывает его избыточное управление, вызывающее отсутствие использования Muc2.
И наоборот, когда поступление треонина с пищей ниже потребности, треонин может стать лимитирующей аминокислотой для синтеза кишечных муцинов, как показано на крысах и свиньях и поросятах. Действительно, было определено, что скорость фракционного синтеза муцина, определяемая как% муцинов, синтезируемых в сутки, уменьшает наполовину в верхней части тонкого кишечника крыс, получавших диету, покрывающую только 30% потребности в потребности в треонине (Рис. 1). Тем не менее, такой дефицит не оказывает существенного ограничивающего влияния на синтез белка оболочки оболочки. 1), причем эти остальные белки содержат примерно в семь раз меньше треонина, чем Muc2. Муцины особенно к действию пищеварительных ферментов, рециркуляция треонина из муцинов, секретируемых в верхних отделах желудочно-кишечного тракта, очень низка, а его потеря очень высока по отношению к потребности в треонине всего организма. В здоровых условиях крайне важно, чтобы поступление треонина с пищей точно соответствовало потребностям в нем организма, поддерживая таким образом синтез муцина и защиту кишечника, способствуя общему здоровому состоянию организма и предотвращая заболевания, связанные с кишечником.
1), причем эти остальные белки содержат примерно в семь раз меньше треонина, чем Muc2. Муцины особенно к действию пищеварительных ферментов, рециркуляция треонина из муцинов, секретируемых в верхних отделах желудочно-кишечного тракта, очень низка, а его потеря очень высока по отношению к потребности в треонине всего организма. В здоровых условиях крайне важно, чтобы поступление треонина с пищей точно соответствовало потребностям в нем организма, поддерживая таким образом синтез муцина и защиту кишечника, способствуя общему здоровому состоянию организма и предотвращая заболевания, связанные с кишечником.
Схема 1. Скорость фракционного синтеза (FSR), выраженный в% / сутки, муцинов и общих тканей оболочки в верхнем тонком кишечнике (а) и толстом кишечнике (Б) крыс, получавших полусинтетические диеты, удовлетворяющие 30%, 60% или 100% их потребности в треонине для роста. Рационы были изонитрогенными (скорректированными с аланином) и вводились крысам в течение 14 дней. Все группы крыс дополнительные питание парно для усреднения потребления крысами из группы 30%.Синтез белка in vivo измеряли с использованием метода флудинг-доз после инъекции L- (1-13C) – валина. Значения-средние ± SEM, n = 8. Для составляющей кишечника (муцины или белки оболочки каждой).
Все группы крыс дополнительные питание парно для усреднения потребления крысами из группы 30%.Синтез белка in vivo измеряли с использованием метода флудинг-доз после инъекции L- (1-13C) – валина. Значения-средние ± SEM, n = 8. Для составляющей кишечника (муцины или белки оболочки каждой).
При воспалительных заболеваниях
Как показано на моделях животных и людях, воспалительные ситуации, такие как наблюдаемые при ВЗК (хроническое воспаление) и сепсис (острое воспаление), связаны с общей повышенной анаболической реакцией, происходящей в основном в кишечнике и печени, соответственно.Этот анаболический ответ увеличивает использование аминокислот, в частности, присутствующих в больших количествах в кишечных и печеночных протеинах. Поэтому потребности в треонине и других аминокислотах, таких как серин и цистеин, сильно повышаются. Доступность первично лимитирующих (треонин) и вторично лимитирующих (серин, цистеин) аминокислот для кишечных муцинов может оказаться слишком низко из-за недостаточного качества питания (недостаточный уровень этих аминокислот) и количества (плохой аппетит) потребления пищи. Например, через два дня после заражения было показано использование треонина для синтеза муцинов в кишечнике крыс на 70%, чем у крыса контрольной группы. В целом, абсолютное потребление белка, синтез белка, кишечника и белков плазмы (минус альбумин) увеличилось на 23%, что в 2,6 раза превышало пищевое потребление. Аналогичным образом, пролин, который хорошо представлен в составе кишечных муцинов (13% 3,48 по сравнению с 4% -7% в белках организма, кроме коллагена), также может служить вторичной лимитирующей аминокислотой для муфцина.
Например, через два дня после заражения было показано использование треонина для синтеза муцинов в кишечнике крыс на 70%, чем у крыса контрольной группы. В целом, абсолютное потребление белка, синтез белка, кишечника и белков плазмы (минус альбумин) увеличилось на 23%, что в 2,6 раза превышало пищевое потребление. Аналогичным образом, пролин, который хорошо представлен в составе кишечных муцинов (13% 3,48 по сравнению с 4% -7% в белках организма, кроме коллагена), также может служить вторичной лимитирующей аминокислотой для муфцина.
Таким образом, при воспалительных состояниях необходима адекватная и хорошо поддерживаемая нутритивная поддержка для стимуляции защитного ответа, механизмы регенерации и, следовательно, поддержание или восстановление барьерной функции кишечника. Определение “адекватного и хорошо сбалансированного питания” будет зависеть от метаболического состояния, связанного с болезнью, и определенно будет разниться с таковым для здорового состояния.
Как ранее наблюдалось в моделях животных с ВЗК, кишечная продукция муцина не усиливалась с помощью здорового, сбалансированного питания. Однако было показано увеличение объема треонина, серина, пролина и цистеина в рационе крыс на модели колита эффективно способствует синтезу муцина толстой кишки в зависимости от дозы, не оказывая при этом влияния на общие белки слизистой оболочки (Рис.2). аминокислота увеличивала присутствие Muc2-защитных бокаловидных клеток в поверхностном эпителии уязвимой области. Она также способствовала росту всех тестируемых популяций комменсальных бактерий, включая лактобацилл.
Однако было показано увеличение объема треонина, серина, пролина и цистеина в рационе крыс на модели колита эффективно способствует синтезу муцина толстой кишки в зависимости от дозы, не оказывая при этом влияния на общие белки слизистой оболочки (Рис.2). аминокислота увеличивала присутствие Muc2-защитных бокаловидных клеток в поверхностном эпителии уязвимой области. Она также способствовала росту всех тестируемых популяций комменсальных бактерий, включая лактобацилл.
Схема 2. Скорость абсолютного синтеза (ASR), выраженные в мг / сут, муцинов и оболочки слизистой оболочки в толстой кишке крыс, получавших декстран сульфат натрия (DSS). Крыс кормили в течение 28 дней изонитрогенными (скорректированными с аланином) полусинтетическими порошковыми диетами, обеспечивающими следующие уровни по с потребностями крыс: DSSM1; двукратное увеличение треонина, пролина, серина и цистеина; DSSM2; четырехкратное увеличение треонина и пролина; и трехкратное увеличение серина и цистеина. Значения-средние ± SEM (n = 8). Для составляющей кишечника (муцины или белки оболочки каждой) средства без общей буквы различаются, Р
Значения-средние ± SEM (n = 8). Для составляющей кишечника (муцины или белки оболочки каждой) средства без общей буквы различаются, Р
Вывод
Содержание аминокислот треонина, серина, пролина и цистеина относительно высоки в составе кишечных муцинов, отчасти объясняет их высокое потребление кишечника. А значит адаптированная диетическая поддержка с точным регулированием количества этих четырех аминокислот имеет решающее значение для поддержания барьерной функции кишечника.Патологические ситуации, воспаление кишечника, процессы защиты кишечника и восстановление тканей, еще больше увеличивают потребность организма в перечисленных выше аминокислотах. В таких случаях рекомендуется усилить поступление с пищей с пищей, серина, пролина и цистеина, стимулировать синтез муцина, роста и равновесия комменсальной микробиоты, таким образом усилить неспецифическую неиммунную функцию кишечного барьера.
Автор перевода: Анатолий Черников – главный ветеринарный врач, Клиника «101 Далматинец», Москва
Список литературы
1. Ридс П.Дж., Бурин Д.Г., Столл Б., ван Гудувэр Дж.Б. Последствия и регуляция метаболизма кишечника. В Lobley GE, White A, MacRae JC (ред.). Материалы VIII Международного симпозиума по метаболизму белков и питанию. Абердин, Великобритания. Wageningen Press, Вагенинген, Нидерланды. 1999: 127–153.
Ридс П.Дж., Бурин Д.Г., Столл Б., ван Гудувэр Дж.Б. Последствия и регуляция метаболизма кишечника. В Lobley GE, White A, MacRae JC (ред.). Материалы VIII Международного симпозиума по метаболизму белков и питанию. Абердин, Великобритания. Wageningen Press, Вагенинген, Нидерланды. 1999: 127–153.
2. Шарма Р., Янг С., Ной Дж. Молекулярная модуляция кишечного эпителиального барьера: вклад микробиоты. J Biomed Biotechnol. 2010 (в печати).
3. Neutra MR, Forstner JF. Слизь желудочно-кишечного тракта: синтез, секреция и функция.В Леонард Р. Джонсон (ред.). Физиология желудочно-кишечного тракта. Raven Press, Нью-Йорк. 1987: 975–1009.
4. Тернер JR. Молекулярные основы регуляции эпителиального барьера: от основных механизмов до клинического применения. Am J Pathol. 2006; 169: 1 901–1909.
5. Vereecke L, Beyaert R, Van Loo G. Гибель энтероцитов и поддержание кишечного барьера при гомеостазе и болезни. Trends Mol Med. 2011; 17: 584-593.
6. Yu QH, Yang Q. Разнообразие плотных контактов (TJs) между эпителиальными клетками желудочно-кишечного тракта и их функция в поддержании слизистого барьера. Cell Biol Int. 2009; 33: 78-82.
Cell Biol Int. 2009; 33: 78-82.
7. Snoek SA, Verstege MI, Boeckxstaens GE, et al. Кишечная нервная система как регулятор функции кишечного эпителиального барьера при здоровье и болезни. Эксперт Рев Гастроэнтерол Гепатол. 2010; 4: 637-651.
8. Йоханссон М.Э., Амборт Д., Пеласейед Т. и др. Состав и функциональная роль слоев слизи в кишечнике. Cell Mol Life Sci. 2011; 68: 3,635-3,641.
9. Форстнер Дж. Ф., Оливер М. Г., Сильвестр Ф. А.. Производство, структура и биологическая значимость муцинов желудочно-кишечного тракта.В Blaser MJ, Smith PD, Ravdin JI, Greenberg HB, Guerrant RL (ред.). Инфекции желудочно-кишечного тракта. Raven Press, Нью-Йорк. 1995: 71–88.
10. Атума С., Стругала В., Аллен А., Холм Л. Прилипший гелевый слой желудочно-кишечной слизи: толщина и физическое состояние in vivo. Am J Physiol Gastrointest Liver Physiol. 2001; 280: G922-G929.
11. Йоханссон М.Э., Ларссон Д.М., Ханссон Г.С. Два слизистых слоя толстой кишки организованы муцином MUC2, тогда как внешний слой является законодателем взаимодействий между хозяином и микробом. Proc Natl Acad Sci USA. 2011; 108: 4 659–4 665.
Proc Natl Acad Sci USA. 2011; 108: 4 659–4 665.
12. Макгукин М.А., Линден С.К., Саттон П., Флорин TH. Динамика муцина и кишечные патогены. Nat Rev Microbiol. 2011; 9: 265-278.
13. Шенг Й.Х., Хаснайн С.З., Флорин Т.Х., Макгукин М.А. Муцины при воспалительных заболеваниях кишечника и колоректальном раке. J Gastroenterol Hepatol. 2012; 27: 28-38.
14. Ван Клинкен Б.Дж., Эйнерханд А.В., Бюллер Х.А., Деккер Дж. Стратегический биохимический анализ муцинов. Анальная биохимия. 1998; 265: 103-116.
15. Ван дер Слуис М., Де Конинг Б.А., Де Брейн А.С. и др.У мышей с дефицитом Muc2 спонтанно развивается колит, что указывает на то, что MUC2 имеет решающее значение для защиты толстой кишки. Гастроэнтерология. 2006; 131: 117-129.
16. Carraway KL, Theodoropoulos G, Kozloski GA, Carothers Carraway CA. Функции и регуляция Muc4 / MUC4 при раке. Будущее Онкол. 2009; 5: 1,631–1640.
17. Луу Й., Юнкер В., Рачагани С. и др. Муцин кишечника человека MUC17 усиливает восстановление клеток кишечника и ускоряет заживление экспериментального колита. Int J Biochem Cell Biol. 2010; 42: 996–1006.
Int J Biochem Cell Biol. 2010; 42: 996–1006.
18. Реста-Ленерт С., Дас С., Батра С.К., Хо С.Б. Muc17 защищает эпителиальные клетки кишечника от энтероинвазивной инфекции E. coli, способствуя целостности эпителиального барьера. Am J Physiol Gastrointest Liver Physiol. 2011; 300: G1144-G1155.
19. Аллен А. Слизь желудочно-кишечного тракта. В Справочнике по физиологии: желудочно-кишечная система. Слюнная, желудочная, панкреатическая и гепатобилиарная секреция. Am Physiol Soc, Bethesda, MD. 1989: 359-382.
20. Форстнер Г. Передача сигналов, упаковка и секреция муцинов.Annu Rev Physiol. 1995; 57: 585-605.
21. Plaisancié P, Barcelo A, Moro F, et al. Влияние нейротрансмиттеров, кишечных гормонов и медиаторов воспаления на выделение слизи в толстой кишке крыс. Am J Physiol Gastrointest Liver Physiol. 1998; 275: G1073-G1084.
22. Шерман П., Форстнер Дж., Рооми Н. и др. Истощение муцина в кишечнике истощенных крыс. Am J Physiol. 1985; 248: G418- G4123.
23. Фор М.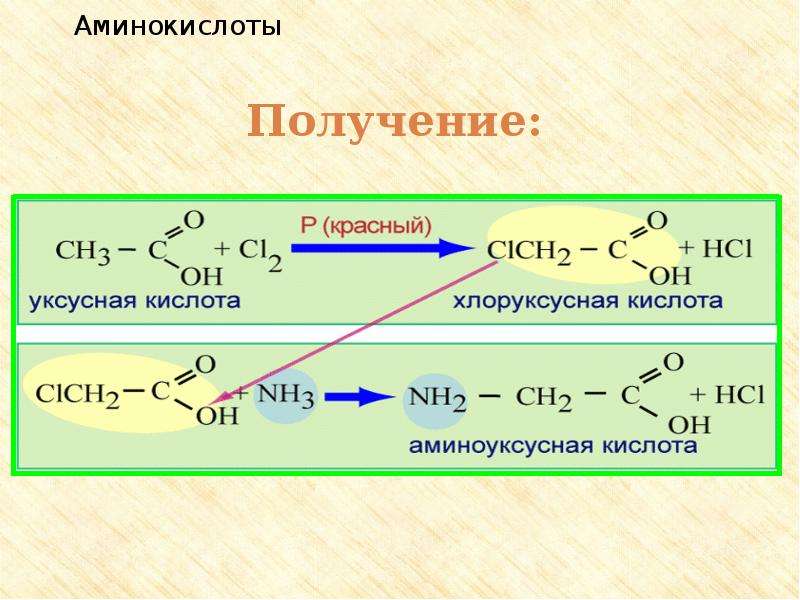 , Моэнноз Д., Монтигон Ф. и др. Ограничение диетического треонина специфически снижает синтез муцина в кишечнике у крыс.J Nutr. 2005; 135: 486-491.
, Моэнноз Д., Монтигон Ф. и др. Ограничение диетического треонина специфически снижает синтез муцина в кишечнике у крыс.J Nutr. 2005; 135: 486-491.
24. Закон Г.К., Бертоло Р.Ф., Аджири-Авере А. и др. Адекватный пероральный прием треонина имеет решающее значение для выработки муцина и функции кишечника новорожденных поросят. Am J Physiol Gastrointest Liver Physiol. 2007; 292: G1293-G1301.
25. Ван X, Qiao S, Yin Y, et al. Дефицит или избыток диетического треонина снижает синтез белка в тощей кишке и скелетных мышцах молодых свиней. J Nutr. 2007; 137: 1,442–1446.
26. Николс Н.Л., Бертоло РФ. Концентрация треонина в просвете резко влияет на синтез белка слизистой оболочки кишечника и синтез муцина у поросят.J Nutr. 2008; 138: 1,298–1,303.
27. Комелли Е.М., Симмеринг Р., Форе М. и др. Многогранная регуляция транскрипции слизистого слоя кишечника мышей эндогенной микробиотой. Геномика. 2008; 91: 70-77.
28. Jenkins RT, Ramage JK, Jones DB и др. Проницаемость тонкого и толстого кишечника для 51Cr-EDTA у пациентов с активным воспалительным заболеванием кишечника. Clin Invest Med. 1988; 11: 151-155.
Clin Invest Med. 1988; 11: 151-155.
29. Арслан Г, Атасевер Т, Циндорук М, Йылдырым ИС. (51) Проницаемость толстой кишки для CrEDTA и ответ на терапию у пациентов с язвенным колитом.Nucl Med Commun. 2001; 22: 997–1001.
30. Махида Ю.Р., Рольфе В.Е. Бактериальные взаимодействия хозяина при воспалительном заболевании кишечника. Clin Sci (Лондон). 2004; 107: 331-431.
31. Отт SJ, Musfeldt M, Wenderoth DF, et al. Уменьшение разнообразия бактериальной микрофлоры слизистой оболочки толстой кишки у пациентов с активным воспалительным заболеванием кишечника. Кишечник. 2004; 53: 685-693.
32. Ким Ю.С., Хо С.Б. Кишечные бокаловидные клетки и муцины в здоровье и болезни: недавние исследования и прогресс. Curr Gastroenterol Rep.2010; 12: 319-330.
33. Sheng YH, Lourie R, Lindén SK, et al. Муцин на поверхности клеток MUC13 защищает от воспаления кишечника, подавляя апоптоз эпителиальных клеток. Кишечник. 2011; 60: 1,661–1670.
34. Ruot B, Bechereau F, Bayle G, et al. Реакция синтеза альбумина печени на инфекцию у крыс зависит от фазы воспалительного процесса. Clin Sci (Лондон). 2002. 102: 107–114.
Реакция синтеза альбумина печени на инфекцию у крыс зависит от фазы воспалительного процесса. Clin Sci (Лондон). 2002. 102: 107–114.
35. Фор М., Шоне Ф, Меттро С. и др. Использование треонина для синтеза белков острой фазы, кишечных белков и муцинов увеличивается во время сепсиса у крыс.J. Nutr. 2007; 137: 1,802–1,807.
36. Ридс П.Дж., Джахур Ф. Аминокислотные потребности болезни. Clin Nutr. 2001; 1: 15-22.
37. Breuille D, Rose F., Arnal M, et al. Сепсис изменяет вклад различных органов в синтез белка всего тела у крыс. Clin Sci (Лондон). 1994; 86: 663-669.
38. Столл Б., Генри Дж., Ридс П. Дж. И др. Катаболизм доминирует в кишечном метаболизме первого прохождения незаменимых аминокислот у поросят, получавших молочный белок. J Nutr. 1998; 128: 606-614.
39.Фуллер М.Ф., Милн А., Харрис С.И. и др. Потери аминокислот в илеостомической жидкости при безбелковой диете. Am J Clin Nutr. 1994; 59: 70-73.
40. Ван дер Слюис, М. Шаарт, Б. де Конинг и др. Метаболизм треонина в кишечнике мышей: потеря муцина 2 вызывает катаболический путь треонина. J Pediatr Gastroenterol Nutr. 2009; 49: 99-107.
J Pediatr Gastroenterol Nutr. 2009; 49: 99-107.
41. Ван Дер Шур С.Р., Ридс П.Дж., Столл Б. и др. Высокая метаболическая стоимость функционального кишечника. Гастроэнтерология. 2002; 123: 1,931–1940.
42. Gaudichon C, Bos C, Morens C и др.Илеальные потери азота и аминокислот у людей и их значение для оценки потребности в аминокислотах. Гастроэнтерология. 2002; 123: 50-59.
43. Heys SD, Park KG, McNurlan MA, et al. Скорость синтеза белка в толстой кишке и печени: стимуляция желудочно-кишечными патологиями. Кишечник. 1992; 33: 976-981.
44. Breuille D, Arnal M, Rambourdin F, et al. Устойчивые модификации белкового метаболизма в различных тканях на модели длительного сепсиса на крысах. Clin Sci (Лондон). 1998; 94: 413-423.
45. Mercier S, Breuille D, Mosoni L, et al. Хроническое воспаление изменяет белковый обмен в некоторых органах взрослых крыс. J Nutr. 2002; 132: 1 921–1928.
46. Эль Юсфи М., Брёй Д., Папет И. и др. Повышенный синтез тканевого белка во время спонтанного колита у крыс HLA-B27 подразумевает различные основные механизмы. Clin Sci (Лондон). 2003; 105: 437-446.
Clin Sci (Лондон). 2003; 105: 437-446.
47. Breuillé D, Bechereau F, Buffiere C, et al. Благоприятное влияние добавок аминокислот, особенно цистеина, на экономию азота в организме крыс с сепсисом.Clin Nutr. 2006; 25: 634-642.
48. Фор М., Моенноз Д., Монтигон Ф. и др. Разработка быстрого и удобного метода очистки муцинов и определения скорости их синтеза in vivo у крыс. Анальная биохимия. 2002; 15 (307): 244-251.
49. Тытгат К.М., Ван дер Валь Дж. В., Эйнерханд А. В. и др. Количественный анализ синтеза MUC2 при язвенном колите. Biochem Biophys Res Commun. 1996; 224: 397-405.
50. Фор М., Моенноз Д., Монтигон Ф. и др. Продукция и состав муцина изменяются при колите, вызванном декстрансульфатом натрия у крыс.Dig Dis Sci. 2003; 48: 1366–1373.
51. Фор М., Моенноз Д., Меттро С. и др. Хронический колит, развиваемый трансгенными крысами HLA-B27, связан с измененным синтезом муцина in vivo. Dig Dis Sci. 2004; 49: 339-346.
52. Фор М., Меттро С., Моэнноз Д. и др. Определенные аминокислоты увеличивают синтез муцина и микробиоту у крыс, получавших декстрансульфат натрия. J Nutr. 2006; 136: 1,558–1564.
Определенные аминокислоты увеличивают синтез муцина и микробиоту у крыс, получавших декстрансульфат натрия. J Nutr. 2006; 136: 1,558–1564.
характеристики, функции, использование в спорте
Многие физиологические процессы, протекающие в организме человека, не могут происходить без наличия аминокислот.Это расщепленные белки, которые всасываются в кровь. Организм человека нуждается во всех употреблении аминокислот.
Аминокислоты могут быть заменимыми (их синтез происходит в организме человека) и незаменимыми (мы получаем их вместе с едой). Обычным людям нет необходимости за присутствием тех или заменителей в организме, но атлеты и спортсмены должны это делать, т.к. потребность в различных расщепленных текстах возрастает. Поэтому они должны приниматься в виде спортивного питания.
Одной из наиболее важных аминокислот является орнитин, который содержит функции.
Общая информация
Орнитин относится к группе заменимых аминокислот – такие вещества имеются в организме человека, где и происходит их синтез. В больших количествах он присутствует в соединительной ткани. Орнитин может преобразовываться в аргинин. Наличие данной аминокислоты в организме человека, всем тем, кто занимается бодибилдингом или фитнесом, требуется дополнительный прием этого вещества.
В больших количествах он присутствует в соединительной ткани. Орнитин может преобразовываться в аргинин. Наличие данной аминокислоты в организме человека, всем тем, кто занимается бодибилдингом или фитнесом, требуется дополнительный прием этого вещества.
Функции орнитина
К основным свойствам орнитина можно отнести:
- Стимуляция выработки соматотропина (гормона роста). Синтез соматотропина происходит в гипофизе (принято считать, что во время сна). Интенсивные нагрузки помогает его выработке. За счет продукции соматотропина увеличение мышечной ткани. Орнитин аналогичен по действию с аргинином, поэтому рекомендован его прием перед сном.
- Проявление гепатопротектроных свойств.Орнитин обеспечивает защиту печени от негативного воздействия всевозможных токсинов, обеспечивается в медикаментозных препаратах и пище. Аминокислота помогает в процессах восстановления печеночных клеток, что крайне важно для всех людей, страдающих от разных патологий печени.
 Исследования показывают, что постоянное использование орнитина позволяет улучшить движение крови по сосудам печени.
Исследования показывают, что постоянное использование орнитина позволяет улучшить движение крови по сосудам печени. - Стимуляция синтеза инсулина. Важным свойством орнитина является возможность его использования в стимулировании стимулирования инсулина, являющимся мощным анаболическим гормоном (важнейший гормон, если выполняется нагрузка на массу).
- Участие в процессах мочеобразования. Орнитинствуют в процессе образования и выведения мочи, способствуя тем самым выведению токсинов (в частности, аммиака, токсичных веществ, образуемого в процессе белкового распада). Происходит это благодаря орнитиновому циклу, во время которого преобразование аммиака в печени в мочевину и ее дальнейший вывод из организма почками.
- Участие в процессах расщепления жирных кислот. Орнитин способен расщеплять жирные кислоты, что позволяет получать дополнительную энергию (крайне важно для тех, кто «сушится» или худеет).Также орнитин, который улучшает сжигает жир даже в ночные часы, улучшает выработку соматотропина, который сам по себе сжигает жир даже в ночные часы.

Орнитин также обладает массой положительных характеристик, которые используются в терапии иммунной системы:
- Укрепление сухожилий и связок.
- Ускорение процессов заживления соединительной ткани (при порезах, ранах).
- Улучшение работы иммунной системы за счет усиления синтеза глютамина.
- Нормализация кислотно-щелочного баланса.
Дозы и использование
Орнитин – крайне актуальная добавка в сфере современного фитнеса и бодибилдинга. Он применяется для следующих целей:
- Расщепление жирных кислот (во время «сушки).
- Ускорение окисления.
- Увеличение мышечной массы.
- Поддерживает нормальную работу иммунной системы.
Рекомендованная ежедневная доза для спортсменов варьируется от 500 до 2000 мг (в зависимости от ряда факторов).Необходимо принимать орнитин на голодный желудок и перед отходом ко сну.
За решение, чтобы достичь орнитина большего эффекта, происходит комбинированный приемнитина и аргинина. На современном рынке можно найти множество продуктов, в составе которых присутствуют орнитин и аргинин одновременно в разных соотношениях. Яркими примерами таких препаратов являются:
На современном рынке можно найти множество продуктов, в составе которых присутствуют орнитин и аргинин одновременно в разных соотношениях. Яркими примерами таких препаратов являются:
- Dynamic Development Night Amino. Оптимальный вариант для применения перед сном. Содержит лизин, орнитин, аргинин, витамин В6.Концентрация всех веществ максимальная.
- Макслер Аргинин / Орнитин / Лизин. Лизин, орнитин и аргинин в этом продукте представлен в продукте 1: 1: 1.
- Twinlab L-Аргинин L-Орнитин. Орнитин и аргинин в предложении 1: 2.
- СЕЙЧАС: L-орнитин 500 мг. В продукте орнитин содержится в чистом виде без добавок.
Орнитин не рекомендовано беременным женщинам (возникают спазмы кишечника, тошнота). Иных противопоказаний аминокислота не имеет.
Заказать Аминокислоты шелка (ШЕЛКОВЫЕ АМИНОКИСЛОТЫ) в «МХ и Густав Геесс Украина»
Торговая марка: SILKERINA HL
Характеристика: Silkerina HL – водорастворимый продукт, полученный ферментативным гидролизом серицина, который является вязким адгезивным белком, находящимся в шелке. Продукт состоит в основном из серина, аланина, глицина, аспарагиновой и глутаминовой кислотой. Благодаря своей гидрофильньной и характерной структуре, Silkerina HL имеет невероятное структурное сходство с кератином кожи и волос, на которые оставляет защитный и увлажняющий слой.Silkerina HL имеет низкую молекулярную массу (5000 дальтон), который позволяет ее проникновение через кутикулу волос и рогового слоя.
Продукт состоит в основном из серина, аланина, глицина, аспарагиновой и глутаминовой кислотой. Благодаря своей гидрофильньной и характерной структуре, Silkerina HL имеет невероятное структурное сходство с кератином кожи и волос, на которые оставляет защитный и увлажняющий слой.Silkerina HL имеет низкую молекулярную массу (5000 дальтон), который позволяет ее проникновение через кутикулу волос и рогового слоя.
Применение: Благодаря своим свойствам Silkerina HL может использовать жидких средств против старения и гелей, увлажняющих средств для лица и питательных веществ, кремах для глаз, губ и тела, так же как в средствах для душа и ванны. Благодаря формированию слоя и значительным свойствам Silkerina HL идеально подходит для использования в рецептуре ухода за волосами, таких как шампунь, кондиционеры для волос и уход, восстанавливающий структуру кожи.Он особенно подходит для обслуживания продуктов для обработанных и поврежденных волос. Процент использования изменяется от 0,5% до 3% для обогащения специальными добавками рецептур. Он может действовать в холодном или горячем состоянии. Он проповедует прозрачными составами.
Он может действовать в холодном или горячем состоянии. Он проповедует прозрачными составами.
Наименование INCI (ЕС) / CTFA: ШЕЛКОВЫЕ АМИНОКИСЛОТЫ
№ CAS: 96690-41-4
№ EINECS: 306-235-8
Стабилизаторы: Феноксиэтанол, Метилпарабен, Этилпарабен, Пропилпарабен 0.5% Натрий Дегидроацетат 0,1%
Происхождение: Животное, синтетическое
ХАРАКТЕРНАЯ ОСОБЕННОСТЬ
Главные параметры проверенные на партии продукта. Эти значения сообщаться сопроводительному сертификату анализа для каждой партии.
ДРУГИЕ ХАРАКТЕРИСТИКИ
Аллергены: подтверждено, что SILKERINA HL подчиняются правилам Европейской Директиве
2003/15 / EC касательно наличия 26 веществ, идентифицированных как аллергенные.Из-за природы материалов, используемых для нашего производства, можно заявить, что эти аллергены отсутствуют.
Мы можем также подтвердить отсутствие метилэвгенол (93-15-2), ксилольный мускус (81-15-2) и кетон-мускус (81-14-1), регламентируемый XXIX Директивой комиссии ЕС 2003/16 от 19 февраля 2003, адаптированого к Дополнению III технического прогресса к Директиве Совета 76/768 / ECC.
CMR: подтверждено, что SILKERINA HL подчиняются правилам Европейской Директиве
2003/15 / EC касательно наличия веществ CMR 1, 2, 3 (таких, как примесь или остатки даже реакции).Из-за природы материалов, используемых для нашего производства, можно заявить, что эти вещества отсутствуют.
ГМО: Мы гарантируем отсутствие ГМО в составе продукта.
ТОКСИКОЛОГИЧЕСКИЕ ДАННЫЕ
Продукт изготовлен из природных компонентов и не проверен на животных. Лабораторные тесты доказали, что он не вызывает раздражения. Тесты доступны по запросу.
СПЕЦИФИКАЦИЯ ПРОДУКТА
| Характеристика | Спецификация |
| Внешний вид | жидкость |
| Запах | характерный |
| pH (20 ° С) | 4,00-6,00 |
| Сухой остаток (%) | 11,00-13,00 |
| Микробиологическая проба | – |
| Общее бактериальное число (КОЕ / г) | <100 |
| Плесневые и дрожжевые грибы (КОЕ / г) | <10 |
Примечание: возможный осадок не портит качество товара.
Фасовка 0,5кг 1кг 2кг
ФОРМИРОВАНИЕ ПУЛА СВОБОДНЫХ АМИНОКИСЛОТ ПЕЧЕНИ КРЫС В УСЛОВИЯХ РАЗЛИЧНЫХ ФОРМ АЛКОГОЛЬНОЙ ИНТОКСИКАЦИИ ПРИНИМАНИЯ КОРРЕКЦИИ L -– АРГИНИНОМ | Артемова (Артемова О.В.)
Аминокислоты и их производные в патогенезе и лечение поражений печени / Л. И. Нефёдов [и др.] // Весцi. АН Беларусі, Сер. біял. навук. – 1997. – №2. – С. 39–48.
Бенсон Дж. В. Хроматографический анализ аминокислот и пептидов на сферических смолах и его применение в биохимии и медицине / Дж.В. Бенсон, Дж. А. Патерсон // Новые методы анализа аминокислот, пептидов и белков; под ред. Ю. А. Овчинникова – М .: Мир, 1974. – С. 9–84.
Биохимия и алкоголизм (I): метаболические процессы при алкоголизме / И.М. Рослый [и др.] // Вопросы наркологии. – 2004. – №2. – С. 70–79.
Влияние предшественника монооксида азота – L – аргинина и блокаторов NO – эргической системы на активность дегидрогеназ ЦТК и сопряжённые с ним реакции / Л.М. Караедова [и др. ] // Активные формы кислорода, азота и хлора в регуляции клеточных функций в норме и при патологии.- Гродно, 2006. – Ч.1. – С. 98–104.
] // Активные формы кислорода, азота и хлора в регуляции клеточных функций в норме и при патологии.- Гродно, 2006. – Ч.1. – С. 98–104.
Лелевич В.В. Характеристика пула свободных аминокислот плазмы крови крыс в условиях прерывистой интоксикации. Лелевич, О.В. Артёмова // М – лы респ. конф. «Актуальные вопросы молекулярной эволюции и биохимии», БГМУ, Минск. – 2006, – С. 16–18.
Гридлевский Р. Роль монооксида азота в сердечно-сосудистой системе / Р.Гридлевский // Вестник ГГМУ. – 2003. – № 4. – С.
Козловский А. В. Характеристика запаса аминокислот сыворотки крови в динамике алкогольного абстинентного синдрома.Автореф. дисс. канд. мед. наук. – Минск. – 1993. – С. 11-13.
Марков Х.М. О биорегуляторной системе L – аргинин – оксид азота. / Х.М. Марков // Патологическая физиология и экспериментальная терапия. – 1996. – № 1. – С. 34–39.
Островский Ю.М. Аминокислоты в патогенезе, диагностике и лечении алкоголизма / Ю.М. Островский, С.Ю. Островский. – Мн: Наука и техника, 1995.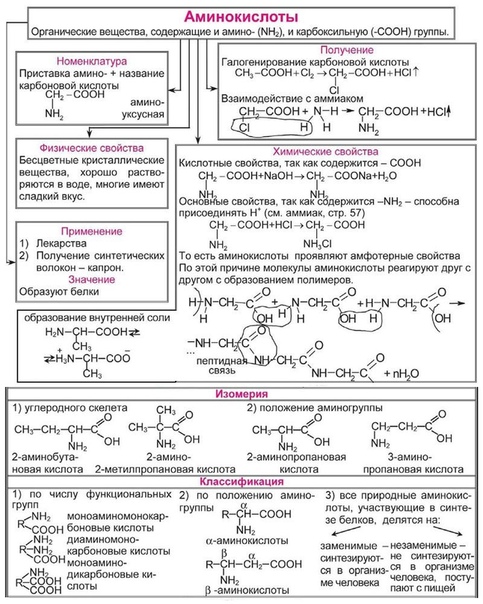 – 280 с.
– 280 с.
Ходосовский М.Н. Участие L – аргинин –НО системы в развитии реперфузионых повреждений печени / М.Н. Ходосовский, В.В. Зинчук // Экспериментальная и клиническая фармакология. – 2003. – № 3. – С. 39–43.
Шейбак В.М. Обмен аминокислот и КоА приольной интоксикации / В.М. Шейбак. – Гродно. – 1998. – 153с.
Аргинин обращает вызванные этанолом воспалительные и фибротические изменения в печени, несмотря на продолжающееся введение этанола / амин a. нанжи [и др.] // журнал фармакологии и экспериментальной терапии – 2001. – №299. – С. 832–839.
Артёмова О.В. Свободные аминокислоты в печени крыс при прерывистой алкогольной интоксикации / О.В. Артёмова // Алкоголь и алкоголизм. – 2005. – Т. 40. – Р. 163.
Соколович Д. Добавка L – аргинина увеличивает детоксикацию аммиака у крыс, получавших этанол / Д. Соколович // Алкоголь и алкоголизм. – 2007. – Т. 42. – Р. 153.
Сосудистые и гормональные реакции на аргинин: обеспечение субстрата для оксида азота или неспецифический эффект? / Р.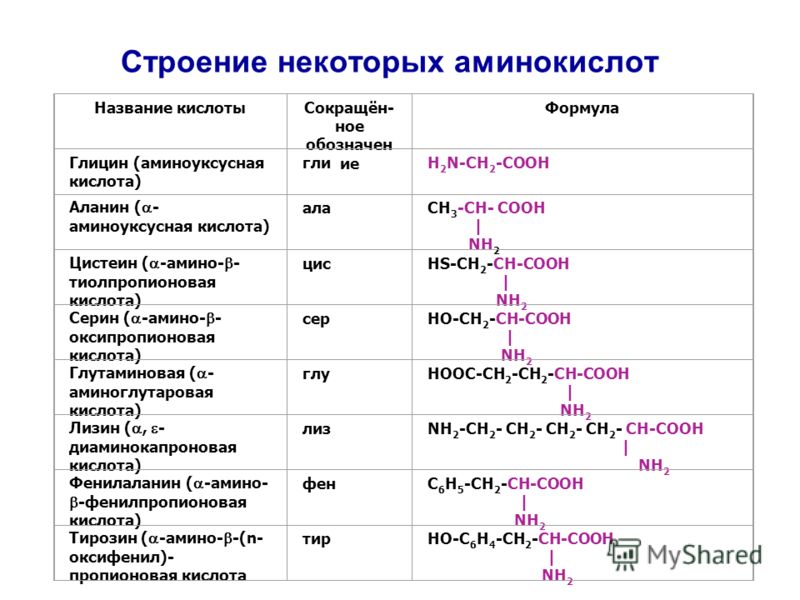 Дж. Макаллистер [и др.] // Clin. Sci.- 1995. – № 89. – С.183–90.
Дж. Макаллистер [и др.] // Clin. Sci.- 1995. – № 89. – С.183–90.
Аминокислоты Nutrend Taurine Vitality Support 120cap
Описание Аминокислоты Nutrend Taurine Vitality Support 120cap
Предназначен для стимулирования организма, и прежде всего работы головного мозга.Он способствует снятию усталости, улучшению улучшения и улучшений. Таурин – основной компонент энергетических напитков.
Таурин – стимулятор деятельности нервной системы и «акселератор» передачи нервных импульсов (к примеру увеличение сорости передачи нервных импульсов к мышечному волокну – улучшение реакции).
Характеристика действующего вещества:
Таурин – заменимая аминокислота. Основные задачи таурина – стимуляция работы головного мозга, улучшение движений, повышения, стрессоустойчивость. Таурин снимает усталость, ощущение истощения и повышает концентрацию. Интересно то, что таурин обладает способностью транспортировать глюкозу к мышечным клеткам (по аналогии к инсулину), что может быть использовано для быстрого восстановления. Например, применение таурина перед силовыми тренировками – увеличивает его в крови, что позволяет во время перерывов между сериями повторений упражнений транспортировать к мышечным клеткам углеводы – это дает возможность каждую последующую серию выполнить более качественно и с большим повторением.Такой же эффект может быть получен и в других соревнованиях. Очень важно добавление таурина в рацион вегетарианцев, так как мясо – основной источник таурина.
Таурин снимает усталость, ощущение истощения и повышает концентрацию. Интересно то, что таурин обладает способностью транспортировать глюкозу к мышечным клеткам (по аналогии к инсулину), что может быть использовано для быстрого восстановления. Например, применение таурина перед силовыми тренировками – увеличивает его в крови, что позволяет во время перерывов между сериями повторений упражнений транспортировать к мышечным клеткам углеводы – это дает возможность каждую последующую серию выполнить более качественно и с большим повторением.Такой же эффект может быть получен и в других соревнованиях. Очень важно добавление таурина в рацион вегетарианцев, так как мясо – основной источник таурина.
Назначение:
Во время – состояние усталости, интенсивной физической активности, когда максимальная готовность, когда необходима сверхстимуляция работы головного мозга, во время работы, которая требует постоянной концентрации (тяжелая умственная работа, водители, студенты.

 Таким образом, некоторые аминокислоты необходимы для нормальной работы головного мозга.
Таким образом, некоторые аминокислоты необходимы для нормальной работы головного мозга.




 Исследования показывают, что постоянное использование орнитина позволяет улучшить движение крови по сосудам печени.
Исследования показывают, что постоянное использование орнитина позволяет улучшить движение крови по сосудам печени.