– свойства белков – Биохимия
К физико-химическим свойствам белков относят амфотерность, растворимость, способность к денатурации, коллоидные свойства.
Амфотерность
Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы.
Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0.
Если в пептиде или белке преобладают основные аминокислоты (лизин и аргинин), то при нейтральных рН заряд белка положительный, т.к. обусловлен положительным зарядом радикала этих аминокислот.
Если в белке преобладают кислые аминокислоты (глутамат и аспартат), то белок кислый, при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот.
Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот.
Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать стабильность рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании.
С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обусловливает их способность к высаливанию, что удобно для выделения белков в нативной (живой) конформации.
Влияние рН на заряд белка
При смещении рН в растворе изменяется концентрация ионов Н+.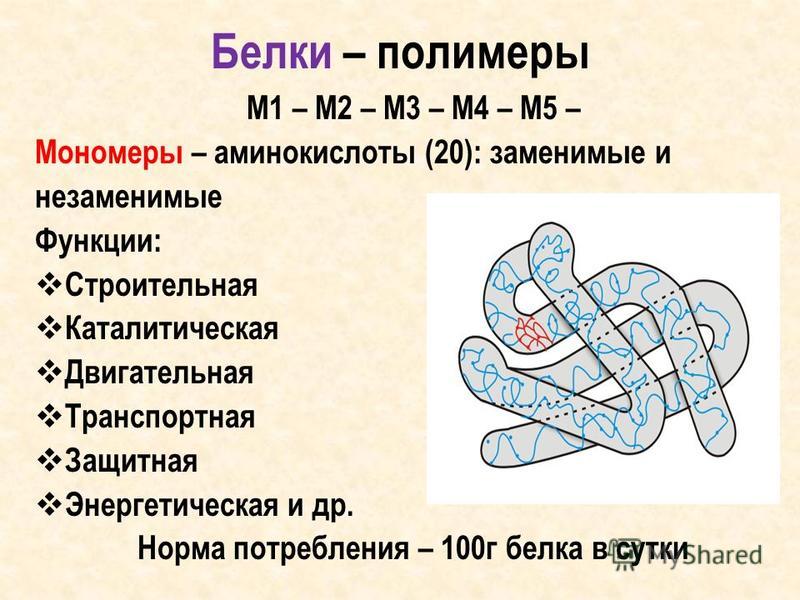 При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным.
При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным.
При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Изменение заряда белковой цепи при изменении pH
Растворимость
Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
- наличием заряда и взаимоотталкиванием заряженных молекул белка,
- наличием гидратной оболочки – окружение молекулы диполями воды и взаимодействие их с полярными и заряженными группами на поверхности глобулы белка. Чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка.

Например, 100 г белка альбумина связывает 30-50 г воды.
Белки и их функциональные свойства в пищевых продуктах
Уникальное сочетание биологических, питательных и функциональных свойств белков делает их важными пищевыми ингредиентами, способными обеспечить широкий спектр разнообразных и универсальных продуктов после обработки. Белки содержат аминокислоты, которые обеспечивают необходимую питательную поддержку, а некоторые фракции, такие как сыворотка и казеин, являются хорошими источниками функциональных белков.
Функциональность белка — это общий термин, определяемый как любое физико-химическое свойство, влияющее на процессинг и поведение белковых систем, на свойства мясных компонентов и качества конечного продукта.
Техно-функциональные свойства белков
Такие свойства белка, как эмульсионность, пенообразование, гелеобразование, растворимость, реологические, вязкостные и водосвязывающие свойства, влияют на обработку, приготовление и хранение пищевых продуктов, а также вносят свой вклад в качество и органолептические свойства пищевых продуктов.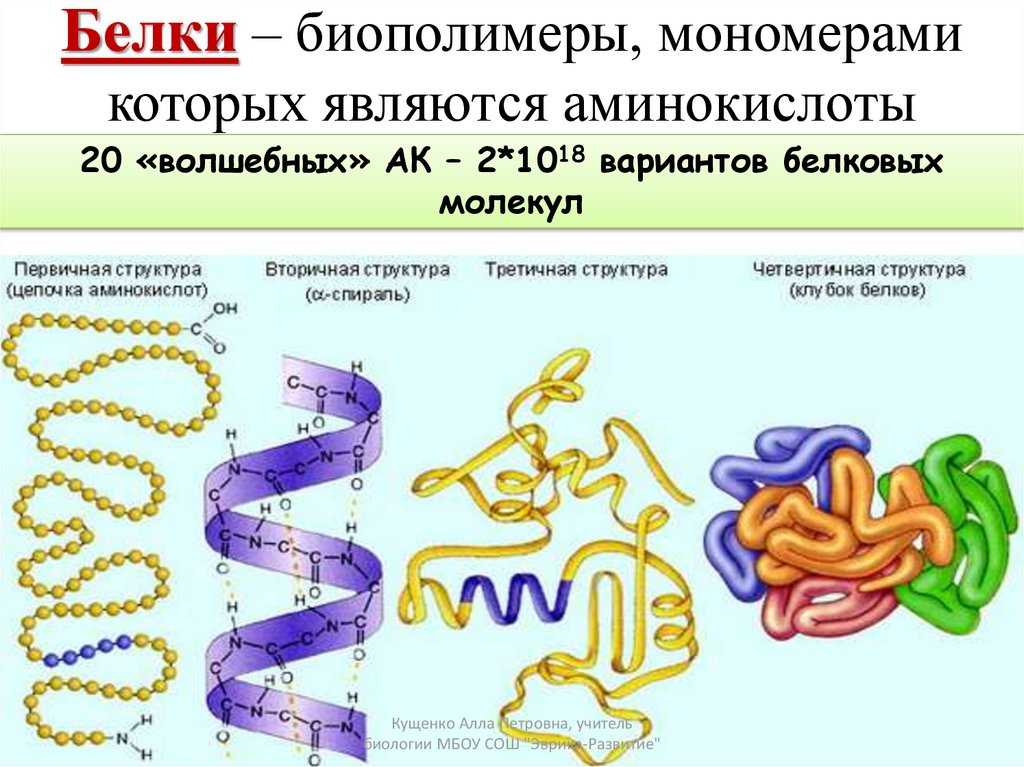
Белки играют важную роль в качестве поверхностно-активных веществ в пищевых пенах и эмульсиях, а белки, полученные из молока и яиц, занимают центральное место в качестве стабилизаторов пены и эмульсий.
Свойства животных белков
Животные белки являются важным и часто незаменимым компонентом различных пищевых продуктов, где их физико-химические и биологические характеристики служат для повышения питательных, органолептических и даже оздоровительных свойств этих продуктов.
Высокое питательное качество и отличные физико-химические свойства молочных белков казеина и сыворотки лежат в основе их широкого использования во многих пищевых продуктах. От детских смесей, сметаны, йогурта, мармелада и сливок для кофе до майонеза, мороженого, десертов, мясных полуфабрикатов, сыра для пиццы, взбитых сливок и заправок для салатов – это лишь несколько примеров широко потребляемых пищевых продуктов, содержащих животные белки.
Точно так же физико-химические и структурные свойства белков мяса имеют решающее значение для их использования при приготовлении для изготовления мясных полуфабрикатов и консервов, колбас, аналогов морепродуктов (имитации крабового мяса).
Животные белки в лечебном питании
Биологические свойства белковых гидролизатов и пептидов животного происхождения также способствовали их использованию в пищевой промышленности для приготовления лечебных пищевых продуктов, предназначенных для лечения пищевых аллергий и контроля таких состояний, как кистозный фиброз, заболевания печени, болезнь Крона и фенилкетонурия. Было обнаружено, что такие гидролизаты пищевых белков и биоактивные пептиды животного происхождения обладают рядом полезных для здоровья свойств, включая гиполипидемическую, антиоксидантную, антипролиферативную, иммуномодулирующую, антимикробную и антигипертензивную активность.
ООО «ТПП «БиоПроФуд»
ИНН 7735148750
ОГРН 5157746107833
Адрес: 124365, город Москва, город Зеленоград, Заводская ул. , д. 21а стр. 1, офис 4
, д. 21а стр. 1, офис 4
18+
Реклама
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter
версия для печати
Белки — физические и химические свойства
Присоединяйся сейчас
Если вы готовы сдать экзамены по биологии уровня A, станьте участником прямо сейчас, чтобы получить полный доступ ко всей нашей библиотеке материалов для повторения.
Присоединяйтесь к более чем 22 000 учащихся, сдавших экзамены благодаря нам!
Зарегистрируйтесь ниже, чтобы получить мгновенный доступ!
Присоединиться →
Или попробуйте пример…
Еще не готовы приобрести комплект для доработки? Без проблем. Если вы хотите ознакомиться с тем, что мы предлагаем, перед покупкой, у нас есть бесплатная подписка с образцами материалов для пересмотра.
Зарегистрируйтесь в качестве бесплатного члена ниже, и вы вернетесь на эту страницу, чтобы попробовать образцы материалов перед покупкой.
Скачать образцы →
Быстрая навигация
[скрыть]
Физические свойства белков- Цвет и вкус
Белки бесцветны и обычно не имеют вкуса. Они однородные и кристаллические. - Форма и размер
Форма белков варьируется от простых кристаллоидных сферических структур до длинных фибриллярных структур. Были распознаны два различных образца формы
:
A. Глобулярные белки- Они имеют сферическую форму и встречаются в основном в растениях, особенно в семенах и клетках листьев. Это пучки, образованные складыванием и смятием белковых цепей. например, пепсин, эдестин, инсулин, рибонуклеаза и т. д.
B. Белки фибриллярные – Они имеют нитевидную или эллипсоидальную форму и обычно встречаются в мышцах животных. Большинство исследований структуры белка было проведено с использованием этих белков. например, фибриноген, миозин и т. д.
д. - Молекулярная масса
Белки обычно имеют большую молекулярную массу в диапазоне от 5 × 103 до 1 × 106. Следует отметить, что значения молекулярной массы многих белков близки или кратны 35 000 и 70 000. - Коллоидная природа
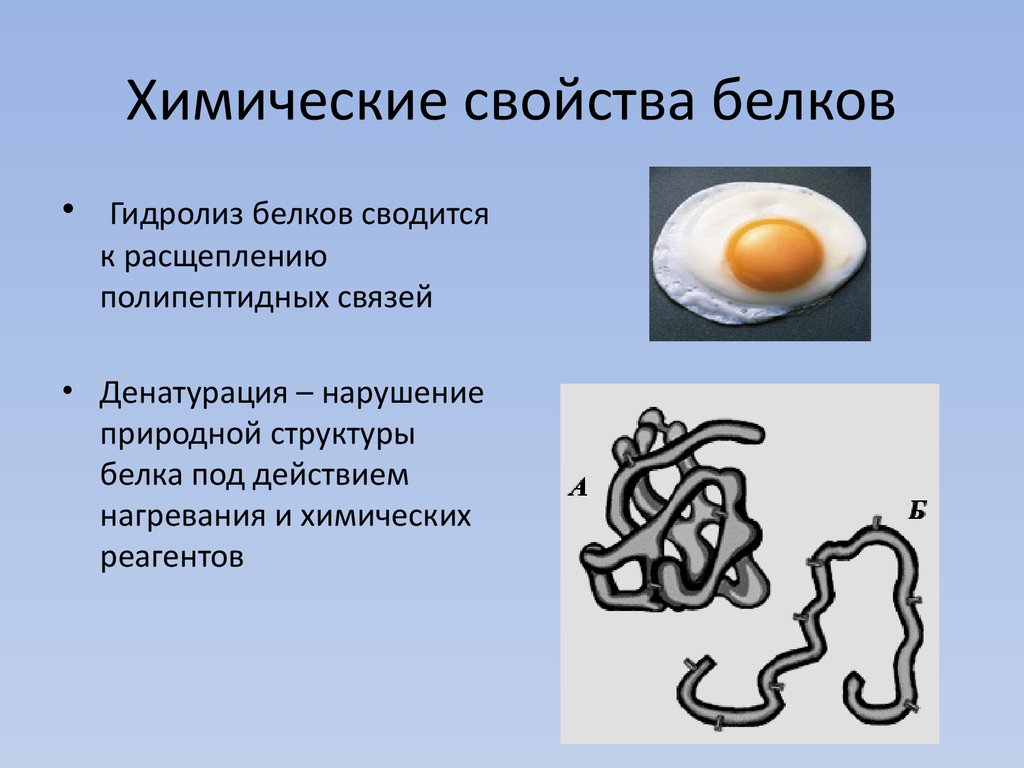
Из-за своего гигантского размера белки обладают многими коллоидными свойствами, такими как; Скорость их диффузии чрезвычайно мала, и они могут вызывать значительное светорассеяние в растворе, что приводит к видимой мутности (эффект Тиндаля). - Денатурация
Денатурация относится к изменениям свойств белка. Другими словами, это потеря биологической активности. Во многих случаях за процессом денатурации следует коагуляция — процесс, при котором денатурированные белковые молекулы имеют тенденцию образовывать большие агрегаты и осаждаться из раствора. - Амфотерная природа
Подобно аминокислотам, белки являются амфотерными, т. е. действуют как кислоты и щелочи. Они мигрируют в электрическом поле, и направление миграции зависит от суммарного заряда, которым обладает молекула. На чистый заряд влияет значение pH. Каждый белок имеет фиксированное значение изоэлектрической точки (pl), при которой он будет двигаться в электрическом поле.
Они мигрируют в электрическом поле, и направление миграции зависит от суммарного заряда, которым обладает молекула. На чистый заряд влияет значение pH. Каждый белок имеет фиксированное значение изоэлектрической точки (pl), при которой он будет двигаться в электрическом поле. - Способность связывать ионы
Белки могут образовывать соли как с катионами, так и с анионами в зависимости от их суммарного заряда. - Растворимость
На растворимость белков влияет рН. Растворимость самая низкая в изоэлектрической точке и увеличивается с увеличением кислотности или щелочности. Это связано с тем, что когда белковые молекулы существуют в виде катионов или анионов, силы отталкивания между ионами велики, поскольку все молекулы обладают избыточными зарядами одного знака. Таким образом, они будут более растворимы, чем в изоэлектрическом состоянии. - Оптическая активность
Все белковые растворы поворачивают плоскость поляризованного света влево, т.
- Гидролиз
Белки гидролизуются различными гидролитическими агентами.
A. Кислотными агентами: Белки при гидролизе с конц. HCl (6–12 н.) при 100–110°С в течение 6–20 ч дают аминокислоты в виде их гидрохлоридов.
B. С помощью щелочных агентов: белки также можно гидролизовать с помощью 2 н. NaOH. - Реакции с участием группы СООН
A. Реакция со щелочами (солеобразование)
B. Реакция со спиртами (этерификация)
C. Реакция с аминами - Реакции с участием группы Nh3
A. Реакция с минеральными кислотами (солеобразование): когда свободные аминокислоты или белки обрабатывают минеральными кислотами, такими как HCl, образуются кислые соли.
B. Реакция с формальдегидом: С формальдегидом образуются гидроксиметилпроизводные.
C. Реакция с бензальдегидом: образуются основания Шиффа
D. Реакция с азотистой кислотой (реакция Ван Слайка): Аминокислоты реагируют с HNO2 с выделением газообразного N2 и образованием соответствующих α-гидроксикислот.
Реакция с азотистой кислотой (реакция Ван Слайка): Аминокислоты реагируют с HNO2 с выделением газообразного N2 и образованием соответствующих α-гидроксикислот.
E. Реакция с ацилирующими агентами (ацилирование)
F. Реакция с FDNB или реагентом Сенгера
G. Реакция с дансилхлоридом - Реакции с участием группы COOH И Nh3
A. Реакция с трикетогидринденгидратом (нингидриновая реакция)
B. Реакция с фенилизоцианатом: с фенилизоцианатом образуется гидантоиновая кислота, которая, в свою очередь, может быть преобразована в гидантоин.
C. Реакция с фенилизотиоцианатом или реактивом Эдмана
D. Реакция с фосгеном: С фосгеном образуется N-карбоксиангидрид
E. Реакция с сероуглеродом: с сероуглеродом образуется 2-тио-5-тиозолидон - Реакции с участием группы R или боковой цепи
B. Ксантопротеидный тест
C. Тест Миллона
D. Тест Фолина
E. Тест Сакагучи
F. Тест Паули
Тест Паули
G. Тест Эрлиха - Реакции с участием группы SH
A. Испытание с нитропруссидом: при использовании нитропруссида натрия в разбавленном Nh5.OH появляется красная окраска. Тест специфичен для цистеина.
B. Тест Салливана: цистеин окрашивается в красный цвет в присутствии 1,2-нафтохинон-4-сульфоната натрия и гидросульфита натрия.
Часто задаваемые вопросы
Что такое глобулярные белки?Белки, в которых полипептидные цепи складываются сами на себя, принимая глобулярную форму, называются глобулярными белками. Эти белки имеют третичную или четвертичную структуру.
Какие глобулярные белки растворимы в воде?Глобулярные белки, имеющие на своей поверхности гидрофильные аминокислоты, растворимы в воде. Это связано с тем, что гидрофильные аминокислоты могут образовывать водородные связи и другие полярные связи с молекулами воды.
Что понимается под денатурацией? Денатурация – это процесс, при котором белок теряет свою структуру и функции. Это потеря биологической активности белка. Денатурация белков может происходить из-за изменений в окружающей среде.
Это потеря биологической активности белка. Денатурация белков может происходить из-за изменений в окружающей среде.
Биуретовый тест и нингидриновый тест можно использовать для определения присутствия белков в растворе.
Функции, структура, свойства и классификация
РЕКЛАМА:
Проведем углубленное изучение белков. Прочитав эту статью, вы узнаете: 1. Функции белков 2. Структуры белков 3. Свойства белков и 4. Классификация белков.
Белки представляют собой азотсодержащие органические соединения с высокой молекулярной массой, которые играют жизненно важную или первостепенную роль в живых организмах. Они состоят из 20 стандартных а-аминокислот.
Функции белков:Основные функции белков в организме человека:
РЕКЛАМА:
1. Они служат единицами бодибилдинга, например, мышечными белками.
2. Обеспечивают поддержку и защиту различных тканей, например, коллагена и кератина.
3. Все химические реакции в организме катализируются белковыми ферментами, например трипсином.
4. Переносят различные молекулы и ионы из одного органа в другой, например, гемоглобин, сывороточный альбумин.
РЕКЛАМА:
5. Они хранят и обеспечивают питательные вещества, например молочный казеин, яичный альбумин.
6. Защищают организм от вредных инородных организмов, например, иммуноглобулины, фибриноген.
7. Они помогают регулировать клеточную или физиологическую активность, например, гормонов, а именно инсулина, ГР.
Структуры белков: Первичная структура белков :Первичная структура белков относится к общему количеству аминокислот и их последовательности в данном конкретном белке.
Определенное количество аминокислот расположены в определенной последовательности. Последовательность аминокислот в белке определяет его биологическую роль. Различные белки имеют разные последовательности. Поэтому изучение общего числа и последовательности аминокислот в белке есть изучение его первичной структуры.
Последовательность аминокислот в белке определяет его биологическую роль. Различные белки имеют разные последовательности. Поэтому изучение общего числа и последовательности аминокислот в белке есть изучение его первичной структуры.
Первичная структура отличает нормальный белок от аномального. Нормальный взрослый гемоглобин (HbA) состоит из 2 α-цепей и 2 β-цепей. Каждая α-цепь состоит из 141 аминокислоты, а каждая β-цепь состоит из 146 аминокислот, расположенных в определенной последовательности. Любое изменение в последовательности приводит к аномальному гемоглобину. Как и в серповидноклеточном гемоглобине (HbS), аминокислота валин присутствует в 6-м положении Р-цепи вместо глутаминовой кислоты в нормальном гемоглобине.
Вторичная структура белков :Это относится к скручиванию полипептидной цепи в спиральную форму.
Встречаются три типа спиральных структур:
РЕКЛАМА:
(а) Альфа-спираль
(b) Бета со складками и
(c) Обратный поворот.
1. Альфа-спираль:
РЕКЛАМА:
α означает первую, и структура, описанная ниже, была первой среди обнаруженных спиральных структур, поэтому она известна как альфа (α) спираль.
Отличительные особенности этой структуры:
я. Здесь полипептид закручивается или скручивается, образуя правостороннюю спиральную структуру.
ii. Расстояние между каждым витком катушки равно 5,4 Å.
РЕКЛАМА:
III. На виток приходится 3,6 аминокислоты.
ив. Группы «R» видны выступающими из спирали.
v. Имеются внутрицепочечные водородные связи, при которых водород группы -NH соединяется с кислородом группы -СО 4-й аминокислоты позади нее. Таким образом, каждая пептидная группа участвует в водородных связях.
в.и. Этот тип структуры встречается во многих белках в сочетании с другими структурами. Чистая а-спиральная структура наблюдается в белке волос, то есть в кератине.
2. Бета со складками:
Бета со складками:
β означает второе, и структура, описанная ниже, была вторым открытием после α-спирали.
Отличительные черты этой конструкции:
я. Здесь цепь не спиральная, а зигзагообразная.
ii. Расстояние между каждым витком равно 7 Å.
III. Полипептидные цепи расположены рядом в виде складок.
РЕКЛАМА:
ив. Между цепями существует межцепочечная водородная связь, и каждая пептидная группа участвует в водородной связи.
Цепи антипараллельны друг другу.
3. Обратный поворот:
Складывается в обратном направлении цепи.
Третичная структура белков :Спиральная форма полипептида сворачивается в сферическую, глобулярную, эллипсоидальную или другую конформацию, которая называется третичной структурой белков. Эта укладка необходима для биологической активности белков. например, ферменты, иммуноглобулины.
Третичная конформация поддерживается четырьмя типами связей:
РЕКЛАМА:
1. Водородные связи:
Водородные связи:
Образуется между водородом и электроотрицательным атомом, таким как кислород или азот, в группе «R» аминокислот.
2. Ионные взаимодействия:
Образуется из кислых (глутаминовая и аспарагиновая) и основных (аргинин, лизин или гистидин) аминокислот.
3. Дисульфидные связки:
Это прочная связь, образованная между сульфгидрильными группами двух цистеиновых аминокислот. Образовавшаяся в результате димерная структура известна как цистин (аминокислота, содержащаяся только в белках, а не в свободной форме).
4. Гидрофобные взаимодействия:
Группы «R» гидрофобных аминокислот объединяются вместе в центре вдали от воды, тем самым развивая силу притяжения между каждой группой «R» и силу отталкивания от воды, и эти взаимодействия известны как гидрофобные взаимодействия.
Четвертичная структура белков: Четвертичная структура представлена олигомерными белками.
Олигомерные белки:
Имеют две или более полипептидные цепи.
Четвертичная структура относится к типу расположения полипептидов в олигомерном белке. Эти полипептиды удерживаются вместе водородными связями, ионными связями или силами Вандер-Ваальса, например, гемоглобин имеет четыре полипептидные цепи, которые расположены определенным образом, что относится к четвертичной структуре гемоглобина.
Четвертичная структура гемоглобина описывает, что он состоит из четырех полипептидных цепей; два из которых α (α 1 и α 2 ), а два других — β (β 1 и β 2 ). Две альфа-цепи противоположны друг другу и примыкают к каждой β-цепи. Цепи α и цепи β связаны между собой солевыми мостиками.
Структурно-функциональная взаимосвязь в белках:
Гемоглобин играет жизненно важную роль в транспорте кислорода от легких к периферическим тканям и транспорте углекислого газа из тканей в легкие.
Существует три типа нормального гемоглобина со следующими полипептидами:
(1) Взрослый гемоглобин (Hb A) имеет цепи 2α2β.
(2) Фетальный гемоглобин (Hb F) имеет цепи 2α2γ.
(3) Малый взрослый гемоглобин (Hb A 1 ) имеет цепи 2α2δ.
Количество аминокислот в α-цепях составляет 141 аминокислоту, а в других цепях, то есть в β-, γ- и δ-цепях, 146 аминокислот. Эти цепи различаются по различию в последовательности расположения аминокислот в цепях. Четвертичная структура гемоглобина создает полость между тетрамером, в которой присутствует 2, 3, дифосфоглицерат (ДФГ или БФГ), образующий солевой мостик с амино-концом β-цепи, который стабилизирует гемоглобин, тем самым снижая сродство к кислороду.
В легких высокое парциальное давление кислорода приводит к связыванию O 2 с одной из цепей гемоглобина, что приводит к разрыву солевых мостиков между четырьмя субъединицами. Последующее связывание кислорода (сигмовидная кривая ассоциации Hb-O 9 ) облегчается разрывом солевых мостиков, изменяющих вторичную, третичную и четвертичную структуры, что позволяет вращать одну α/β-субъединицу по отношению к другой α/β-цепи, тем самым сжимая тетрамер и высвобождение ДФГ. Это приводит к увеличению его сродства к кислороду (состояние R Hb).
Это приводит к увеличению его сродства к кислороду (состояние R Hb).
В периферических тканях СО 2 связывается с а-аминогруппой аминоконца с преобразованием ее положительного заряда в отрицательный, что способствует образованию солевого мостика между полипептидными цепями с возвратом в дезоксисостояние (Т-состояние), т. е. выделение кислорода из Hb. Высвобождению O 2 из Hb также способствует связывание DPG с тетрамером.
Когда человек взлетает в полет, аэроплан медленно набирает высоту, что приводит к снижению O 2 напряжение, из-за которого невозможна оксигенация гемоглобина. При этом человек испытывает гипоксию, но физиологический механизм организма начинает снижать выработку ДФГ, благодаря чему Hb может связывать кислород даже при более низком давлении кислорода.
Поэтому, когда аэроплан набирает максимальную высоту и держится стабильно, человек чувствует себя комфортно. Когда Hb достигает тканей, уровень ДФГ увеличивается, усиливая выделение кислорода. Точно так же вышеописанный процесс обращается вспять, когда человек ныряет глубоко в море. Высокий O 2 давление приводит к увеличению продукции ДФГ, что способствует оксигенации гемоглобина в легких и дезоксигенации в периферических тканях.
Точно так же вышеописанный процесс обращается вспять, когда человек ныряет глубоко в море. Высокий O 2 давление приводит к увеличению продукции ДФГ, что способствует оксигенации гемоглобина в легких и дезоксигенации в периферических тканях.
Частичное или полное разворачивание нативной (природной) конформации полипептидной цепи известно как денатурация. Это вызвано теплом, кислотами, щелочами, спиртом, ацетоном, мочевиной, бета-меркаптоэтанолом.
2. Коагуляция:Когда белки денатурируются нагреванием, они образуют нерастворимые агрегаты, известные как сгустки. Все белки не коагулируют при нагревании, лишь немногие, такие как альбумины и глобулины, способны коагулировать при нагревании.
3. Изоэлектрический pH (pH 1 ): рН, при котором белок имеет одинаковое количество положительных и отрицательных зарядов, называется изоэлектрическим рН. Под действием электрического поля белки не движутся ни к аноду, ни к катоду, поэтому это свойство используется для выделения белков. Белки становятся наименее растворимыми при pH 9.0431 I и попасть в осадок. pH I казеина составляет 4,5, и при этом pH казеин в молоке свертывается, образуя сгусток.
Под действием электрического поля белки не движутся ни к аноду, ни к катоду, поэтому это свойство используется для выделения белков. Белки становятся наименее растворимыми при pH 9.0431 I и попасть в осадок. pH I казеина составляет 4,5, и при этом pH казеин в молоке свертывается, образуя сгусток.
Средняя молекулярная масса аминокислоты принимается равной 110. Общее количество аминокислот в белке, умноженное на 110, дает приблизительную молекулярную массу этого белка. Разные белки имеют разный аминокислотный состав и, следовательно, их молекулярные массы различаются. Молекулярные массы белков колеблются от 5000 до 10 9 Дальтон. Экспериментально молекулярную массу можно определить такими методами, как гель-фильтрация, электрофорез в электрофорезе, ультрацентрифугирование или измерение вязкости.
Классификация белков :Белки классифицируются на основе:
(1) Их растворимость и
(2) Их структурная сложность.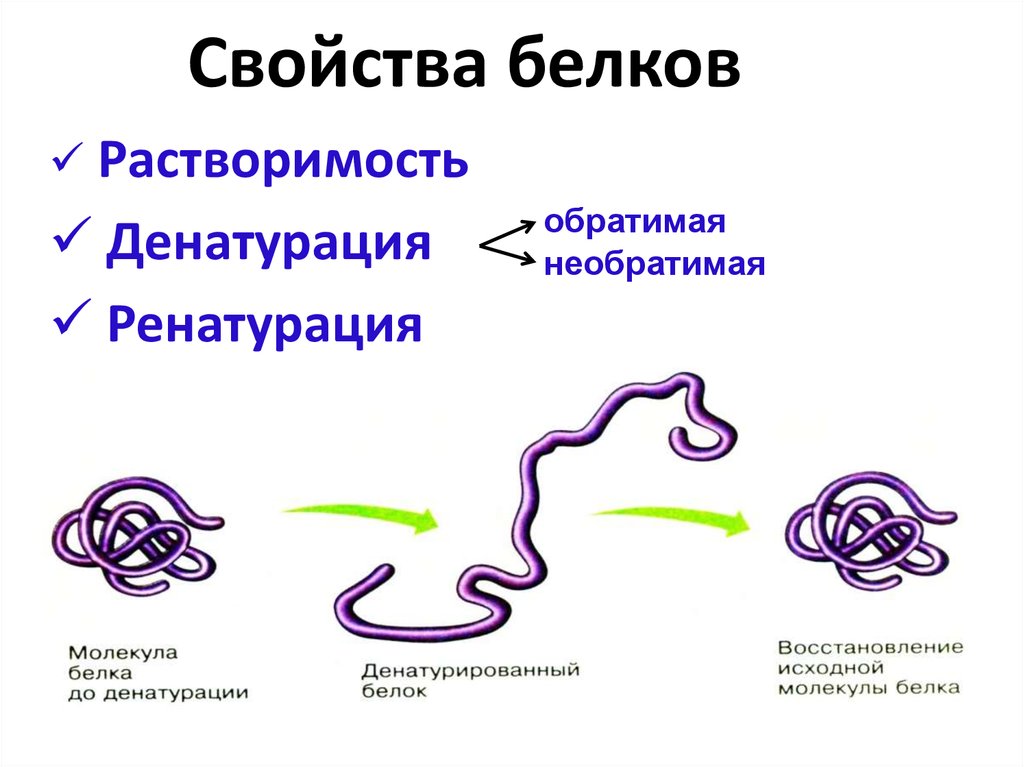
В зависимости от растворимости в воде белки подразделяются на:
1. Волокнистые белки:
Нерастворимы в воде. К ним относятся структурные белки. Они выполняют поддерживающую функцию (например, коллаген) и/или защитную функцию (например, кератин и фибрин волос).
2. Глобулярные белки:
Они растворимы в воде. К ним относятся функциональные белки, например ферменты, гемоглобин и т. д.
B. Классификация по сложности конструкции:В зависимости от сложности конструкции они подразделяются на:
(1) Простой
(2) конъюгированные и
(3) Производные белки.
1. Простые белки:
Белки, состоящие только из аминокислот, известны как простые белки.
Они далее подразделяются на:
(а) Альбумины:
Они растворимы в воде, коагулируют при нагревании и осаждаются при полном насыщении сульфатом аммония, например, сывороточный альбумин, лактальбумин и яичный альбумин.
(б) Глобулины:
Они нерастворимы в воде, но растворимы в разбавленных растворах солей. Они коагулируют при нагревании и осаждаются при половинном насыщении сульфатом аммония, например, сывороточный глобулин и овоглобулин.
(c) Глютелины:
Нерастворимы в воде и нейтральных растворителях. Растворим в разбавленных кислотах и щелочах. Они коагулируют под действием тепла, например глютелин пшеницы.
(г) Проламины:
Водонерастворимые, но растворимые в 70% спирте, например, глиадин пшеницы, белки кукурузы, ячменя и т. д.
(e) Истории:
Водорастворимый, основной по своей природе из-за присутствия аргинина и лизина, обнаруженный в ядре. Они помогают в упаковке ДНК в клетке. Они образуют белковую часть нуклеопротеина.
(f) Протамины:
Водорастворимый, основной по своей природе, не коагулируемый при нагревании. Найден в сперматозоидах, следовательно, является компонентом нуклеопротеина спермы.
(г) Глобина:
Они растворимы в воде, не коагулируют при нагревании. например, глобин гемоглобина.
(h) Альбуминоиды или склеропротеины:
Нерастворим во всех нейтральных растворителях, разбавленных кислотах или щелочах, например, кератин волос и белки костей и хрящей.
2. Конъюгированные белки:
Белки, состоящие из аминокислот и неаминокислотного/белкового вещества, называемого простетической группой, известны как конъюгированные белки.
Различные типы конъюгированных белков:
РЕКЛАМА:
(а) Хромопротеины:
Здесь небелковая часть представляет собой окрашенное соединение в дополнение к белковой части. Бывший. Гемоглобин имеет гем в качестве простетической группы, а цитохромы также имеют гем.
(б) Нуклеопротеины:
Эти белки связаны с нуклеиновыми кислотами, например, хроматином (гистоны + нуклеиновые кислоты).


 д.
д. Они мигрируют в электрическом поле, и направление миграции зависит от суммарного заряда, которым обладает молекула. На чистый заряд влияет значение pH. Каждый белок имеет фиксированное значение изоэлектрической точки (pl), при которой он будет двигаться в электрическом поле.
Они мигрируют в электрическом поле, и направление миграции зависит от суммарного заряда, которым обладает молекула. На чистый заряд влияет значение pH. Каждый белок имеет фиксированное значение изоэлектрической точки (pl), при которой он будет двигаться в электрическом поле.
 Реакция с азотистой кислотой (реакция Ван Слайка): Аминокислоты реагируют с HNO2 с выделением газообразного N2 и образованием соответствующих α-гидроксикислот.
Реакция с азотистой кислотой (реакция Ван Слайка): Аминокислоты реагируют с HNO2 с выделением газообразного N2 и образованием соответствующих α-гидроксикислот.  Тест Паули
Тест Паули