Пример белка – Простые и сложные белки. Строение, функции, свойства, характеристика, примеры сложных белков
Простые белки — Википедия
Материал из Википедии — свободной энциклопедии
Просты́е белки́ — белки, которые построены из остатков α-аминокислот и при гидролизе распадаются только на аминокислоты.
Простые белки по растворимости в воде и солевых растворах условно подразделяются на несколько групп: протамины, гистоны, альбумины, глобулины, проламины, глютелины.
До 80-х годов XX века в научной литературе на русском языке простые белки часто обозначались термином «протеины». Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные. Глобулярные белки отличаются шарообразной формой молекулы (эллипсоид вращения), растворимы в воде и в разбавленных солевых растворах. Хорошая растворимость объясняется локализацией на поверхности глобулы заряженных аминокислотных остатков, окруженных гидратной оболочкой, что обеспечивает хороший контакт с растворителем. К этой группе относятся все ферменты и большинство других биологически активных белков, исключая структурные.
Среди глобулярных белков можно выделить:
- альбумины— растворимы в воде в широком интервале рН (от 4 до 8,5), осаждаются 70-100%-ным раствором сульфата аммония;
- полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
- гистоны— низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
- протамины отличаются еще более высоким содержанием аргинина (до 85 %), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
- проламины характеризуются высоким содержанием глутаминовой кислоты (30-45 %) и пролина (до 15 %), нерастворимы в воде, растворяются в 50-90 % этаноле;
- глутелины содержат около 45 % глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины).
Что такое белки, какой у них состав, зачем они нужны? :: SYL.ru
О том, что такое белки, сейчас знает практически каждый из школьных уроков биологии. Они выполняют множество функций в клетке живого существа.
Что такое белки?
Это сложные органические соединения. Они состоят из аминокислот, которых всего существует 20, однако, соединив их в разной последовательности, можно получить миллионы разнообразных химических веществ.
Структура белков
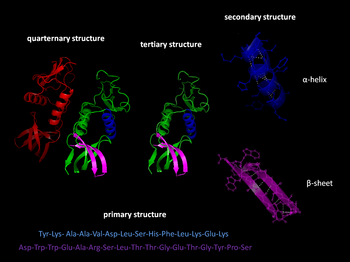
Когда мы уже знаем, что такое белки, можно подробнее рассмотреть их строение. Существует первичная, вторичная, третичная и четвертичная структура такого рода веществ.
Первичная структура
Это цепь, в которой аминокислоты соединены в нужном порядке. Это чередование и определяет вид белка. Для каждого вещества данного класса оно индивидуально. От первичной структуры во многом зависят также физические и химические свойства того или иного белка.
Вторичная структура
Это пространственная форма, которую принимает полипептидная цепь за счет образования водородных связей между карбоксильными группами и имино-группами. Существует два наиболее распространенных ее типа: альфа-спираль и бета-структура, имеющая лентообразный вид. Первая формируется вследствие возникновения связей между молекулами одной и той же полипептидной цепи, вторая — между двумя или более расположенными параллельно цепями. Однако также возможно возникновение бета-структуры и в пределах одного полимера — в том случае, когда определенные его фрагменты повернуты на 180 градусов.

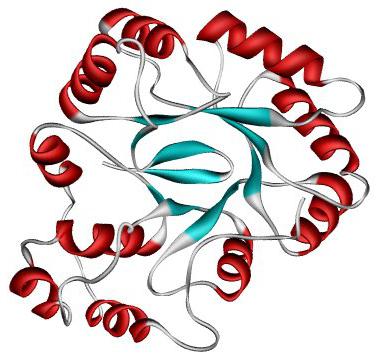
Третичная структура
Это чередование и расположение относительно друг друга в пространстве участков альфа-спирали, простых полипептидных цепей и бета-структур.
Четвертичная структура
Ее также существует два вида: глобулярная и фибриллярная. Такая структура формируется за счет электростатических взаимодействий и водородных связей. Глобулярная имеет форму небольшого клубка, а фибриллярная — нити. Примерами белков с четвертичной структурой первого типа могут служить альбумин, инсулин, иммуноглобулин и т. д.; фибриллярных — фиброин, кератин, коллаген и другие. Есть и еще более сложные по строению белки, к примеру, миозин, содержащийся в мышечных тканях, он имеет стержень фибриллярной формы, на котором расположены две глобулярные головки.
Химический состав белков
Аминокислотный состав белков может быть представлен двадцатью аминокислотами, которые комбинируются в различном порядке и количестве.
Это глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, лизин, аргинин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, фенилаланин, тирозин, триптофан, гистидин и пролин. Среди них есть незаменимые, то есть те, которые организм человека не в состоянии вырабатывать самостоятельно. Таких аминокислот насчитывается 8 для взрослых и еще 2 для детей: лейцин, изолейцин, валин, метионин, лизин, триптофан, фенилаланин, треонин, а также гистидин и аргинин.
Примеры белков с разной структурой
Ярким представителем глобулярных белков является альбумин. Его третичная структура состоит из альфа-спиралей, которые соединяются одиночными полипептидными цепочками.
Первичная же образуется такими аминокислотами, как аспаргиновая кислота, аланин, цистеин и глицин. Данный белок находится в плазме крови и выполняет функцию транспорта определенных веществ. Из фибриллярных можно выделить фиброин и коллаген. Третичная структура первого представляет собой вещество из бета-структур, которые соединены одиночными полипептидными цепочками. Сама цепь представляет собой чередование аланина, глицина, цистеина и серина. Данное химическое соединение является основным компонентом паутины и шелка, а также перьев птиц.
Что такое денатурация?
Это процесс разрушения сперва четвертичной, затем третичной и вторичной структур белка. Белок, с которым это случилось, уже не может выполнять свои функции и теряет основные физические и химические свойства. Такой процесс происходит в основном из-за воздействия высоких температур или агрессивных химических веществ. К примеру, при температуре выше сорока градусов Цельсия начинает денатурировать гемоглобин, переносящий кислород по крови организмов. Вот почему для человека опасно столь сильное повышение температуры.
Функции белков
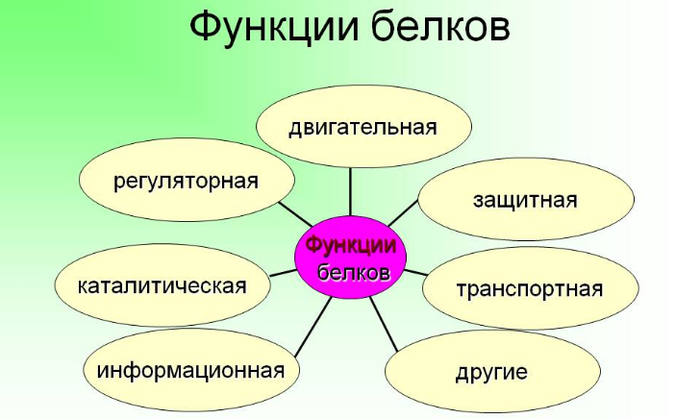
Узнав о том, что такое белки, можно обратить внимание на роль этих веществ в жизни клетки и всего организма в целом. Они выполняют девять основных функций. Первая — пластическая. Они являются компонентами многих структур живого организма и служат в качестве строительного материала для клетки. Вторая — транспортная. Белки способны переносить вещества, примером веществ данного назначения являются альбумин, гемоглобин, а также разнообразные белки-транспортеры, находящиеся на плазматической мембране клетки, каждый из которых пропускает только определенное вещество в цитоплазму из окружающей среды. Третья функция — защитная. Ее выполняют иммуноглобулины, которые являются частью иммунной системы, и коллаген, являющийся основным компонентом кожного покрова. Также белки в организме человека и других организмов выполняют регуляторную функцию, так как существует некоторое количество гормонов, представленных такого рода веществами, к примеру, как инсулин. Еще одна роль, выполняемая этими химическими соединениями, — сигнальная. Данные вещества передают электрические импульсы из клетки в клетку. Шестая функция — двигательная. Яркими представителями белков, выполняющих ее, являются актин и миозин, которые способны сокращаться (они находятся в мышцах). Такие вещества могут также служить запасными, однако в таких целях они используются довольно редко, в основном это белки, которые есть в молоке. Они выполняют еще и каталитическую функцию — в природе есть ферменты белковой природы. И последняя функция— рецепторная. Существует группа белков, которые частично денатурируют под воздействием того или иного фактора, давая таким образом сигнал всей клетке, которая передает его дальше.
Структура белков — Википедия
Материал из Википедии — свободной энциклопедии
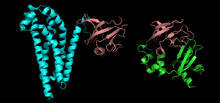
Структура белков — расположение атомов молекулы белка в трёхмерном пространстве. Белки являются полимерами — полипептидами, последовательностями, составленными из мономеров — различных L-α-аминокислот. Обычно белок, состоящий менее чем из 40 аминокислот, называют пептидом[1]. Для того, чтобы осуществлять свои биологические функции, белки сворачиваются в одну или несколько особых пространственных конфигураций, обусловленных рядом нековалентных взаимодействий, таких, как водородные связи, ионные связи, силы Ван-дер-Ваальса. Для понимания того, как функционируют белки на молекулярном уровне, необходимо определить их трёхмерную структуру.
 Структура белков, от первичной к четвертичной.
Структура белков, от первичной к четвертичной.Существуют четыре уровня структуры белков.
Аминокислотные остатки[править | править код]
Первичная структура[править | править код]
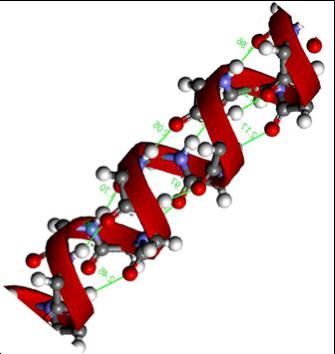
Вторичная структура[править | править код]
 An alpha-helix with hydrogen bonds (yellow dots)
An alpha-helix with hydrogen bonds (yellow dots)Третичная структура белков[править | править код]
Четвертичная структура белков[править | править код]
Домены, мотивы и свёртки в структурах белков[править | править код]
Структурный домен[править | править код]
Структурные мотивы и последовательности[править | править код]
Супервторичная структура[править | править код]
Белковые свёртки[править | править код]
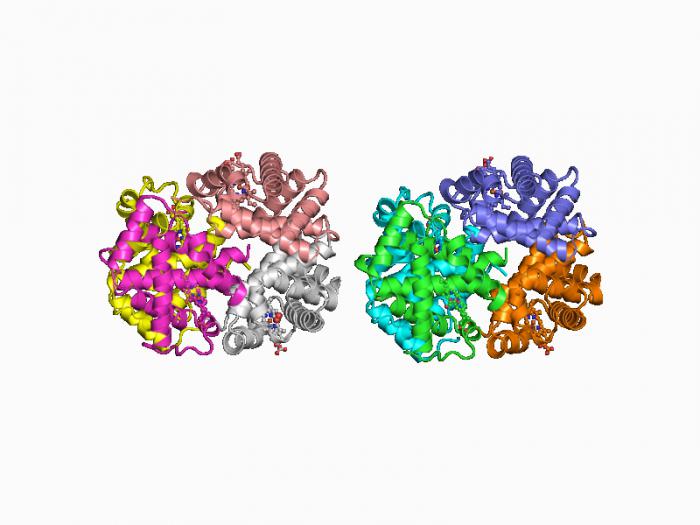
 Примеры структур белков из PDB
Примеры структур белков из PDBСложные белки — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 августа 2016; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 августа 2016; проверки требуют 3 правки.

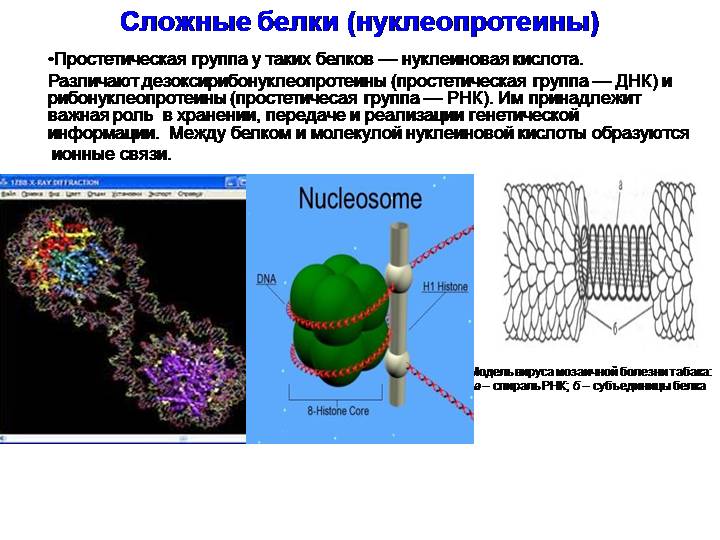
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
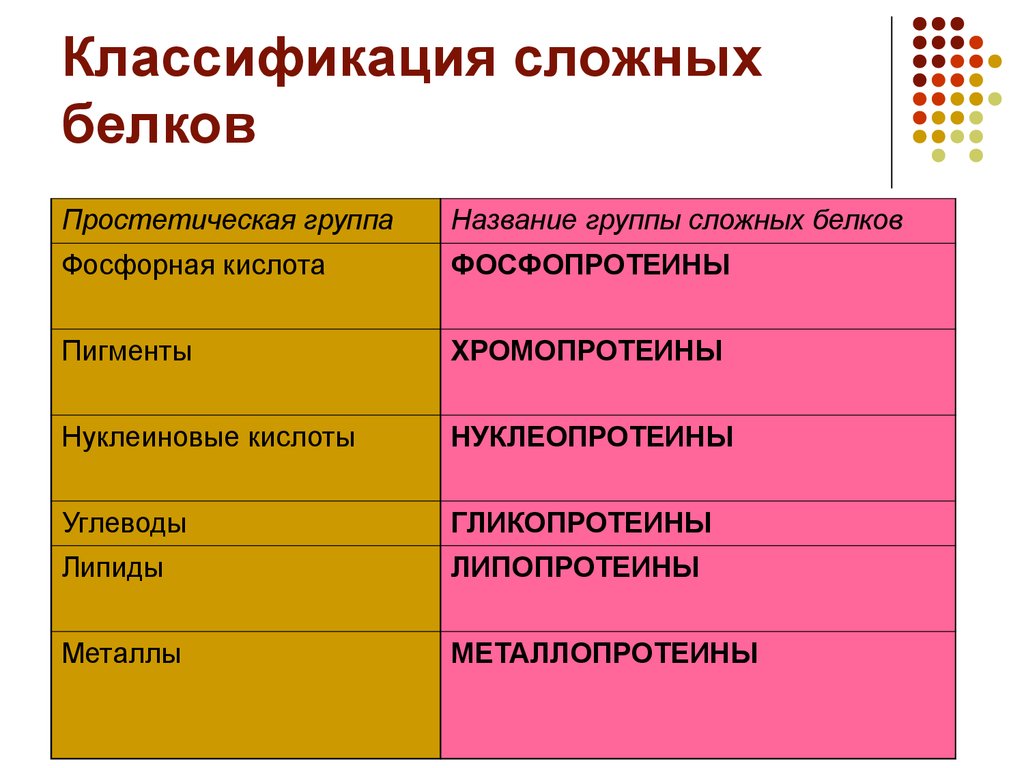
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы[1]:
- Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
- Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
- Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
- Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
- Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока[3]:
- Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлосодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
характеристика, классификация, строение и функции
Белки — это незаменимые и важнейшие компоненты, которые входят в состав продуктов питания. На сегодняшний день ученые продолжают активно изучать их роль для человеческого организма, но уже установлено, что благодаря данным элементам происходит вещественный обмен. Также белки улучшают способность к росту мышц и нормализуют работу нервной системы. Они входят в структуру клеток и являются жизненно важными компонентами для организма.
Краткая история открытия сложных белков
Целенаправленно изучать функции и строение сложных белков ученые начали во второй половине 18 века, а французский химик Антуан Франсуа де Фуркруа в результате научных экспериментов получил такие макроэлементы, как глютен, альбумин и фибрин. Сложные белки были выделены учеными в отдельную молекулярную группу.
Сложныке белки
Что касается первой модели химического строения белков, то она была изобретена в 1838 году, а предложил ее Мулдер, основываясь на теории радикалов. До 1850 года данная модель считалась общепризнанной, а в 1852 г. белки стали называться протеинами. Во второй половине 19-го века специалисты приступили к изучению аминокислот, из которых состоят протеины. В 1895 г. немецким ученым Альбрехтом Косселем была выдвинута теория, в которой он утверждал, что аминокислоты — это основные структурные элементы сложных белков.
Обратите внимание! Классы сложных белков в биохимии являются высокомолекулярными органическими веществами. В состав молекулы протеина входят сотни аминокислот, которые представлены цепочкой пептидной связи.
Сложные белки: общая характеристика, классификация
Сложные белки представлены двухкомпонентными макроэлементами, которые состоят из небелковых веществ (простетической группы) и простого протеина (пептидных цепей). В процессе их гидролиза начинается активное деление продуктов распада, небелковой части и различных аминокислот. К группе сложных белков относится множество различных макроэлементов, наиболее популярными из которых являются:
- хромопротеины, объединенные простетическим компонентом и его окрашенностью. Данный класс состоит из флавопротеидов, гемовых белков и хлорофиллов;
- нуклеопротеиды, которые представлены сложными белками, характеризующимися нековалентными связями нуклеиновых кислот. Наиболее популярным является компонент хромосом — хроматин;
- фосфопротеиды, состоящие из соединенных остатков фосфорной кислоты. К ним относят казеин, являющийся сложным протеином творога;
- гликопротеины — молекулы данной группы белков отличаются наличием углеводного остатка в составе. Популярные гликопротеины представлены иммуноглобулинами, структура которых содержит полисахариды;
- липопротеиды, в составе которых содержится липидный компонент. Наибольшей популярностью пользуются аполипопротеины — макроэлементы, обеспечивающие функционирование регулярной транспортировки липидов.
Отдельная группа сложных белков представлена металлопротеинами, в состав которых входят ионы металлов. Микроэлементы марганца, железа, меди или любого другого металла связаны между собой донорно-акцепторным взаимодействием. Данная группа не имеет гемовых белков, содержащих в своем составе профириновое кольцо с железом, к примеру, хлорофилл.
Сложныке белки классификация
Обратите внимание! Гликопротеины очень важны для человеческого организма. Из данных макроэлементов построены клеточные стенки, а также хрящевая и костная соединительная ткань. Также гликопротеины обеспечивают транспортировку ионов в кровь через клеточную мембрану.
Характеристика небелковых групп, входящих в состав сложных белков
В большинстве случаев, небелковая группа протеогликанов состоит из больших углеводных цепей, в которых периодически повторяются дисахаридные остатки, представлены аминосахаром или уроновой кислотой. В зависимости от того, какую структуру имеют углеводные цепи, можно выделить их различные типы. Распространенным гликозаминогликаном является гепарин и гиалуроновая кислота, которая активно применяется в косметологических целях.
Обратите внимание! Что касается нуклеопротеинов, то они отвечают за регуляцию и хранение генетического материала, а также работу рибосом, от которых зависит процесс синтеза белка. Важной функциональной ролью отличается фосфатная группа, потому что практически все сложные протеины с ней связаны. В клетках фосфатной группы регулярно происходит дефосфорилирование и фосфорилирование, что, в свою очередь, оптимизирует работу белков.
Стоит заметить, что небелковые группы, из которых состоят сложные белки, определяют степень их термопластичности, растворимости, а также изменяют заряд. К примеру, таким эффектом отличаются моносахариды и фосфорная кислота. Сложный макроэлемент состоит из углеводной части, которая предотвращает разрушение из-за процесса гидролиза, а также влияет на сортировку и секрецию молекул, проникающих через клеточную мембрану. Белковые каналы для транспортировки гидрофобных соединений можно классифицировать с помощью липидных фрагментов.
Обратите внимание! Функции и структура небелковых элементов зависит от того, какой тип у простетической группы. К примеру, железосодержащий гем в гемоглобине способствует связыванию углекислого газа и кислорода.
Значение белков для организма человека
Из белков состоят структурные элементы клеток организма, которые способствуют обновлению любых тканей и росту. В больших объемах протеин содержится в мышцах (около 45-50%), в хрящах и костях — около 15-20%, а остальные 15-20% приходятся на кожу. Чтобы организм нормально функционировал, человеку необходимо съедать не менее 1 г чистого протеина на один кг живого веса в сутки.
Если организм будет испытывать нехватку этих веществ, человек начнет страдать от белкового голодания. С помощью различных групп сложных белков в организме происходят метаболические процессы, а дефицит таких макроэлементов равен полному голоданию. Первыми симптомами того, что человеку недостает протеинов, является:
- резкая потеря веса;
- слабость в теле, ухудшение общего состояния;
- отказ от приема пищи;
- у детей приостанавливается рост и замедляется умственное развитие;
- У взрослых людей нарушается гормональный фон.
Если показатели нехватки протеинов достигли критической отметки, это может привести к летальному исходу. Стоит заметить, что протеины животного происхождения усваиваются желудком лучше всего. К таким продуктам можно отнести рыбу и морепродукты, молоко, кефир, куриное мясо и перепелиные яйца.
С опасностью белкового голодания могут столкнуться вегетарианцы, поэтому им нужно очень внимательно следить за количеством потребляемых протеинов. Опытные диетологи утверждают, что восполнить недостаток животной пищи в ежедневном рационе можно с помощью бобовых и злаковых культур, свежих овощей и грибов.
Люди, ведущие здоровый образ жизни, используют сложные макроэлементы в целях наращивания мышечной массы, а также для повышения выносливости организма и быстрого восстановления после физических нагрузок. Приверженцами принципа протеиновых диет, в большинстве случаев, являются бодибилдеры, но белок рекомендуется употреблять в больших количествах даже при минимальных физических нагрузках.
Значение белков для организма человека
Основная особенность спортивного питания — специальные протеиновые добавки. Лучше всего организмом усваивается яичный белок, а с помощью коллагенового протеина восстанавливается мышечная ткань, сухожилия и связки. Стоит заметить, что за короткий промежуток времени способен расщепляться сывороточный протеин. Чтобы белковые добавки хорошо усвоились в желудке, их рекомендуется принимать на ночь. Категорически запрещено и неверно употреблять протеины перед физическими нагрузками.
Перед тем, как пересматривать рацион и определять норму суточного потребления макроэлементов, рекомендуется проконсультироваться с квалифицированным диетологом, который способен объяснить все нюансы. Стоит помнить, что организм нуждается в достаточном количестве протеинов, желательно, чтобы это было 50% белков животного происхождения и 50% растительного.
Простые и сложные белки. Строение, функции, свойства, характеристика, примеры сложных белков
Одно из определений жизни звучит следующим образом: «Жизнь есть способ существования белковых тел». На нашей планете все без исключения организмы содержат такие органические вещества, как протеины. В данной статье будут описаны простые и сложные белки, определены различия в молекулярном строении, а также рассмотрены их функции в клетке.
Что такое белки
С точки зрения биохимии – это высокомолекулярные органические полимеры, мономерами которых являются 20 видов различных аминокислот. Они соединяются между собой ковалентными химическими связями, иначе называемые пептидными. Так как мономеры белка являются амфотерными соединениями, они содержат как аминогруппу, так и карбоксильную функциональную группы. Химическая связь СО-NH возникает между ними.
Если полипептид состоит из остатков аминокислотных звеньев, он образует простой белок. Молекулы полимера, дополнительно содержащие ионы металлов, витамины, нуклеотиды, углеводы – это сложные белки. Далее мы рассмотрим пространственное строение полипептидов.
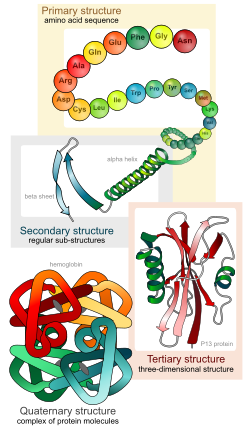
Уровни организации белковых молекул
Они представлены четырьмя различными конфигурациями. Первая структура – линейная, она наиболее проста и имеет вид полипептидной цепи, во время её спирализации происходит образование дополнительных водородных связей. Они стабилизируют спираль, которая называется вторичной структурой. Третичный уровень организации имеют простые и сложные белки, большинство растительных и животных клеток. Последняя конфигурация – четвертичная, возникает при взаимодействии нескольких молекул нативной структуры, объединенных коферментами, именно такое строение имеют сложные белки, выполняющие в организме разнообразные функции.
Разнообразие простых белков
Эта группа полипептидов немногочисленна. Их молекулы состоят только из аминокислотных остатков. К протеинам относятся, например, гистоны и глобулины. Первые представлены в структуре ядра и объединены с молекулами ДНК. Вторая группа – глобулины – считаются главными компонентами плазмы крови. Такой белок, как гамма-глобулин, выполняет функции иммунной защиты и является антителом. Эти соединения могут образовывать комплексы, в состав которых входят сложные углеводы и белки. Такие фибриллярные простые белки, как коллаген и эластин, входят в состав соединительной ткани, хрящей, сухожилий, кожи. Их главные функции – строительная и опорная.
Белок тубулин входит в состав микротрубочек, которые являются компонентами ресничек и жгутиков таких одноклеточных организмов, как инфузории, эвглены, паразитические жгутиконосцы. Этот же белок входит в состав многоклеточных организмов (жгутики сперматозоидов, реснички яйцеклеток, реснитчатый эпителий тонкого кишечника).
Белок альбумин выполняет запасающую функцию (например, белок куриных яиц). В эндосперме семян злаковых растений – ржи, риса, пшеницы – накапливаются молекулы белков. Они называются клеточными включениями. Эти вещества использует зародыш семени в начале своего развития. Кроме того, высокое содержание белка в зерновках пшеницы является очень важным показателем качества муки. Хлеб, испеченный из муки богатой клейковиной, имеет высокие вкусовые качества и более полезен. Клейковину содержат так называемые твердые сорта пшеницы. В плазме крови глубоководных рыб содержатся белки, препятствующие их гибели от холода. Они обладают свойствами антифриза, предотвращая гибель организма при низких температурах воды. С другой стороны, в составе клеточной стенки термофильных бактерий, живущих в геотермальных источниках, содержатся белки, способные сохранять свою природную конфигурацию (третичную или четвертичную структуру) и не денатурировать в интервале температур от +50 до + 90 °С.
Протеиды
Это сложные белки, для которых характерно большое разнообразие в связи с различными функциями, выполняемыми ими. Как отмечалось ранее, эта группа полипептидов, кроме белковой части, содержит простетическую группу. Под влиянием различных факторов, таких как высокая температура, соли тяжелых металлов, концентрированные щелочи и кислоты, сложные белки могут изменять свою пространственную форму, упрощая её. Это явление называется денатурацией. Строение сложных белков нарушается, водородные связи рвутся, а молекулы теряют свои свойства и функции. Как правило, денатурация носит необратимый характер. Но у некоторых полипептидов, выполняющих каталитическую, двигательную и сигнальную функции, возможна ренатурация – восстановление природной структуры протеида.

Если действие дестабилизирующего фактора происходит продолжительное время, белковая молекула разрушается полностью. Это приводит к разрыву пептидных связей первичной структуры. Восстановить протеин и его функции уже невозможно. Такое явление называется деструкцией. Примером может служить варка куриных яиц: жидкий белок – альбумин, находящийся в третичной структуре, полностью разрушается.
Биосинтез белков
Еще раз напомним, что в состав полипептидов живых организмов входит 20 аминокислот, среди которых есть незаменимые. Это лизин, метионин, фенилаланин и т. д. Они поступают в кровь из отделов тонкой кишки после расщепления в ней белковых продуктов. Чтобы синтезировать заменимые аминокислоты (аланин, пролин, серин), грибы и животные используют азотсодержащие соединения. Растения, являясь автотрофами, самостоятельно образуют все необходимые составные мономеры, представляющие сложные белки. Для этого в реакциях ассимиляции у них используются нитраты, аммиак или свободный азот. У микроорганизмов некоторые виды обеспечивают себя полным аминокислотным набором, а у других синтезируются только некоторые мономеры. Этапы биосинтеза белков протекают в клетках всех живых организмов. В ядре происходит транскрипция, а в цитоплазме клетки – трансляция.
Первый этап – синтез предшественника иРНК происходит при участии фермента РНК-полимеразы. Он разрывает водородные связи между цепями ДНК, и на одной из них по принципу комплиментарности собирает молекулу пре-иРНК. Она подвергается слайсингу, то есть созревает, и далее выходит из ядра в цитоплазму, образуя матричную рибонуклеиновую кислоту.
Для осуществления второго этапа необходимо наличие специальных органелл – рибосом, а также молекул информационных и транспортных рибонуклеиновых кислот. Еще одним важным условием является наличие молекул АТФ, так как реакции пластического обмена, к которым принадлежит биосинтез белков, происходят с поглощением энергии.
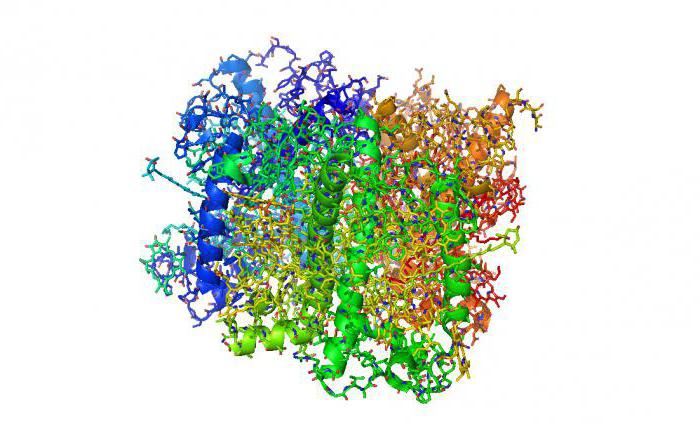
Ферменты, их строение и функции
Это большая группа белков (около 2000), выполняющих роль веществ, влияющих на скорость протекания биохимических реакций в клетках. Они могут быть простыми (трепсин, пепсин) или сложными. Сложные белки состоят из кофермента и апофермента. Специфичность самого белка относительно соединений, на которые он воздействует, определяет кофермент, а активность протеидов наблюдается только в том случае, когда белковый компонент связан с апоферментом. Каталитическая активность фермента зависит не от всей молекулы, а только от активного центра. Его строение соответствует химической структуре катализируемого вещества по принципу «ключ-замок», поэтому действие ферментов строго специфично. Функции сложных белков заключаются как в участии в метаболических процессах, так и в использовании их в качестве акцепторов.
Классы сложных белков
Они были разработаны биохимиками, исходя из 3 критериев: физико-химических свойств, функциональных особенностей и специфики структурных признаков протеидов. К первой группе относятся полипептиды, различающиеся электрохимическими свойствами. Они делятся на основные, нейтральные и кислые. По отношению к воде белки могут быть гидрофильными, амфифильными и гидрофобными. Ко второй группе относятся ферменты, которые были рассмотрены нами ранее. Третья группа включает полипептиды, различающиеся химическим составом простетических групп (это хромопротеиды, нуклеопротеиды, металлопротеиды).
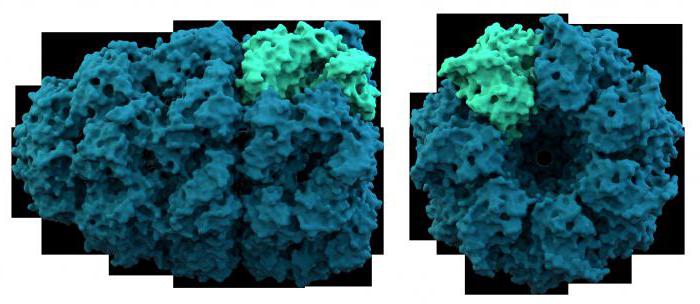
Рассмотрим свойства сложных белков более подробно. Так, например, кислый белок, входящий в состав рибосом, содержит 120 аминокислот и является универсальным. Он находится в белоксинтезирующих органеллах, как прокариотических, так и эукариотических клеток. Еще один представитель этой группы – белок S-100, состоит из двух цепей, связанных ионом кальция. Он входит в состав нейронов и нейроглии – опорной ткани нервной системы. Общее свойство всех кислых белков – это высокое содержание двухосновных карбоновых кислот: глутаминовой и аспарагиновой. К щелочным белкам относятся гистоны – протеины, входящие в состав нуклеиновых кислот ДНК и РНК. Особенностью их химического состава является большое количество лизина и аргинина. Гистоны вместе с хроматином ядра образуют хромосомы – важнейшие структуры наследственности клеток. Эти белки участвуют в процессах транскрипции и трансляции. Амфифильные протеины широко представлены в клеточных мембранах, образуя липопротеиновый бислой. Таким образом, изучив выше рассмотренные группы сложных белков, мы убедились в том, что их физико-химические свойства обусловлены строением белкового компонента и простетических групп.
Некоторые сложные белки клеточных мембран способны узнавать различные химические соединения, например антигены, и реагировать на них. Это сигнальная функция протеидов, она очень важна для процессов избирательного поглощения веществ, поступающих из внешней среды, и для её защиты.
Гликопротеины и протеогликаны
Они являются сложными белками, отличающимися между собой биохимическим составом простетических групп. Если химические связи между белковым компонентом и углеводной частью – ковалентно-гликозидные, такие вещества называются гликопротеинами. Апофермент у них представлен молекулами моно- и олигосахаридов, примерами таких белков служат протромбин, фибриноген (белки, участвующие в свертывании крови). Кортико- и гонадотропные гормоны, интерфероны, мембранные ферменты также являются гликопротеинами. В молекулах протеогликанов белковая часть составляет всего 5%, остальное приходится на простетическую группу (гетерополитсахарид). Обе части соединены гликозидной связью группы ОН-треонина и аргинина и группы NH₂-глутамина и лизина. Молекулы протеогликанов играют очень важную роль в водно-солевом обмене клетки. Ниже представлена таблица сложных белков, изученных нами.
| Гликопротеины | Протеогликаны |
| Структурные компоненты простетических групп | |
| 1. Моносахариды (глюкоза, галактоза, манноза) | 1. Гиалуроновая кислота |
| 2. Олигосахариды (мальтоза, лактоза, сахароза) | 2. Хондроитиновая кислота. |
| 3. Ацетилированные аминопроизводные моносахаридов | 3. Гепарин |
| 4. Дезоксисахариды | |
| 5. Нейраминовые и сиаловые кислоты | |
Металлопротеиды
Эти вещества содержат в составе своих молекул ионы одного или нескольких металлов. Рассмотрим примеры сложных белков, относящихся к вышеназванной группе. Это прежде всего ферменты, такие как цитохромоксидаза. Она располагается на кристах митохондрий и активизирует синтез АТФ. Феррин и трансферрин – протеиды, содержащие ионы железа. Первый депонирует их в клетках, а второй является транспортным белком крови. Еще один металлопротеид – альфаамелаза, она содержит ионы кальция, входит в состав слюны и сока поджелудочной железы, участвуя в расщеплении крахмала. Гемоглобин является как металлопротеидом, так и хромопротеидом. Он выполняет функции транспортного белка, перенося кислород. В результате образуется соединение оксигемоглобин. При вдыхании монооксида карбона, иначе называемого угарным газом, его молекулы образуют с гемоглобином эритроцитов очень стойкое соединение. Оно быстро разносится по органам и тканям, вызывая отравление клеток. В итоге при длительном вдыхании угарного газа наступает смерть от удушья. Гемоглобин частично переносит и углекислый газ, образовавшийся в процессах катаболизма. С током крови диоксид карбона поступает в легкие и почки, а из них – во внешнюю среду. У некоторых ракообразных и моллюсков транспортным белком, переносящим кислород, служит гемоцианин. Вместо железа он содержит ионы меди, поэтому кровь животных имеет не красный, а голубой цвет.
Функции хлорофилла
Как мы уже упоминали ранее, сложные белки могут образовывать комплексы с пигментами – окрашенными органическими веществами. Их цвет зависит от хромоформных групп, которые избирательно поглощают определённые спектры солнечного света. В клетках растений есть зеленые пластиды – хлоропласты, содержащие пигмент хлорофилл. В его состав входят атомы магния и многоатомный спирт фитол. Они связаны с белковыми молекулами, а сами хлоропласты содержат тилакоиды (пластинки), или мембраны, связанные в стопки – граны. В них находятся фотосинтезирующие пигменты – хлорофиллы – и дополнительные каротиноиды. Здесь же находятся все ферменты, используемые в фотосинтетических реакциях. Таким образом, хромопротеиды, к которым относится и хлорофилл, выполняют важнейшие функции в обмене веществ, а именно в реакциях ассимиляции и диссимиляции.
Вирусные белки
Их содержат представители неклеточных форм жизни, входящие в Царство Вира. Вирусы не имеют собственного белоксинтезирующего аппарата. Нуклеиновые кислоты, ДНК или РНК, могут вызывать синтез собственных частиц самой клеткой, инфицированной вирусом. Простые вирусы состоят только из белковых молекул, компактно собранных в структуры спиральной или многогранной формы, как, например, вирус табачной мозаики. Сложные вирусы имеют дополнительную мембрану, составляющую часть плазматической оболочки клетки-хозяина. В неё могут входить гликопротеиды (вирус гепатита В, вирус оспы). Основная функция гликопротеидов — это узнавание специфических рецепторов на мембране клетки хозяина. В состав дополнительных вирусных оболочек входят и белки-ферменты, обеспечивающие редупликацию ДНК или транскрипцию РНК. Исходя из вышесказанного, можно сделать следующий вывод: белки оболочек вирусных частиц имеют специфическое строение, зависящее от мембранных белков клетки-хозяина.
В данной статье нами была дана характеристика сложных белков, изучены их строение и функции в клетках различных живых организмов.
Биология, 6 класс Что такое белки? Пожалуйста, напишите кратко, википедия у меня самого есть…
Ну и чем тебя там ответ не устраивает? Основополагающие кирпичики жизни
Белки – это материал для построения клеток, тканей и органов, для синтеза ферментов, пептидных гормонов, гемоглобина и т. д. Белки – это сложные высокомолекулярные природные соединения, построенные из -аминокислот. В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков. Белки подразделяют на протеины (простые белки) и протеиды (сложные белки).
Белки иначе полипептиды — высокомолекулярные природные полимеры. По составу белки делят на простые и сложные. Белки являются одной из основных функциональных структур всего живого. Уровни структуры белков: 1 — первичная; 2 — вторичная; 3 — третичная; 4 — четвертичная. <img src=”//otvet.imgsmail.ru/download/66921397_f8c3388959612ef9e276aac65efba1ba_800.jpg” data-big=”1″ data-lsrc=”//otvet.imgsmail.ru/download/66921397_f8c3388959612ef9e276aac65efba1ba_120x120.jpg”>
Белки- полимеры, мономеры, аминокислоты
