Нарушение обмена углеводов – Нарушение углеводного обмена – диагностика и лечение в медицинском центре “Андреевские больницы
Углеводный обмен — Википедия
Углеводный обмен, или метаболизм углеводов в организмах животных и человека. Метаболизм углеводов в организме человека состоит из следующих процессов:
- Расщепление в пищеварительном тракте поступающих с пищей поли- и дисахаридов до моносахаридов, дальнейшее всасывание моносахаридов из кишечника в кровь.

- Синтез и распад гликогена в тканях
 (гликогенез и гликогенолиз), прежде всего в печени.
(гликогенез и гликогенолиз), прежде всего в печени. - Гликолиз — распад глюкозы.

 в отличие от «анаэробного гликолиза»,
в отличие от «анаэробного гликолиза», завершающегося образованием молочной кислоты или лактата.
завершающегося образованием молочной кислоты или лактата. - Анаэробный путь прямого окисления глюкозы или, как его называют, пентозофосфатный путь (пентозный цикл).

- Взаимопревращение гексоз.
- Анаэробный метаболизм пирувата. Этот процесс выходит за рамки углеводного обмена, однако может рассматриваться как завершающая его стадия: окисление продукта гликолиза — пирувата.
- Глюконеогенез — образование углеводов из неуглеводных продуктов
 (пирувата, лактата, глицерина, аминокислот, липидов, белков и т. д.).
(пирувата, лактата, глицерина, аминокислот, липидов, белков и т. д.).
Углеводы входят в состав живых организмов и вместе с белками, липидами и нуклеиновыми кислотами определяют специфичность их строения и функционирования. К углеводам относят соединения, обладающие разнообразными и зачастую сильно отличающимися функциями. Углеводы участвуют во многих метаболических процессах, но прежде всего они являются основными поставщиками энергии. На долю углеводов приходится примерно 75 % массы пищевого суточного рациона и более 50 % от суточного количества необходимых калорий. Однако неправильно сводить функцию углеводов только к энергетическому обеспечению процессов жизнедеятельности организма. Следует отметить и структурную роль углеводов. Так, в виде гликозаминогликанов углеводы входят в состав межклеточного матрикса. Большое число белков (ферменты, белки-транспортёры, белки-рецепторы, гормоны) — гликопротеины, углеводная составляющая которых повышает их специфичность. Например, различия в строении олигосахаридных фрагментов клеточной оболочки эритроцитов обеспечивают групповую принадлежность крови. Из углеводов в процессе метаболизма образуется большое число органических соединений, которые служат исходными субстратами для синтеза липидов, аминокислот, нуклеотидов. Производные углеводов — глюкурониды — участвуют в детоксикации ксенобиотиков и инактивации веществ эндогенного происхождения
- Углеводы, потребляемые с пищей
-

Лактоза или молочный сахар, впервые была обнаружена в коровьем молоке, откуда и получила своё название.
-

Мальтоза или солодовый сахар, входит в состав семян зерновых культур (ячменя, ржи, пшеницы итд.).
-

Сахароза — один из самых потребляемых углеводов в мире.
Переваривание и всасывание углеводов[править | править код]
Пищеварение углеводов можно разделить на несколько этапов:
- Пищеварение, происходящее в полости рта
- Пищеварение в желудке
- Пищеварение и всасывание в тонком кишечнике.
Эпителиальные клетки кишечника способны всасывать только моносахариды. Поэтому процесс переваривания заключается в ферментативном гидролизе гликозидных связей в углеводах, имеющее олиго- или полисахаридное строение.
Переваривание углеводов в полости рта[править | править код]
В полости рта начинается расщепление крахмала (и гликогена) под действием фермента слюны — амилазы. Известны 3 вида амилаз, которые различаются главным образом по конечным продуктам их ферментативного действия:
- α-амилаза
- β-амилаза
- γ-амилаза
α-Амилаза (КФ 3.2.1.1) расщепляет в полисахаридах внутренние α-1,4-связи, поэтому её иногда называют эндоамилазой. Молекула α-амилазы содержит в своих активных центрах ионы Ca2+ необходимые для ферментативной активности. Кроме того, характерной особенностью α-амилазы животного происхождения является способность активироваться одновалентными анионами. Прежде всего Сl–.
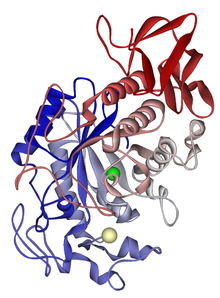 Структура α-амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.
Структура α-амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.В ротовой полости не может происходить полное расщепление крахмала, так как действие фермента на крахмал кратковременно. Кроме того, амилаза слюны не расщепляет α- 1,6-гликозидные связи (связи в местах разветвлений), поэтому крахмал переваривается лишь частично с образованием крупных фрагментов — декстринов и небольшого количества мальтозы. Следует отметить, что амилаза слюны не гидролизует гликозидные связи в дисахаридах.
Под действием β-амилазы от крахмала отщепляется дисахарид мальтоза, то есть β-амилаза является экзоамилазой. Она обнаружена у высших растений где играет важную роль в мобилизации резервного (запасного) крахмала.
γ-Амилаза отщепляет один за другим глюкозные остатки от конца полигликозидной цепочки. Различают 2 вида γ-амилаз: кислые и нейтральные, в зависимости от того в какой области pH они проявляют максимальную активность. В органах и тканях человека и млекопитающих кислая γ-амилаза локализована в лизосомах, а нейтральная — в микросомах и гиалоплазме. Амилаза слюны является α-амилазой. Под влиянием этого фермента происходят первые фазы распада крахмала (или гликогена) с образованием декстринов (в небольшом количестве образуется и мальтоза). Затем пища смешанная со слюной попадает в желудок.
Желудочный сок не содержит ферментов расщепляющие сложные углеводы (например целлюлозу). В желудке действие α-амилазы слюны прекращается так как желудочное содержимое имеет очень кислую среду (pH 1,5 — 2,5). Однако в более глубоких слоях пищевого комка, куда не сразу проникает желудочный сок, действие амилазы некоторое время продолжается и происходит расщепление полисахаридов с образованием декстринов и мальтозы. Наиболее важная фаза распада крахмала (или гликогена) протекает в двенадцатиперстной кишке под действием α-амилазы поджелудочного сока. Здесь pH возрастает до нейтральных значений, при этих условиях α-амилаза панкреатического сока обладает почти максимальной активностью. Этот фермент завершает превращение крахмала и гликогена в мальтозу, начатое амилазой слюны.
Переваривание углеводов в кишечнике[править | править код]
Расщепление крахмала и гликогена до мальтозы в кишечнике происходит под действием 3-х ферментов:
- панкреатической α-амилазы
- амило-1,6-глюкозидазы
- олиго-1,6-глюкозидазы
Образующаяся мальтоза оказывается только временным продуктом, так как она быстро гидролизуется под влиянием фермента мальтазы (α-глюкозидазы) на 2 молекулы глюкозы. Кишечный сок также содержит активную сахаразу, под действием которой образуются глюкоза и фруктоза.
Панкреатическая α-амилаза[править | править код]
В двенадцатиперстной кишке рН среды желудочного содержимого нейтрализуется, так как секрет поджелудочной железы имеет рН 7,5-8,0 и содержит гидрокарбонаты (НСО3–). С секретом поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Этот фермент гидролизует α-1,4-гликозидные связи в крахмале и декстринах.
Продукты переваривания крахмала на этом этапе — дисахарид мальтоза, содержащая 2 остатка глюкозы, связанные α-1,4-связью. Из тех остатков глюкозы, которые в молекуле крахмала находятся в местах разветвления и соединены α-1,6-гликозидной связью, образуется дисахарид изомальтоза. Кроме того, образуются олигосахариды, содержащие 3-8 остатков глюкозы, связанные α-1,4- и α-1,6-связями
α-Амилаза поджелудочной железы, так же, как α-амилаза слюны, действует как эндогликозидаза. Панкреатическая α-амилаза не расщепляет α-1,6-гликозидные связи в крахмале. Этот фермент также не гидролизует β-1,4-гликозидные связи, которыми соединены остатки глюкозы в молекуле целлюлозы. Целлюлоза, таким образом, проходит через кишечник неизменённой. Тем не менее непереваренная целлюлоза выполняет важную функцию балластного вещества, придавая пище дополнительный объём и положительно влияя на процесс переваривания. Кроме того, в толстом кишечнике целлюлоза может подвергаться действию бактериальных ферментов и частично расщепляться с образованием спиртов, органических кислот и СО
Мальтоза, изомальтоза и триозосахариды, образующиеся в верхних отделах кишечника из крахмала, — промежуточные продукты. Дальнейшее их переваривание происходит под действием специфических ферментов в тонком кишечнике. Дисахариды пищи сахароза и лактоза также гидролизуются специфическими дисахаридазами в тонком кишечнике.
Особенность переваривания углеводов в тонком кишечнике заключается в том, что активность специфических олиго- и дисахаридаз в просвете кишечника низкая. Но ферменты активно действуют на поверхности эпителиальных клеток кишечника.
Тонкий кишечник изнутри имеет форму пальцеобразных выростов — ворсинок, покрытых эпителиальными клетками. Эпителиальные клетки, в свою очередь, покрыты микроворсинками, обращёнными в просвет кишечника. Эти клетки вместе с ворсинками образуют щёточную каёмку, благодаря которой увеличивается поверхность контакта гидролитических ферментов и их субстратов в содержимом кишечника. На 1 мм2 поверхности тонкой кишки у человека приходится 80-140 млн ворсинок.
Ферменты, расщепляющие гликозидные связи в дисахаридах (дисахаридазы), образуют ферментативные комплексы, локализованные на наружной поверхности цитоплазматической мембраны энтероцитов.
Сахаразо-изомальтазный комплекс[править | править код]
Этот ферментативный комплекс состоит из двух полипептидных цепей и имеет доменное строение. Сахаразо-изомальтазный комплекс прикрепляется к мембране микроворсинок кишечника с помощью гидрофобного (трансмембранного) домена, образованного N-концевой частью полипептида. Каталитический центр выступает в просвет кишечника. Связь этого пищеварительного фермента с мембраной способствует эффективному поглощению продуктов гидролиза клеткой.
Сахаразо-изомальтазный комплекс гидролизует сахарозу и изомальтозу, расщепляя α-1,2- и α-1,6-гликозидные связи. Кроме того, оба ферментных домена имеют мальтазную и мальтотриазную активности, гидролизуя α-1,4-гликозидные связи в мальтозе и мальтотриозе (трисахарид, образующийся из крахмала). На долю сахаразо-изомальтазного комплекса приходится 80 % от всей мальтазной активности кишечника. Но несмотря на присущую ему высокую мальтазную активность, этот ферментативный комплекс назван в соответствии с основной специфичностью. К тому же сахаразная субъединица — единственный фермент в кишечнике, гидролизующий сахарозу. Изомальтазная субъединица с большей скоростью гидролизует гликозидные связи в изомальтозе, чем в мальтозе и мальтотриозе.
В тощей кишке содержание сахаразо-изомальтазного ферментативного комплекса достаточно высокое, но оно снижается в проксимальной и дистальной частях кишечника.
Гликоамилазный комплекс[править | править код]
Этот ферментативный комплекс катализирует гидролиз α-1,4-связи между глюкозными остатками в олигосахаридах, действуя с восстанавливающего конца. По механизму действия этот фермент относят к экзогликозидазам. Комплекс расщепляет также связи в мальтозе, действуя как мальтаза. В гликоамилазный комплекс входят две разные каталитические субъединицы, имеющие небольшие различия в субстратной специфичности. Гликоамилазная активность комплекса наибольшая в нижних отделах тонкого кишечника.
β-Гликозидазный комплекс (лактаза)[править | править код]
Лактаза расщепляет β-1,4-гликозидные связи между глюкозой и галактозой в лактозе.
Этот ферментативный комплекс по химическому составу является гликопротеином. Лактаза, как и другие гликозидазные комплексы, связана с щёточной каёмкой и распределена неравномерно по всему тонкому кишечнику. Активность лактазы колеблется в зависимости от возраста. Так, активность лактазы у плода особенно повышена в более поздние сроки беременности и сохраняется на высоком уровне до 5-7 летнего возраста. Затем активность фермента снижается, составляя у взрослых 10 % от уровня активности, характерного для детей.
Трегалаза[править | править код]
Трегалаза (КФ 3.2.1.28) — также гликозидазный комплекс, гидролизующий связи между мономерами в трегалозе — дисахариде, содержащемся в грибах.
Совместное действие всех перечисленных ферментов завершает переваривание пищевых олиго- и полисахаридов с образованием моносахаридов, основной из которых — глюкоза. Кроме глюкозы, из углеводов пищи также образуются фруктоза и галактоза, в меньшем количестве — манноза, ксилоза, арабиноза.
Всасывание моносахаридов в кишечнике[править | править код]
Моносахариды образовавшиеся в результате переваривания, всасываются эпителиальными клетками тощей и подвздошной кишок с помощью специальных механизмов транспорта через мембраны клеток.
Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться разными способами: путём облегчённой диффузии и активного транспорта. В случае активного транспорта глюкоза и Na+ проходят через мембраны с люминальной стороны, связываясь с разными участками белка-переносчика. При этом Na+ поступает в клетку по градиенту концентрации, и одновременно глюкоза транспортируется против градиента концентрации (вторично-активный транспорт). Следовательно, чем больше градиент Na+, тем больше поступление глюкозы в энтероциты. Если концентрация Na+ во внеклеточной жидкости уменьшается, транспорт глюкозы снижается. Градиент концентрации Na+, являющийся движущей силой активного сим-порта, создаётся работой Nа+, К+-АТФ-азы. Перенос в клетки слизистой оболочки кишечника по механизму вторично-активного транспорта характерен также для галактозы.
При разной концентрации глюкозы в просвете кишечника «работают» различные механизмы транспорта. Благодаря активному транспорту эпителиальные клетки кишечника могут поглощать глюкозу при её очень низкой концентрации в просвете кишечника. Если же концентрация глюкозы в просвете кишечника велика, то она может транспортироваться в клетку путём облегчённой диффузии. Таким же способом может всасываться и фруктоза. Следует отметить, что скорость всасывания глюкозы и галактозы гораздо выше, чем других моносахаридов.
После всасывания моносахариды (главным образом, глюкоза) покидают клетки слизистой оболочки кишечника через мембрану, обращённую к кровеносному капилляру, с помощью облегчённой диффузии. Часть глюкозы (более половины) через капилляры кишечных ворсинок попадает в кровеносную систему и по воротной вене доставляется в печень. Остальное количество глюкозы поступает в клетки других тканей.
Транспорт глюкозы из крови в клетки[править | править код]
Потребление глюкозы клетками из кровотока происходит также путём облегчённой диффузии. Следовательно, скорость трансмембранного потока глюкозы зависит только от градиента её концентрации. Исключение составляют клетки мышц и жировой ткани, где облегчённая диффузия регулируется инсулином (гормон поджелудочной железы). В отсутствие инсулина плазматическая мембрана этих клеток непроницаема для глюкозы, так как она не содержит белки-переносчики (транспортёры) глюкозы. Транспортёры глюкозы называют также рецепторами глюкозы. Например, описан транспортёр глюкозы, выделенный из эритроцитов. Это трансмембранный белок, полипептидная цепь которого построена из 492 аминокислотных остатков и имеет доменную структуру. Полярные домены белка расположены по разные стороны мембраны, гидрофобные располагаются в мембране, пересекая её несколько раз. Транспортёр имеет участок связывания глюкозы на внешней стороне мембраны. После присоединения глюкозы конформация белка изменяется, в результате чего глюкоза оказывается связанной с белком в участке, обращённом внутрь клетки. Затем глюкоза отделяется от транспортёра, переходя внутрь клетки. Считают, что способ облегчённой диффузии по сравнению с активным транспортом предотвращает транспорт ионов вместе с глюкозой, если она транспортируется по градиенту концентрации.
Глюкозные транспортёры[править | править код]
Глюкозные транспортёры или ГЛЮТ представляют собой несколько семейств мембранных белков, обнаруженных во всех тканях организма млекопитающих. На данный момент существуют несколько десятков разновидностей ГЛЮТ, они пронумерованы в соответствии с порядком их обнаружения[3].
Структура белков семейства ГЛЮТ отличается от белков, транспортирующих глюкозу через мембрану в кишечнике и почках против градиента концентрации. Описанные 4 типа ГЛЮТ имеют сходные первичную структуру и доменную организацию (все 4 типа относятся к I классу переносчиков глюкозы). ГЛЮТ-5 имеет несколько иную структуру и относится ко II классу переносчиков глюкозы.
Распределение белков-транспортёров глюкозы (ГЛЮТ)
| Типы ГЛЮТ | Локализация в органах |
|---|---|
| ГЛЮТ-1 | Преимущественно в мозге, плаценте, почках, толстом кишечнике. |
| ГЛЮТ-2 | Преимущественно в печени, почках, β-клетках островков Лангерганса, эритроцитах. |
| ГЛЮТ-3 | Во многих тканях, включая мозг, плаценту, почки. |
| ГЛЮТ-4(инсулинзависимый) | В мышцах (скелетных и сердечной), жировой ткани. Содержится в отсутствии инсулина почти полностью в цитоплазме. |
| ГЛЮТ-5 | В апикальном отделе энтероцитов тонкого кишечника. Является переносчиком фруктозы[4]. |
Все типы ГЛЮТ могут находиться как в плазматической мембране, так и в цитозольных везикулах. ГЛЮТ-4 (и в меньшей мере ГЛЮТ-1) почти полностью находятся в цитоплазме клеток. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ, к плазматической мембране, слиянию с ней и встраиванию транспортёров в мембрану. После чего возможен облегчённый транспорт глюкозы в эти клетки. После снижения концентрации инсулина в крови транспортёры глюкозы снова перемещаются в цитоплазму, и поступление глюкозы в клетку прекращается.
Перемещение глюкозы из первичной мочи в клетки почечных канальцев происходит вторично-активным транспортом, подобно тому, как это осуществляется при всасывании глюкозы из просвета кишечника в энтероциты. Благодаря этому глюкоза может поступать в клетки даже в том случае, если её концентрация в первичной моче меньше, чем в клетках. При этом глюкоза реабсорбируется из первичной мочи почти полностью (99 %).
Известны различные нарушения в работе транспортёров глюкозы. Наследственный дефект этих белков может лежать в основе инсулинонезависимого сахарного диабета В то же время причиной нарушения работы транспортёра глюкозы может быть не только дефект самого белка. Нарушения функции ГЛЮТ-4 возможны на следующих этапах:
- передача сигнала инсулина о перемещении этого транспортёра к мембране;
- перемещение транспортёра в цитоплазме;
- включение в состав мембраны;
- отшнуровывание от мембраны и т. д.
Нарушения переваривания и всасывания углеводов[править | править код]
В основе патологии переваривания и всасывания углеводов могут быть причины двух типов:
- дефекты ферментов, участвующих в гидролизе углеводов в кишечнике;
- нарушение всасывания продуктов переваривания углеводов в клетки слизистой оболочки кишечника.
В обоих случаях возникает осмотическая диарея, которую вызывают нерасщеплённые дисахариды или невсосавшиеся моносахариды. Эти невостребованные углеводы поступают в дистальные отделы кишечника, изменяя осмотическое давление содержимого кишечника. Кроме того, оставшиеся в просвете кишечника углеводы частично подвергаются ферментативному расщеплению микроорганизмами с образованием органических кислот и газов. Всё вместе приводит к притоку воды в кишечник, увеличению объёма кишечного содержимого, усилению перистальтики, спазмам и болям, а также метеоризму.
Термином «мальабсорбция» называют недостаточное всасывание переваренных продуктов углеводов. Но поскольку клинические проявления при недостаточном переваривании и всасывании сходны, то термином «мальабсорбция» называют оба вида нарушений.
Нарушение переваривания углеводов в кишечнике[править | править код]
Нарушения переваривания могут быть связаны как с недостаточной активностью отдельных дисахаридаз, так и с недостаточностью всего ферментативного комплекса, например сахаразо-изомальтазного.
Известны наследственные и приобретённые формы недостаточности активности ферментов. Симптомы врождённых форм проявляются достаточно рано, например после первых кормлений грудным молоком (при дефиците лактазы), после перехода на искусственное вскармливание или при добавлении в рацион сахара и крахмала (при дефиците ос-амилазы или специфических дисахаридаз). В случае недостаточного лечения врождённые формы патологии сопровождаются хроническим дисбактериозом и нарушениями физического развития ребёнка.
Приобретённые формы патологии могут наблюдаться при кишечных заболеваниях, например гастритах, колитах, энтеритах. Следует заметить, что в этих случаях особенно заметно снижение активности лактазы. Как уже говорилось, активность лактазы в кишечнике ниже, чем других дисахаридаз, поэтому уменьшение её активности становится заметным для организма в первую очередь.
Дефицит лактазы у взрослых людей может иметь и другую причину. Возможно снижение экспрессии гена лактазы возрастного характера. Уже упоминалось, что активность лактазы у взрослых людей в норме значительно ниже, чем у детей. Поэтому снижение активности лактазы относительно уже имеющегося низкого уровня у отдельных людей может проявляться непереносимостью молока. Носителями патологии, связанной с дефицитом лактазы, являются чаще всего лица африканского и азиатского происхождения. Средняя частота данной формы патологии в странах Европы составляет 7-12 %, в Китае — 80 %, в отдельных районах Африки — до 97 %. Подобные наблюдения распространения лактазной недостаточности связывают с исторически сложившимся рационом питания и отсутствием молочного скотоводства в упомянутых регионах. Примеры и причины нарушения переваривания дисахаридов перечислены в таблице.
Существуют редкие формы нарушения переваривания углеводов. Например, известна наследственная недостаточность трегалазы, которая проявляется диспепсией после употребления грибов, содержащих трегалозу.
В отдельных случаях мальабсорбция может быть вызвана несколькими причинами. Например, после операции на желудке возможны ухудшение смешивания пищи с пищеварительными соками, снижение их секреции, ускорение прохождения пищи через кишечник, колонизация бактериями слепой и приводящей петель.
Нарушения всасывания моносахаридов[править | править код]
Для диагностики различных нарушений переваривания используют пробы с нагрузкой определёнными углеводами. Нарушения всасывания могут быть следствием дефекта какого-либо компонента (белка или фермента), участвующего в системе транспорта моносахаридов через мембрану. Описаны патологии, связанные с дефектом натрийзависимого белка переносчика глюкозы. Недостаточность кишечных дисахаридаз можно диагностировать с помощью введения дисахарида и последующего определения концентрации глюкозы в крови. Для большей чувствительности этот тест проводят, вводя сначала дисахарид (50 г), а затем эквивалентное количество составляющих его моносахаридов (по 25 г каждого). После нагрузки концентрация глюкозы в крови увеличивается примерно на 50 % относительно нормы. При патологии отмечают незначительную гипергликемию.
Нарушения переваревания дисахаридов
| Причина заболевания | Клинические проявления и лабораторные данные |
|---|---|
| Наследственный дефицит лактазы | Встречается относительно редко. После приёма молока наблюдаются рвота, диарея, спазмы и боли в животе, метеоризм. Симптомы развиваются сразу после рождения. |
| Недостаточность лактазы вследствие снижения экспрессии гена фермента в онтогенезе | Характерна для взрослых и детей старшего возраста. Является следствием возрастного снижения количества лактазы. Симптомы непереносимости молока аналогичны наследственной форме дефицита лактозы. |
| Недостаточность лактазы вторичного характера | Это временная, приобретённая форма. Непереносимость молока может быть следствием кишечных заболеваний, например, колитов, гастритов. Кроме того, временный дефицит лактазы может быть следствием операций на ЖКТ. |
| Наследственная недостаточность сахаразо-изомальтазного комплекса | Проявляется, когда в рацион детей добавляют сахарозу и крахмал. Больные дети обычно неохотно едят сладкое. После нагрузки сахарозой отмечается незначительная гипергликемия. Другие сахара (глюкоза, фруктоза, лактоза) переносятся хорошо. |
| Приобретённая недостаточность сахаразо-изомальтазного комплекса | Может возникать вследствие кишечных заболеваний. Проявляется диспепсией, провоцируемой крупами, крахмалом, а также пивом и другими напитками на основе солода. |
Если тест при нагрузке моносахаридом сопровождается адекватным повышением его концентрации в крови, а нагрузка дисахаридом не даёт нормальной реакции, то это, скорее всего, указывает на дефект кишечной дисахаридазы, а не системы транспорта.
О недостаточности лактазы можно судить, определяя водород в выдыхаемом воздухе (водородный тест). Водород образуется в результате действия бактериальных ферментов на лактозу.
Многие ткани синтезируют в качестве резервной формы глюкозы гликоген. Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови и создают депо для её использования тканями по мере необходимости.
Гликоген — одна из самых главных форм запасания углеводов у грибов, животных и человека.
Нарушения углеводного обмена
Углеводы — обязательный и наиболее значительный компонент пищи. В сутки человек потребляет 400–600 г различных углеводов.
Как необходимый участник метаболизма, углеводы включены практически во все виды обмена веществ: нуклеиновых кислот (в виде рибозы и дезоксирибозы), белков (например, гликопротеинов), липидов (например, гликолипидов), нуклеозидов (например, аденозина), нуклеотидов (например, АТФ, АДФ, АМФ), ионов (например, обеспечивая энергией их трансмембранный перенос и внутриклеточное распределение).
Как важный компонент клеток и межклеточного вещества, углеводы входят в состав структурных белков (например, гликопротеинов), гликолипидов, гликозаминогликанов и других.
Как один из главных источников энергии, углеводы необходимы для обеспечения жизнедеятельности организма. Наиболее важны углеводы для нервной системы. Ткань мозга использует примерно 2/3 всей глюкозы, поступающей в кровь.
Типовые формы нарушений
Расстройства метаболизма углеводов объединяют в несколько групп их типовых форм патологии: гипогликемии, гипергликемии, гликогенозы, гексоз‑ и пентоземии, агликогенозы (рис. 8–1).

Рис. 8–1. Типовые формы нарушения углеводного обмена.
Гипогликемии
Гипогликемии — состояния, характеризующиеся снижением уровня глюкозы плазмы крови (ГПК) ниже нормы (менее 65 мг%, или 3,58 ммоль/л). В норме ГПК натощак колеблется в диапазоне 65–110 мг%, или 3,58–6,05 ммоль/л.
Причины гипогликемии
Причины гипогликемии представлены на рис. 8–2.

Рис. 8–2. Причины гипогликемии.
Патология печени
Наследственные и приобретённые формы патология печени — одна из наиболее частых причин гипогликемии. Гипогликемия характерна для хронических гепатитов, циррозов печени, гепатодистрофий (в том числе иммуноагрессивного генеза), для острых токсических поражений печени, для ряда ферментопатий (например, гексокиназ, гликогенсинтетаз, глюкозо–6‑фосфатазы) и мембранопатий гепатоцитов. К гипогликемии приводят нарушения транспорта глюкозы из крови в гепатоциты, снижение активности гликогенеза в них и отсутствие (или малое содержание) депонированного гликогена.
Нарушения пищеварения
Нарушения пищеварения — полостного переваривания углеводов, а также их пристеночного расщепления и абсорбции — приводят к развитию гипогликемии. Гипогликемия развивается также при хронических энтеритах, алкогольном панкреатите, опухолях поджелудочной железы, синдромах нарушенного всасывания.
• Причины нарушений полостного переваривания углеводов
† Недостаточность ‑амилазы поджелудочной железы (например, у пациентов с панкреатитами или опухолями железы).
† Недостаточное содержание и/или активность амилолитических ферментов кишечника (например, при хронических энтеритах, резекции кишечника).
• Причины нарушений пристеночного расщепления и абсорбции углеводов
† Недостаточность дисахаридаз, расщепляющих углеводы до моносахаридов — глюкозы, галактозы, фруктозы.
† Недостаточность ферментов трансмембранного переноса глюкозы и других моносахаридов (фосфорилаз), а также белка–переносчика глюкозы GLUT5.
Патология почек
Гипогликемия развивается при нарушении реабсорбции глюкозы в проксимальных канальцах нефрона почек. Причины:
• Дефицит и/или низкая активность ферментов (ферментопатия, энзимопатия), участвующих в реабсорбции глюкозы.
• Нарушение структуры и/или физико‑химического состояния мембран (мембранопатии) вследствие дефицита или дефектов мембранных гликопротеинов, участвующих в реабсорбции глюкозы (подробнее см. в приложении «Справочник терминов», статья «Переносчики глюкозы» на компакт-диске).
Названные причины приводят к развитию синдрома, характеризующегося гипогликемией и глюкозурией («почечный диабет»).
Эндокринопатии
Основные причины развития гипогликемии при эндокринопатиях: недостаток эффектов гипергликемизирующих факторов или избыток эффектов инсулина.
• К гипергликемизирующим факторам относят глюкокортикоиды, йодсодержащие гормоны щитовидной железы, СТГ, катехоловые амины и глюкагон.
† Глюкокортикоидная недостаточность (например, при гипокортицизме вследствие гипотрофии и гипоплазии коры надпочечников). Гипогликемия развивается в результате торможения глюконеогенеза и дефицита гликогена.
† Дефицит тироксина (T4) и трийодтиронина (T3) (например, при микседеме). Гипогликемия при гипотиреозах является результатом торможения процесса гликогенолиза в гепатоцитах.
† Недостаток СТГ (например, при гипотрофии аденогипофиза, разрушении его опухолью, кровоизлиянии в гипофиз). Гипогликемия при этом развивается в связи с торможением гликогенолиза и трансмембранного переноса глюкозы.
† Дефицит катехоламинов (например, при туберкулёзе с развитием надпочечниковой недостаточности). Гипогликемия при дефиците катехоламинов является следствием пониженной активности гликогенолиза.
† Недостаток глюкагона (например, при деструкции ‑клеток поджелудочной железы в результате иммунной аутоагрессии). Гипогликемия развивается в связи с торможением глюконеогенеза и гликогенолиза.
• Избыток инсулина и/или его эффектов
Причины гипогликемии при гиперинсулинизме:
† активация утилизации глюкозы клетками организма,
† торможение глюконеогенеза,
† подавление гликогенолиза.
Указанные эффекты наблюдаются при инсулиномах или передозировке инсулина.
Углеводное голодание
Углеводное голодание наблюдается в результате длительного общего голодания, в том числе — углеводного. Дефицит в пище только углеводов не приводит к гипогликемии в связи с активацией глюконеогенеза (образование углеводов из неуглеводных веществ).
Длительная значительная гиперфункция организма при физической работе
Гипогликемия развивается при длительной и значительной физической работе в результате истощения запасов гликогена, депонированного в печени и скелетных мышцах.
Клинические проявления гипогликемиИ
Возможные последствия гипогликемии (рис. 8–3): гипогликемическая реакция, синдром и кома.

Рис. 8–3. Возможные последствия гипогликемии.
Гипогликемическая реакция
Гипогликемическая реакция — острое временное снижение ГПК до нижней границы нормы (как правило, до 80–70 мг%, или 4,0–3,6 ммоль/л).
• Причины
† Острая избыточная, но преходящая секреция инсулина через 2–3 сут после начала голодания.
† Острая чрезмерная, но обратимая секреция через несколько часов после нагрузки глюкозой (с диагностической или лечебной целью, переедания сладкого, особенно у лиц пожилого и старческого возраста).
• Проявления
† Низкий уровень ГПК.
† Лёгкое чувство голода.
† Мышечная дрожь.
† Тахикардия.
Указанные симптомы в покое выражены слабо и выявляются при дополнительной физической нагрузке или стрессе.
Гипогликемический синдром
Гипогликемический синдром — стойкое снижение ГПК ниже нормы (до 60–50 мг%, или 3,3–2,5 ммоль/л), сочетающееся с расстройством жизнедеятельности организма.
Проявления гипогликемического синдрома приведены на рис. 8–4. По происхождению они могут быть как адренергическими (обусловленными избыточной секрецией катехоламинов), так и нейрогенными (вследствие расстройств функций ЦНС).

Рис. 8–4. Проявления гипогликемического синдрома.
Гипогликемическая кома
Гипогликемическая кома — состояние, характеризующееся падением ГПК ниже нормы (как правило, менее 40–30 мг%, или 2,0–1,5 ммоль/л), потерей сознания, значительными расстройствами жизнедеятельности организма.
Механизмы развития
• Нарушение энергетического обеспечения нейронов, а также клеток других органов вследствие:
† Недостатка глюкозы.
† Дефицита короткоцепочечных метаболитов свободных жирных кислот — ацетоуксусной и ‑гидрооксимасляной, которые эффективно окисляются в нейронах. Они могут обеспечить нейроны энергией даже в условиях гипогликемии. Однако, кетонемия развивается лишь через несколько часов и при острой гипогликемии не может быть механизмом предотвращения энергодефицита в нейронах.
† Нарушения транспорта АТФ и расстройств использования энергии АТФ эффекторными структурами.
• Повреждение мембран и ферментов нейронов и других клеток организма.
• Дисбаланс ионов и воды в клетках: потеря ими K+, накопление H+, Na+, Ca2+, воды.
• Нарушения электрогенеза в связи с указанными выше расстройствами.
Принципы терапии гипогликемий
Принципы устранения гипогликемического синдрома и комы: этиотропный, патогенетический и симптоматический
Этиотропный
Этиотропный принцип направлен на ликвидацию гипогликемии и лечение основного заболевания.
Ликвидация гипогликемии
Введение в организм глюкозы:
• в/в (для устранения острой гипогликемии одномоментно 25–50 г в виде 50% раствора. В последующем инфузия глюкозы в меньшей концентрации продолжается до восстановления сознания у пациента).
• с пищей и напитками. Это необходимо в связи с тем, что при в/в введении глюкозы не восстанавливается депо гликогена в печени (!).
Терапия основного заболевания, вызвавшего гипогликемию (болезней печени, почек, ЖКТ, желёз внутренней секреции и др.).
Патогенетический
Патогенетический принцип терапии ориентирован на:.
• блокирование главных патогенетических звеньев гипогликемической комы или гипогликемического синдрома (расстройств энергообеспечения, повреждения мембран и ферментов, нарушений электрогенеза, дисбаланса ионов, КЩР, жидкости и других).
• ликвидацию расстройств функций органов и тканей, вызванных гипогликемией и её последствиями.
Устранение острой гипогликемии, как правило, приводит к быстрому «выключению» её патогенетических звеньев. Однако хронические гипогликемии требуют целенаправленной индивидуализированной патогенетической терапии.
Симптоматический
Симптоматический принцип лечения направлен на устранение симптомов, усугубляющих состояние пациента (например, сильной головной боли, страха смерти, резких колебаний АД, тахикардии и др.).
Вопрос 9. Нарушение обмена углеводов.
При полном отсутствии углеводов в рационе или нарушениях их усвоения они могут синтезироваться в организме из жиров и белков, сопровождаясь образованием недоокисленных продуктов жирового обмена и развитием ацидоза.
Избыточное же употребление углеводов ведет к перенапряжению инсулинового аппарата, нарушению обмена веществ, ожирению. Усвояемость углеводов достаточно высока и составляет 80—98%. Классификация углеводов представлена ниже.
Простые Моносахариды:
| Сложные Полисахариды: клетчатка |
Систематический избыток усвояемых углеводов в питании может способствовать возникновению ряда болезней.
Важная роль в регулировании обмена глюкозы в крови принадлежит гормону поджелудочной железы – инсулину. Если организм вырабатывает его в недостаточном количестве, то процессы использования глюкозы замедляются. Уровень глюкозы в крови повышается. Почки перестают задерживать высокие концентрации сахара в крови и появляется сахар в моче. В таком случае следует резко ограничить в питании содержание простых сахаров, особенно сахарозы и некоторых полисахаридов, которые вызывают увеличение концентрации глюкозы в крови.
Недостаток глюкозы. В противном случае в крови появятся продукты неполного окисления жиров, так называемые кетоновые тела, произойдет нарушение функции центральной нервной системы и мышц, ослабление умственной и физической деятельности. Во время бодрствования энергия глюкозы восполняет почти половину энергетических затрат организма. Оставшаяся невостребованной часть глюкозы преобразуется в гликоген, который депонируется (хранится) в печени. Сложнорегулируемое расщепление этого полисахарида обеспечивает стабильный уровень глюкозы в крови. Но при определенных условиях часть глюкозы, иногда значительная, превращается в собственный жир организма.
Небольшой избыток сахара превращается в гликоген, хранящийся в печени и мышцах. При недостатке усваиваемых углеводов в пище глюкоза в крови образуется из этих запасных полисахаридов.
Но систематический избыток усваиваемых углеводов в питании может способствовать возникновению ряда болезней (ожирение, атеросклероз, сахарный диабет).
Толерантность к глюкозе у детей больше, чем у взрослых. У последних глюкоза появляется в моче в случае, если ее потребляет организм 2,5–3 г на 1 кг массы тела, у детей только после потребления 8–12 г глюкозы на 1 кг массы тела отмечается ее появление в моче. Это связано с тем, что у детей при избытке глюкозы интенсивно синтезируется гликоген, откладывающийся не только в печени, но и в других органах.
Отсутствие пищевых волокон в диете может провоцировать рак толстой кишки и других отделов кишечника.
Атеросклероз, гипертония, диабет – результат недостатка пищевых волокон. В ряде стран интенсивно вводят в пищевую промышленность пищевые волокна.
Расстройство обмена углеводов может быть обусловлено нарушением их переваривания и всасывания в пищеварительном тракте. Экзогенные углеводы поступают в организм в виде поли-, ди – и моносахаридов. Их расщепление в основном происходит в двенадцатиперстной кишке и тонком кишечнике, соки которых содержат активные амилолитические ферменты (амилазу, мальтазу, сахаразу, лактазу, инвертазу и др.). Углеводы расщепляются до моносахаридов и всасываются. Если продукция амилолитических ферментов недостаточна, то поступающие с пищей ди – и полисахариды не расщепляются до моносахаридов и не всасываются. Всасывание глюкозы страдает при нарушении ее фосфорилирования в кишечной стенке. В основе данного нарушения лежит недостаточность фермента гексокиназы, развивающаяся при тяжелых воспалительных процессах в кишечнике, при отравлении монойодацетатом, флоридзином. Нефосфорилированная глюкоза не проходит через кишечную стенку и не усваивается. Может развиться углеводное голодание.
Нарушение синтеза и расщепления гликогена. Патологическое усиление распада гликогена происходит при сильном возбуждении ЦНС, при повышении активности гормонов, стимулирующих гликогенолиз (СТГ, адреналин, глюкагон, тироксин). Повышение распада гликогена при одновременном увеличении потребления мышцами глюкозы происходит при тяжелой мышечной нагрузке. Синтез гликогена может изменяться в сторону снижения или патологического усиления.
Снижение синтеза гликогена происходит при тяжелом поражении печеночных клеток (гепатиты, отравление печеночными ядами), когда нарушается их гликогенообразовательная функция. Синтез гликогена снижается при гипоксии, так как в условиях гипоксии уменьшается образование АТФ, необходимой для синтеза гликогена.
Гипергликемия – повышение уровня сахара в крови выше нормального. Может развиваться в физиологических условиях; при этом имеет приспособительное значение, так как обеспечивает доставку тканям энергетического материала. В зависимости от этиологического фактора различают следующие типы гипергликемии.
Алиментарная гипергликемия, развивающаяся после приема большого количества легко усвояемых углеводов (сахар, конфеты, мучные изделия и др.).
Нейрогенная (эмоциональная) гипергликемия – при эмоциональном возбуждении, стрессе, боли, эфирном наркозе.
Гормональные гипергликемии сопровождают нарушения функций эндокринных желез, гормоны которых участвуют в регуляции углеводного обмена.
Гипергликемия при недостаточности гормона инсулина является наиболее выраженной и стойкой. Она может быть панкреатической (абсолютной) и внепанкреатической (относительной).
Панкреатическая недостаточность инсулина развивается при разрушении или повреждении инсулярного аппарата поджелудочной железы. Частой причиной является местная гипоксия островков Лангерганса при атеросклерозе, спазме сосудов. При этом нарушается образование в инсулине дисульфидных связей и инсулин теряет активность – не оказывает гипогликемического эффекта.
К инсулиновой недостаточности может привести разрушение поджелудочной железы опухолями, повреждение ее инфекционным процессом (туберкулез, сифилис). Образование инсулина может нарушиться при панкреатитах – острых воспалительно-дегенеративных процессах в поджелудочной железе.
Инсулярный аппарат перенапрягается и может истощиться при излишнем и частом употреблении в пищу легкоусвояемых углеводов (сахар, конфеты), при переедании, что ведет к алиментарной гипергликемии.
Ряд лекарственных препаратов (группы тиазидов, кортикостероиды и др.) могут вызывать нарушения толерантности к глюкозе, а у предрасположенных к диабету лиц явиться пусковым фактором в развитии данного заболевания.
Внепанкреатическая недостаточность инсулина. Ее причиной может послужить избыточная связь инсулина с переносящими белками крови. Инсулин, связанный с белком, активен лишь в отношении жировой ткани. Он обеспечивает переход глюкозы в жир, тормозит липолиз. При этом развивается так называемый диабет тучных.
При сахарном диабете нарушаются все виды обмена веществ.
Нарушения углеводного обмена определяют характерный симптом диабета – стойкую выраженную гипергликемию. Ее обусловливают следующие особенности углеводного обмена при сахарном диабете: понижение прохождения глюкозы через клеточные мембраны и ассимиляции ее тканями; замедление синтеза гликогена и ускорение его распада; усиление глюконеогенеза – образование глюкозы из лактата, пирувата, аминокислот и других продуктов неуглеводного обмена; торможение перехода глюкозы в жир.
Значение гипергликемии в патогенезе сахарного диабета двояко. Она играет определенную адаптивную роль, так как при ней тормозится распад гликогена и отчасти увеличивается его синтез. Глюкоза легче проникает в ткани, и они не испытывают резкого недостатка углеводов. Гипергликемия имеет и отрицательное значение. При ней резко повышается поступление глюкозы в клетки инсулиннезависимых тканей (хрусталик, клетки печени, бета-клетки островков Лангерганса, нервная ткань, эритроциты, стенка аорты). Избыточная глюкоза не подвергается фосфорилированию, а превращается в сорбитол и фруктозу. Это осмотически активные вещества, нарушающие обмен в данных тканях и вызывающие их повреждение. При гипергликемии повышается концентрация глюко – и мукопротеидов, которые легко выпадают в соединительной ткани, способствую образованию гиалина. При гипергликемии, превышающей 8 моль/л, глюкоза начинает переходить в окончательную мочу – развивается глюкозурия. Это проявление декомпенсации углеводного обмена.
При сахарном диабете процессы фосфорилирования и дефосфорилирования глюкозы в канальцах не справляются с избытком глюкозы в первичной моче. Кроме того, при диабете снижена активность гексокиназы, поэтому почечный порог для глюкозы снижается по сравнению с нормальным. Развивается глюкозурия. При тяжелых формах сахарного диабета содержание сахара в моче может достигать 8-10%. Осмотическое давление мочи при этом повышается, в связи с чем в окончательную мочу переходит много воды. За сутки выделяется 5-10 л и более мочи (полиурия) с высокой относительной плотностью за счет сахара. В результате полиурии развивается обезвоживание организма, и как следствие его – усиленная жажда (полидипсия).
При очень высоком уровне сахара в крови (30-50 моль/л и выше) резко возрастает осмотическое давление крови. В результате происходит обезвоживание организма. Может развиться гиперосмолярная кома. Состояние больных при ней крайне тяжелое. Сознание отсутствует. Резко выражены признаки обезвоживания тканей (мягкие при пальпации глазные яблоки). При очень высокой гипергликемии уровень кетоновых тел близок к норме. В результате обезвоживания происходит повреждение почек, нарушается их функция вплоть до развития почечной недостаточности.
Нарушение углеводного обмена – диагностика и лечение в медицинском центре “Андреевские больницы
У каждого человека в норме уровень содержания глюкозы в крови должен быть от 3,3 до 5,5 ммоль/л. Конечно, глюкоза – очень важная постоянная гомеостаза. При расстройствах углеводного обмена (гипогликемия) в организме происходят необратимые изменения, которые связаны с деятельностью центральной нервной системы.
Понижение глюкозы в крови до 2.2 ммоль/л может спровоцировать судороги и нарушения сознания, человек может впасть гликемическую кому. При незначительном отклонении от нормы больной будет испытывать недомогание, а также снизится его работоспособность.
Причины нарушения углеводного обмена
Основными причинами нарушений процессов, связанных с углеводным обменом, могут стать:
- Нарушение фосфорилирования глюкозы в стенке кишечника (обычно это происходит в том случае, если воспаляется кишечная стенка, при отравлениях флоридзином и монойодацетагом).
- Нарушение нервно-гормональной регуляции.
- Нарушение углеводной функции печени.
- Нарушение нейрогормональной регуляции углеводного обмена.
Симптомы нарушения углеводного обмена
При нарушении разных видов углеводного обмена наблюдается снижение глюкокиназы. Возрастает активность глюко-фосфатазы, следовательно, глюкофосфат поступает в кровь в виде глюкозы. Через мембраны клеток глюкоза практически не проходит, вследствие чего она не способна усваиваться тканями. Ускоряется глюконеогенез (образование глюкозы из пирувата, лактата, амиокислот жирных веществ и др.).
Человек при пониженном уровне глюкозы в крови чувствует общую слабость, быстро утомляется, ему тяжело выполнять обычную ежедневную работу. При сильных отклонениях от нормы начинаются судороги, помутнения сознания. Самый страшный симптом этого заболевания – гликемическая кома.
Диагностика нарушения углеводного обмена
Чтобы правильно диагностировать заболевание, вам необходимо обратиться к врачу, который предложит вам пройти следующие анализы и обследования:
- В первую очередь нужно сдать анализ крови.
- Затем биохимический анализ крови.
- Сделать глюкозотолерантный тест.
- Липидный профиль.
- Гликированный гемоглобин.
- Определить уровень секреции инсулина, а также С-пептида.
- Провести иммунологические анализы.
- Проверить, расположены ли вы к возникновению развития нарушений углеродного обмена вследствие наследственности.
- Диагностика нефропатии.
- ЭКГ и УЗИ.
- Сканирование ультразвуком сосудов.
Врач, который специализируется на нарушениях углеводного обмена, – эндокринолог.
Лечение нарушений углеводного обмена
Для восстановления углеводного обмена можно воспользоваться медикаментозным лечением – препаратами, которые снижают сахар в крови. Это бигуаниды, ингибиторы альфа-глюкозидаза. Однако препараты не принесут пользы, если вы не будете соблюдать правильный режим жизни. Сюда входят: правильное питание, физические нагрузки, сахароснижающая терапия.
Профилактика нарушений углеводного обмена
В связи с нарушением обмена веществ могут развиться довольно сложные и серьезные заболевания, поэтому необходимо предпринять все меры для того, чтобы нарушения не начали развиваться. В первую очередь необходимо сбалансированно и правильно питаться. Это основной залог здоровья. Также существует множество витаминных препаратов, биологических пищевых добавок. Если вы – сладкоежка, от продуктов, содержащих много глюкозы, придется отказаться. Оптимальное употребление воды – 2 л в день.
Нарушения углеводного обмена
Достаточно полные сведения о характере нарушения у пациента углеводного обмена врач может получить, проанализировав его кровь на содержание глюкозы, гликогена, инсулина, молочной и пировиноградной кислот, а также, измерив в ней активность важнейших ферментов углеводного обмена, и, прежде всего, диастазы, гликогенсинтазы, лактатдегидрогеназы и некоторых других.
В повседневной деятельности врач, чаще всего, анализирует у пациента либо уровень глюкозы в крови, либо изучает в ней динамику изменения этого показателя после сахарной нагрузки (толерантность к углеводам).
У практически
здоровых лиц уровень глюкозы в крови
колеблется в пределах 3,3—5,5 мМ/л
(60—100 мг проц.). Изменения в содержании
глюкозы зависят, с одной стороны, 
 от
скорости поступления углеводов в
организм, и, с другой стороны, от
скорости потребления глюкозы тканями,
а у больных — еще от характера и степени
нарушения углеводного обмена.
от
скорости поступления углеводов в
организм, и, с другой стороны, от
скорости потребления глюкозы тканями,
а у больных — еще от характера и степени
нарушения углеводного обмена.
В медицинской практике повышение уровня глюкозы в крови называютгипергликемией (гиперглюкоземией), а понижение —гипогликемией (гипоглюкоземией). Как же научиться использовать исходные данные по содержанию глюкозы в крови для установления характера нарушения углеводного обмена?
С этой целью все виды изменений уровня глюкозы в крови (гипер-, и гипогликемии) лучше всего подразделить на две группы:
а)гормональные, т.е. связанные с изменением функции эндокринных желез;
б)внегормональные причины изменения уровня глюкозы.
Гипергликемии внегормональные. После приема с пищей большого количества простых сахаров у людей развивается так называемаяалиментарная гипергликемия. Механизм ее развития представить нетрудно. Нередко гипергликемия наблюдается после перевозбуждения центральной нервной системы (ЦНС). Это так называемаяэмоциональная гипергликемия. Если уровень глюкозы в крови поднимается выше 10 мМ/л — глюкоза преодолевает почечный барьер и выделяется из организма с мочой. Развиваетсяглюкозурия. Повышение содержания глюкозы вкрови, после приема с пищей избытка углеводов, внутривенного их введения или эмоционального возбуждения, может наблюдаться и у здоровых лиц, и у больных. Различие заключается в том, что у последних гипергликемия выражена сильнее, сохраняется она значительно дольше, и больные нередко теряют с мочой глюкозу. Для уточнения механизма нарушения углеводного обмена у пациентов, в этих случаях определяют тип гликемической кривой после сахарной нагрузки. Важно помнить, что, если у субъекта по каким-либопричинам гипергликемия возникает часто — это опасно для здоровья. Развивается перенапряжение инсулярного аппарата. Это способствует развитию сахарного диабета, атеросклероза и ишемической болезни сердца (ИБС). Вот почему важно ограничивать в диете людей долю углеводов и потребление с пищей, особенно рафинированных сахаров.
Внегормональные гипергликемии наблюдаются также при заболевании печени, почек, менингитах, энцефалитах, шоковых состояниях, травмах ЦНС.
Гипогликемии внегормональные. Они наблюдаются у людей значительно реже — при голодании, длительной физической нагрузке, у беременных. Значительно понижается уровень глюкозы в крови у детей при рождении. Важно помнить, что у недоношенных детей, после рождения, уровень глюкозы в крови может падать ниже критических величин (2,0—2,5 мМ/л), что крайне опасно для здоровья и жизни. Для нормализации обмена углеводов в этот период можно рекомендовать дополнительные введения глюкозы.
Гормональные гипергликемии.
У животных уровень глюкозы в крови повышают практически все гормоны, за исключением инсулина. Установлено, что инсулин облегчает транспорт глюкозы через клеточные мембраны, активирует ферменты катаболизма этих веществ, и, главное, способствует их превращению в гликоген. Развитие патологии, как правило, связанос формированием относительной или абсолютной недостаточности инсулина в организме.
1) Абсолютная недостаточность инсулина наблюдается в тех случаях, когда по ряду причин возникает недостаток гормона в крови. У пациента развивается диабетIтипа (инсулинзависимый).
2) Относительная недостаточность инсулина наблюдается, когда по ряду причин не реализуется действие инсулина (например, когда нарушается чувствительность рецепторов к инсулину), что приводит к развитию диабетаIIтипа.



 Во
всех названных случаях понижается
гипогликемическое действие инсулина
(транспорт глюкозы через мембраны
клеток, катаболизм и превращение глюкозы
в гликоген, липиды и другие, биологически
важные соединения). В крови от этого
повышается содержание глюкозы. В клетки
она не поступает, и они испытывают
энергетический голод. В связи с этим,
клетки «информируют» регуляторные
механизмы организма о том, что им не
хватает глюкозы. Включаются компенсаторные
механизмы, действием которых может
повыситься уровень глюкозы в крови и
тканях. Ведущим среди них является
процесс глюконеогенеза, и, прежде
всего образование глюкозы из аминокислот.
Но и эта, вновь синтезированная, в
основном в печени, и выделенная в кровь
глюкоза, не попадает в цитоплазму клеток,
не катаболизируется в силу недостаточности
инсулина. В конечном итоге в крови еще
больше повышается уровень глюкозы.
Нарастет явление глюкозурии. В тяжелых
случаях сахарного диабета уровень
глюкозы в крови у больных поднимается
выше 20—25 мМ/л. В моче содержание глюкозы
может достигать 5 %. Учитывая, что при
сахарном диабете резко возрастает
диурез (до 10 литров мочи в сутки) нетрудно
подсчитать, какое количество глюкозы
теряют больные сахарным диабетом. Для
покрытия потребности клетки в энергии
в ней усиливается катаболизм жиров и,
как результат, образование в повышенных
количествах кетоновых тел —
ацетоуксусной, β-окси-масляной кислот
и ацетона. Развивается кетонемия, а
затем — кетонурия. Во выдыхаемом больными
воздухе ощущается запах ацетона,
напоминающий запах моченых яблок.
Таковы молекулярные механизмы нарушений
углеводного обмена при сахарном
диабете.
Во
всех названных случаях понижается
гипогликемическое действие инсулина
(транспорт глюкозы через мембраны
клеток, катаболизм и превращение глюкозы
в гликоген, липиды и другие, биологически
важные соединения). В крови от этого
повышается содержание глюкозы. В клетки
она не поступает, и они испытывают
энергетический голод. В связи с этим,
клетки «информируют» регуляторные
механизмы организма о том, что им не
хватает глюкозы. Включаются компенсаторные
механизмы, действием которых может
повыситься уровень глюкозы в крови и
тканях. Ведущим среди них является
процесс глюконеогенеза, и, прежде
всего образование глюкозы из аминокислот.
Но и эта, вновь синтезированная, в
основном в печени, и выделенная в кровь
глюкоза, не попадает в цитоплазму клеток,
не катаболизируется в силу недостаточности
инсулина. В конечном итоге в крови еще
больше повышается уровень глюкозы.
Нарастет явление глюкозурии. В тяжелых
случаях сахарного диабета уровень
глюкозы в крови у больных поднимается
выше 20—25 мМ/л. В моче содержание глюкозы
может достигать 5 %. Учитывая, что при
сахарном диабете резко возрастает
диурез (до 10 литров мочи в сутки) нетрудно
подсчитать, какое количество глюкозы
теряют больные сахарным диабетом. Для
покрытия потребности клетки в энергии
в ней усиливается катаболизм жиров и,
как результат, образование в повышенных
количествах кетоновых тел —
ацетоуксусной, β-окси-масляной кислот
и ацетона. Развивается кетонемия, а
затем — кетонурия. Во выдыхаемом больными
воздухе ощущается запах ацетона,
напоминающий запах моченых яблок.
Таковы молекулярные механизмы нарушений
углеводного обмена при сахарном
диабете.
В нормализации углеводного обмена при сахарном диабете ведущую роль играет инсулин и диета с ограниченны содержанием простых сахаров.
Гипергликемии гормональные наблюдаются также при нарушении функциональной активности других эндокринных желез, как правило, при их гиперфункции. Среди гормональных причин, вызывающих гипергликемию, следует особо выделить так называемый стероидный диабет. Наблюдается он у людей с избыточным содержанием глюкокортикоидных гормонов в крови. Повышение содержания последних может быть следствием либо гиперфункции (гиперсекреции) коры надпочечников при наличии в ней опухоли, или даже быть результатом введения с лечебной целью адренокортикотропных или кортикостероидных гормонов. Повышение уровня глюкозы в крови при стероидном диабете объясняется усилением скорости глюконеогенеза под влиянием глюкокортикоидных гормонов. Метаболизм сахаров в этих случаях можно восстановить отменой стероидных гормонов и нормализацией функциональной активности коры надпочечников.
Повышается уровень глюкозы в крови при гиперсекреции катехоламинов (в результате усиления мобилизации гликогена), тиреоидных гормонов, глюкагона, а также многих других гормонов.
Гормональные гипогликемии. Они наблюдаются чаще всего, как результат введения в организм завышенных доз инсулина при лечении больных сахарным диабетом или ишемической болезнью сердца, а также при гиперплазии островков Лангерганса у больных с опухолью поджелудочной железы.
Следует отметить, что патология в углеводном обмене может также формироваться по причине нарушения их обмена на промежуточных этапах превращения. Чаще всего эти нарушения являются следствием изменения активности одного фермента, лимитирующего какой-либо путь превращения углеводов. Нарушения в обмене углеводов на промежуточных этапах их превращения ведут к развитию таких заболеваний, как гликогеновые болезни, гликозидозы, галактоземии и некоторых других заболеваний.
Гликогеновые болезни. Они являются результатом полного отсутствия в организме или недостаточной активности ферментов, осуществляющих мобилизацию гликогена, а именно фосфорилазы и киназы фосфорилазы. Известны несколько типов гликогенозов. Во всех случаях заболевания в клетках у больных чрезмерно повышается содержание гликогена, так как он при этом частично или полностью не разрушается.
Если снижается активность ферментов не распада, а биосинтеза гликогена, то, наоборот, развиваются агликогенозы. В клетках у таких больных понижается сначала содержание гликогена, а затем и глюкозы.

 Широко
известны в настоящее время гликозидозы — болезни нарушения обмена
гликопротеидов и гликолипидов, т. е.
основных компонентов межклеточного
вещества соединительной ткани и
клеточных мембран. Болезни эти развиваются
в связи с дефектом лизосомальных
ферментов, разрушающих в клетках
полисахариды. Гликогеновые болезни и
гликозидозы могут стать причиной смерти
в раннем возрасте.
Широко
известны в настоящее время гликозидозы — болезни нарушения обмена
гликопротеидов и гликолипидов, т. е.
основных компонентов межклеточного
вещества соединительной ткани и
клеточных мембран. Болезни эти развиваются
в связи с дефектом лизосомальных
ферментов, разрушающих в клетках
полисахариды. Гликогеновые болезни и
гликозидозы могут стать причиной смерти
в раннем возрасте.
С патологией углеводного обмена на промежуточных этапах их превращения связано развитие галактоземии. Наблюдаются эти заболевания при отсутствии или недостаточной активности фермента гексозо-1-фосфат уридилтрансферазы. В крови таких больных уровень галактозы может повышаться до 10—16 мМ/л. Чаще болезнь развивается у детей. Этоприводит к развитию умственной отсталости, помутнению хрусталика, возможны и летальные исходы заболевания.
У некоторых жителей Северной Европы и Африки с возрастом понижается лактазная активность клеток кишечного эпителия. Поступающая с пищей лактоза вследствие этого не переваривается, что ведет к диарее, особенно после приема с пищей молока. При исключении из диеты молока, диарея, как правило, прекращаются.
Нарушения обмена углеводов
Гипергликемия, которая возникает в результате:
а) снижения проницаемости клеточных мембран для глюкозы. Глюкоза накапливается в крови.
б) усиления процессов, поставляющих глюкозу в кровь (распад гликогена печени, глюконеогенез).
в) торможение процессов, потребляющих глюкозу (синтез гликогена, гликолиз, пентозофосфатный путь).
В норме концентрация глюкозы в крови составляет 3,3-5,5 ммоль/л, при сахарном диабете – 6,7 ммоль/л и выше, при 8,9 ммоль/л возникает глюкозурия.
Заторможен пентозофосфатный путь. В результате этого снижено образование НАДФН, что приводит к катаракте.
Гипергликемия вызывает неферментативное гликозилирование белков, в том числе белков клеточных мембран всех органов и систем, в первую очередь, сосудов. Возникают микроангиопатии (ранний признак сахарного диабета).
Нарушения обмена липидов
Нарушения обмена липидов характерны для инсулинзависимого диабета.
Усиливается липолиз, в крови повышается концентрация НЭЖК. Больные в этом случае худеют.
Усиливается окисление жирных кислот и образование ацетил-КоА.
Возрастает синтез кетоновых тел, накопление которых опасно, так как приводит к метаболическому ацидозу.
Возрастает синтез холестерина, что является фактором риска для развития атеросклероза.
Нарушения обмена белков
Увеличивается синтез гликопротеидов.
Усиливается распад белков, синтез мочевины, возрастает остаточный аз
Осложнения при сахарном диабете
Полиурия и полидипсия.(жажда)
Диабетическая кома. Признаки: гипергликемия (14-16 ммоль/л), резкое увеличение содержания кетоновых тел, повышение уровня холестерина, ЛПНП, рН крови сдвигается до 6,8. Это приводит к снижению связанности инсулина с рецептором.
Ангиопатии (микро- и макро -). Микроангиопатия сосудов сетчатки глаза снижает остроту зрения, микроангиопатия сосудов почек приводит к тяжелой почечной недостаточности. Макроангиопатия – нарушение крупных сосудов – характеризуется атеросклерозом, поражением сосудов нижних конечностей.
Гиперосмолярная кома возникает при концентрации глюкозы в крови 50-60 ммоль/л. В результате повышается осмотическое давление крови, что приводит к обезвоживанию организма.
Гипогликемическая кома может возникнуть при передозировке инсулина
глюкозотолерантный тест («сахарная нагрузка»). Вначале теста для определения исходного содержания глюкозы берут кровь из пальца; После этого испытуемому дают выпить 75 г глюкозы, растворенной в воде. Через 2 часа после приема глюкозы берут вторую пробу кровинорма натощак 6.1ммоль на литр после глюкозы 7,8ммоль на литр
нарушение толерантности натощак 7,0 после 11
51. | Соматотропный гормон, глюкагон и другие пептидные гормоны. Биологическое значение. |
Белково – пептидные гормоны
Либерины, статины, андидиуретический гормон, окситоцин – гормоны гипоталамуса.
Тропины (соматотропин, тиреотропин, кортикотропин, фоликулостимулирующий, лютеонизирующий, пролактин) – гормоны гипофиза.
Тиреокальцитонин – гормон щитовидной железы.
Паратгормон – гормон паращитовидной железы.
Тимозин – гормон тимуса.
Инсулин – гормон В-клеток поджелудочной железы.
Глюкагон – гормон А-клеток поджелудочной железы.
Гастрин, секретин, холецистокинин, энтерогастрон – гормоны ЖКТ.
Гормоны предсердий.
Факторы роста клеток, нервов, сосудов.
Ангиотензин-II, кинины – гормоны крови.
Соматотропный гормон (СТГ, гормон роста)
СТГ – простой белок (молекулярная масса 21000). Обладает высокой видовой специфичностью.
СТГ выполняет следующие функции:
Стимулирует синтез белка на уровне транскрипции и трансляции;
Активирует триглицеридлипазу, окисление жирных кислот;
Стимулирует освобождение глюкагона, что приводит к гипергликемии.
Выработку СТГ усиливает соматолиберин, снижает – соматостатин.
Действие СТГ на клетки осуществляется через цАМФ
Патология, вызванная нарушением образования СТГ.
Акромегалия возникает при избыточном образовании СТГ у взрослого человекаАкромегалия обычно обусловлена наличием опухоли аденогипофиза или снижением выработки статинов.
Гигантизм развивается при гиперсекреции СТГ у людей до завершения окостенения. Происходит общий чрезмерный рост скелета.
Гипофизарная карликовость (нанизм) наблюдается при гипосекреции СТГ в детском возрасте.
|
|
При некоторых состояниях можно наблюдать повышение содержания глюкозы в крови – гипергликемию, а также понижение концентрации глюкозы – гипогликемию. Гипергликемия является довольно частым симптомом различных заболеваний, прежде всего связанных с поражением эндокринной системы. Сахарный диабет. В регуляции гликолиза и глюконеогенеза большую роль играет инсулин. При недостаточности содержания инсулина возникает заболевание, которое носит название «сахарный диабет»: повышается концентрация глюкозы в крови (гипергликемия), появляется глюкоза в моче (глюкозурия) и уменьшается содержание гликогена в печени. Мышечная ткань при этом утрачивает способность утилизировать глюкозу крови. В печени при общем снижении интенсивности биосинтетических процессов: биосинтеза белков, синтеза жирных кислот из продуктов распада глюкозы – наблюдается усиленный синтез ферментов глюконеогенеза. При введении инсулина больным диабетом происходит коррекция метаболических сдвигов: нормализуется проницаемость мембран мышечных клеток для глюкозы, восстанавливается соотношение между гликолизом и глюко-неогенезом. Инсулин контролирует эти процессы на генетическом уровне как индуктор синтеза ключевых ферментов гликолиза: гексокиназы, фос-фофруктокиназы и пируваткиназы. Инсулин также индуцирует синтез гли-когенсинтазы. Одновременно инсулин действует как репрессор синтеза ключевых ферментов глюконеогенеза. Следует отметить, что индукторами синтеза ферментов глюконеогенеза служат глюкокортикоиды. В связи с этим при инсулярной недостаточности и сохранении или даже повышении секреции кортикостероидов (в частности, при диабете) устранение влияния инсулина приводит к резкому повышению синтеза и концентрации ферментов глюконеогенеза, особенно фосфоенолпируват-карбоксикиназы, определяющей возможность и скорость глюконеогенеза в печени и почках. Развитие гипергликемии при диабете можно рассматривать также как результат возбуждения метаболических центров в ЦНС импульсами с хе-морецепторов клеток, испытывающих энергетический голод в связи с недостаточным поступлением глюкозы в клетки ряда тканей. Роль системы фруктозо-2,6-бисфосфата в регуляции метаболизма углеводов, а также нарушения ее функционирования при сахарном диабете см. главу 16. Гипергликемия может возникнуть не только при заболевании поджелудочной железы, но и в результате расстройства функции других эндокринных желез, участвующих в регуляции углеводного обмена. Так, гипергликемия может наблюдаться при гипофизарных заболеваниях, опухолях коркового вещества надпочечников, гиперфункции щитовидной железы. Иногда гипергликемия появляется во время беременности. Наконец, гипергликемия возможна при органических поражениях ЦНС, расстройствах мозгового кровообращения, болезнях печени воспалительного или дегенеративного характера. Поддержание постоянства уровня глюкозы в крови, как отмечалось,– важнейшая функция печени, резервные возможности которой в этом отношении весьма велики. Поэтому гипергликемия, обусловленная нарушением функции печени, выявляется обычно при тяжелых ее поражениях. Большой клинический интерес представляет изучение реактивности организма на сахарную нагрузку у здорового и больного человека. В связи с этим в клинике довольно часто исследуют изменения во времени уровня глюкозы в крови, обычно после приема per os 50 г или 100 г глюкозы, растворенной в теплой воде,– так называемая сахарная нагрузка. При оценке построенных гликемических кривых обращают внимание на время максимального подъема, высоту этого подъема и время возврата концентрации глюкозы к исходному уровню. Для оценки гликемических кривых введено несколько показателей, из которых наиболее важное значение имеет коэффициент Бодуэна: где А – уровень глюкозы в крови натощак; В – максимальное содержание глюкозы в крови после нагрузки глюкозой. В норме этот коэффициент составляет около 50%. Значения, превышающие 80%, свидетельствуют о серьезном нарушении обмена углеводов. Гипогликемия. Нередко гипогликемия связана с понижением функций тех эндокринных желез, повышение функций которых приводит, как отмечалось, к гипергликемии. В частности, гипогликемию можно наблюдать при гипофизарной кахексии, аддисоновой болезни, гипотиреозе. Резкое снижение уровня глюкозы в крови отмечается при аденомах поджелудочной железы вследствие повышенной продукции инсулина β-клетками панкреатических островков. Кроме того, гипогликемия может быть вызвана голоданием, продолжительной физической работой, приемом β-ганглиоблока-торов. Низкий уровень глюкозы в крови иногда отмечается при беременности, лактации. Гипогликемия может возникнуть при введении больным сахарным диабетом больших доз инсулина. Как правило, она сопровождает почечную глюкозурию, возникающую вследствие снижения «почечного порога» для глюкозы. Глюкозурия. Обычно присутствие глюкозы в моче (глюкозурия) является результатом нарушения углеводного обмена вследствие патологических изменений в поджелудочной железе (сахарный диабет, острый панкреатит и т.д.). Реже встречается глюкозурия почечного происхождения, связанная с недостаточностью резорбции глюкозы в почечных канальцах. Как временное явление глюкозурия может возникнуть при некоторых острых инфекционных и нервных заболеваниях, после приступов эпилепсии, сотрясения мозга. Отравления морфином, стрихнином, хлороформом, фосфором также обычно сопровождаются глюкозурией. Наконец, необходимо помнить о глюкозурии алиментарного происхождения, глюкозурии беременных и глюкозурии при нервных стрессовых состояниях (эмоциональная глюкозурия). Изменение углеводного обмена при гипоксических состояниях. Отставание скорости окисления пирувата от интенсивности гликолиза наблюдается чаще всего при гипоксических состояниях, обусловленных различными нарушениями кровообращения или дыхания, высотной болезнью, анемией, понижением активности системы тканевых окислительных ферментов при некоторых инфекциях и интоксикациях, гипо- и авитаминозах, а также в результате относительной гипоксии при чрезмерной мышечной работе. При усилении гликолиза происходит накопление пирувата и лактата в крови, что сопровождается обычно изменением кислотно-основного равновесия, уменьшением щелочных резервов крови. Увеличение содержания лактата и пирувата в крови может наблюдаться также при поражениях паренхимы печени (поздние стадии гепатита, цирроз печени и т.п.) в результате торможения процессов глюконеогенеза в печени. Гликогенозы. Ряд наследственных болезней связан с нарушением обмена гликогена. Эти болезни получили название гликогенозов. Они возникают в связи с дефицитом или полным отсутствием ферментов, катализирующих процессы распада или синтеза гликогена, и характеризуются избыточным его накоплением в различных органах и тканях (табл. 10.2). Гликогеноз I типа (болезнь Гирке) встречается наиболее часто, обусловлен наследственным дефектом синтеза фермента глюкозо-6-фосфатазы в печени и почках. Болезнь наследуется по аутосомно-рецессивному типу. Патологические симптомы появляются уже на первом году жизни ребенка: увеличена печень, нередко увеличены почки. В результате гипогликемии появляются судороги, задержка роста, возможен ацидоз. В крови – повышенное количество лактата и пирувата. Введение адреналина или глюка-гона вызывает значительную гиперлактатацидемию, но не гипергликемию, так как глюкозо-6-фосфатаза в печени отсутствует и образования свободной глюкозы не происходит. Предыдущая страница | Следующая страница СОДЕРЖАНИЕ |