Метформин от чего помогает: Аптека Ригла – забронировать лекарства в аптеке и забрать самовывозом по низкой цене в Москва г.
Препарат от сахарного диабета оказался полезен при заболеваниях репродуктивной системы
17 февраля, 2021 11:13
Источник: ТАСС
Российский ученый установил, что популярный препарат от сахарного диабета – метформин – эффективен при лечении заболеваний репродуктивной системы. В частности, он помогает восстановливаться работе яичников и семенников у пациентов с гормональными проблемами и бесплодием. Результаты работы опубликовал научный журнал Pharmaceuticals (Basel), кратко об этом пишет пресс-служба Российского научного фонда (РНФ).
Источник: Пресс-служба РНФ
“Исследование открывает новые направления применения метформина как фармакологического препарата, улучшающего репродуктивные функции у женщин и мужчин при эндокринной патологии.
Также есть перспективы применения метформина для повышения эффективности вспомогательных репродуктивных технологий”, – отметил автор работы, сотрудник Института эволюционной физиологии и биохимии им. Сеченова (ИЭФБ) РАН Александр Шпаков.
Метформин прописывают при сахарном диабете второго типа и метаболическом синдроме. Эти заболевания связаны с нарушениями гормонального фона и обмена веществ. У здорового человека инсулин помогает клеткам захватывать глюкозу – основной источник энергии. При диабете и метаболическом синдроме ткани плохо распознают инсулин и не пропускают глюкозу в клетки. А метформин повышает чувствительности тканей к инсулину, снижает уровень “вредного” холестерина и способствует похудению.
Шпаков решил выяснить, как этот препарат действует на репродуктивную систему мужчин и женщин. Клинические исследования подтвердили, что метформин не только улучшает работу репродуктивной системы у представителей обоих полов, но и благотворно влияет на здоровье новорожденных.
Метформин может помочь в лечении синдрома поликистозных яичников, которым болеют 9-18% женщин репродуктивного возраста и 30% женщин с диабетом и метаболическим синдромом. Клиническое исследование показало, что у большинства женщин с синдромом поликистозных яичников метформин повышает частоту овуляций почти в два раза. Это увеличивает вероятность забеременеть с 24% до 46%.
В то же время исследователи отмечают, что для повышения положительного эффекта метформина его необходимо принимать с препаратами, которые улучшают функцию яичников. Лучшие результаты были получены при комбинировании метформина с одним из таких лекарственных средств – кломифен-цитратом.
Теги
Президентская программа, Медицина, Спецпроект, Инфраструктурные проекты
Влияние метформина и манинила на показатели липидного обмена у больных сахарным диабетом типа 2 | Давыдов
Сердечно-сосудистая патология является основной причиной заболеваемости и смертности у больных сахарным диабетом (СД) типа 2. Дислипидемия (ДЛП), избыточная масса тела и артериальная гипертензия — основные факторы высокого риска поражения сердца и сосудов при СД [5, 12]. Характерной чертой липидного профиля крови у больных СД типа 2 является повышение уровня общего холестерина (ОХС), триглицеридов (ТГ), холестерина липопротеинов низкой (ХС ЛПНП), очень низкой (ХС ЛПОНП) и снижение концентрации холестерина липопротеинов высокой плотности (ХС ЛПВП). По алгоритмам биохимического фенотипирования липидов у больных СД типа 2 обычно выявляется ДЛП классов 2А, 2Б или 4 [2, 3].
Дислипидемия (ДЛП), избыточная масса тела и артериальная гипертензия — основные факторы высокого риска поражения сердца и сосудов при СД [5, 12]. Характерной чертой липидного профиля крови у больных СД типа 2 является повышение уровня общего холестерина (ОХС), триглицеридов (ТГ), холестерина липопротеинов низкой (ХС ЛПНП), очень низкой (ХС ЛПОНП) и снижение концентрации холестерина липопротеинов высокой плотности (ХС ЛПВП). По алгоритмам биохимического фенотипирования липидов у больных СД типа 2 обычно выявляется ДЛП классов 2А, 2Б или 4 [2, 3].
Наиболее распространенными препаратами, применяемыми у больных СД типа 2, остаются производные сульфонилмочевины и бигуаниды. Характер изменений липидного профиля крови под влиянием производных сульфонилмочевины изучен недостаточно. Особый интерес представляют бигуаниды, влияющие не только на гликемию, но и на содержание липидов в плазме крови [1, 6, 15]. Показано, что метформин уменьшает всасывание глюкозы в кишечнике, снижает активность глюконеогенеза [8]. Однако многие аспекты действия бигуанидов остаются малоизученными. Недостаточно данных о влиянии этих препаратов на гормональные регуляторы липидного обмена.
Однако многие аспекты действия бигуанидов остаются малоизученными. Недостаточно данных о влиянии этих препаратов на гормональные регуляторы липидного обмена.
Целью настоящего исследования явилось изучение влияния бигуанидов и производных сульфонилмочевины на содержание липидов, иммунореактивного инсулина (ИРИ) и соматотропного гормона (СТГ) в плазме крови у больных СД типа 2.
Материалы и методы
Обследовано 38 больных СД типа 2 в возрасте 35—55 лет (12 мужчин и 26 женщин), из них 24 пациента (7 мужчин и 17 женщин) имели нормальную массу тела (индекс массы тела — И МТ — < 26 ед.), а 14 больных (5 мужчин и 9 женщин) — избыточную массу тела (ИМТ > 27 ед.). У 14 человек была легкая, а у 24 — среднетяжелая форма заболевания. Все больные находились в состоянии компенсации углеводного обмена (гликированный гемоглобин — НЬ А]С — 7,29 ± 0,21%; гликемия натощак не выше
- ммоль/л; постпрандиальная гликемия не выше
- ммоль/л; глюкозурия 28,62 ±3,12 г/сут; явления кетоза отсутствовали) и на протяжении определенного времени (от 1 года до 3 лет) получали манинил в дозе 0,005—0,015 г/сут.

Все больные методом простой рандомизации с использованием таблиц случайных чисел были разделены на 2 группы. Основную группу (18 человек: 8 мужчин, 10 женщин) составили больные СД типа 2, которым в дальнейшем в качестве монотерапии назначен метформин. Контрольную группу составили 20 больных диабетом (4 мужчины, 16 женщин), которые продолжали получать манинил. Для сравнительного анализа биохимических показателей использовали кровь, взятую из локтевой вены у 10 здоровых лиц среднего возраста (4 мужчин, 6 женщин).
В исследование не включали пациентов, страдающих тяжелыми дыхательными, сердечно-сосудистыми расстройствами, застойной сердечной недостаточностью, болезнями печени, беременных и кормящих женщин, пациентов с диабетической нефропатией, лиц, злоупотребляющих алкоголем, и больных СД с тяжелым общим состоянием. Курс монотерапии метформином составил 3 мес. Больные СД получали препарат однократно вечером после ужина в дозе 0,85 г.
Общеклиническое и клинико-биохимическое обследование проводили до и после курса лечения. Содержание ИРИ в плазме определяли с помощью реактивов фирмы “Dako” (Дания), концентрацию СТГ — с помощью наборов фирмы “Biomar HJH Elisa” (Германия), содержание глюкозы в крови — глюкозооксидазным методом [4]. Содержание ОХС и ТГ определяли с помощью тестов фирмы “Randox” на автоанализаторе “Centrifichem-600”; ХС ЛПВП — на автоанализаторе “Technicon ААР” (США) после осаждения из плазмы ЛПНП и ЛПОНП фосфорновольфрамовой кислотой. Уровень ХС ЛПНП и ХС ЛПОНП вычисляли по формулам W. Friedwald и соавт. [11].
Содержание ИРИ в плазме определяли с помощью реактивов фирмы “Dako” (Дания), концентрацию СТГ — с помощью наборов фирмы “Biomar HJH Elisa” (Германия), содержание глюкозы в крови — глюкозооксидазным методом [4]. Содержание ОХС и ТГ определяли с помощью тестов фирмы “Randox” на автоанализаторе “Centrifichem-600”; ХС ЛПВП — на автоанализаторе “Technicon ААР” (США) после осаждения из плазмы ЛПНП и ЛПОНП фосфорновольфрамовой кислотой. Уровень ХС ЛПНП и ХС ЛПОНП вычисляли по формулам W. Friedwald и соавт. [11].
Для оценки функционального состояния инсулярного аппарата и степени нарушений углеводного обмена использовали 2-часовой тест смешанной пищевой нагрузки (300 ккал; 80% углеводов, 20% белков и жиров). Тест проводили после 12-часового голодания на фоне отмены приема манинила в день обследования. Содержание глюкозы в капиллярной крови и ИРИ в плазме определяли натощак, через 60 и 120 мин после стандартной пищевой нагрузки.
Статистический анализ проводили с помощью программы Stat View, результаты считали достоверными при р < 0,05.
Результаты и их обсуждение
На момент первичного обследования все больные СД типа 2 находились в состоянии компенсации углеводного обмена. Все пациенты методом простой рандомизации были разделены на 2 группы, сопоставимые по полу, возрасту, характеру клиникобиохимических изменений и выраженности соматических расстройств. Основную группу составили больные СД типа 2, которым назначили метформин; в контрольную группу включены пациенты, продолжающие прием манинила в дозе 0,005— 0,015 г/сут.
Уровни гликемии натощак в основной и контрольной группах достоверно не различались и составили 7,54 ± 1,18 и 7,49 ± 1,11 ммоль/л соответственно. Пищевая стимуляция приводила к увеличению содержания глюкозы в крови у всех больных СД типа 2 на всех этапах исследования. Через 60 мин после пищевой нагрузки уровень глюкозы у больных основной группы составлял 13,9 ± 0,19 ммоль/л  Через 120 мин концентрация глюкозы составляла 12,8 ±0,12 ммоль/л в основной и 11,9 ± 0,25 ммоль/л в контрольной группе. Гликемия на 120-й минуте не отличалась от аналогичного показателя на 60-й минуте.
Через 120 мин концентрация глюкозы составляла 12,8 ±0,12 ммоль/л в основной и 11,9 ± 0,25 ммоль/л в контрольной группе. Гликемия на 120-й минуте не отличалась от аналогичного показателя на 60-й минуте.
Результаты лечения метформином оценивали через 3 мес. После лечения метформином у всех больных СД наблюдалось снижение содержания глюкозы в крови натощак на 18% (до 6,23 ± 1,04 ммоль/л) и снижение постпрандиальной гликемии. Степень снижения постпрандиальной гликемии зависела от И МТ. После лечения метформином у больных СД типа 2 с И МТ < 26 ед. содержание глюкозы на 60-й минуте после пищевой нагрузки составляло 9,8 ±0,11 ммоль/л, что на 23% ниже аналогичного показателя до лечения, а на 120-й минуте концентрация глюкозы в крови была равна 10,9 ± 0,14 ммоль/л, что на 15% ниже показателя до лечения. У больных СД типа 2 с И МТ > 27 ед. отмечалось достоверное снижение гликемии на 60-й и 120-й минуте после пищевой нарузки. На 60-й минуте пробы концентрация глюкозы составляла 10,1 ± 0,84 ммоль/л, на 120-й минуте — 8,6 ± 0,25 ммоль/л, что на 23 и 31% соответственно ниже аналогичных показателей до лечения метформином (р < 0,05).
У больных СД типа 2 с ИМТ < 26 ед. уровень базальной секреции ИРИ до лечения находился в пределах нормы, а у пациентов с избыточной массой тела отмечались повышение концентрации ИРИ натощак (р < 0,05) и выраженная постпрандиальная гиперинсулинемия (р < 0,05). После курса лечения метформином наблюдалось снижение базальной и стимулированной секреции ИРИ, особенно выраженное у больных с ИМТ > 27 ед. У этих пациентов постпрандиальная инсулинемия на 60-й минуте теста снижалась на 44%, на 120-й минуте — на 58% (см. рисунок).
Несмотря на компенсацию основного заболевания, у 94% больных СД типа 2 отмечалась выраженная ДЛП за счет гипертриглицеридемии, повы-
Изменение базальной и стимулированной секреции ИРИ (в мкЕД/мл) у больных СД типа 2 при лечении метформином и манинилом.
лИМТ < 26 ед.; <5 — ИМТ > 27 ед.
/ — базальная секреция ИРИ; 2 — через 60 мин после пишевой нагрузки; 3 — через 120 мин после пишевой нагрузки.
/ — до лечения; // — манинил; /// — метформин.
Влияние метформина на состояние липидного обмена у больных СД типа 2 с различной массой тела (М ± т)
Показатель | ИМТ< 26 ед. | ИМТ > 27 ед. | ||
первичное обследование до лечения | через 3 мес после лече ния | первичное обследование до лечения | через 3 мес после лечения | |
ОХС, ммоль/л | 5,46 ± 0,82 | 4,89 ± 0,75 | 6,22 ± 0,55 | 5.00 ± 0,09* |
ТГ, ммоль/л | 2,74 ± 0,27 | 1,46 ±0,25* | 3,37 ± 0,07 | 1,84 ± 0.08* |
ХС ЛПВП, ммоль/л | 1,28 ± 0.17 | 1,54 ± 0.21 | 1,37 ± 0,16 | 1.38 ± 0.18 |
ХС ЛПНП, ммоль/л | 2,98 ± 0,41 | 2,60 ± 0,20 | 3,27 ± 0,14 | 2. |
YC ЛПОНП, ммоль/л | 1,25 ± 0,18 | 0,68 ± 0.09* | 1,62 ± 0,34 | 0,80 ± 0.06* |
СТГ. нг/мл | 1,22 ± 0,27 | 1,35 ± 0,13 | 0,44 ±0,10 | 3,27 ± 0,62* |
Примечание. Звездочка — достоверность (р < 0,05) различия показателей с аналогичными показателями до лечения.
шения уровня ХС ЛПОНП и ХС ЛПНП. После курса лечения метформином наблюдалось снижение содержания липидов в крови у пациентов как с нормальной, так и с избыточной массой тела (см. таблицу). Если у больных диабетом с ИМТ < 26 ед. снижался только уровень ТГ и ХС ЛПОНП, то у больных с избыточной массой тела отмечалось снижение содержания ОХС, ТГ, ХС ЛПОНП и повышение до нормы концентрации СТГ.
Анализ биохимических показателей у больных СД контрольной группы, которые продолжали получать манинил, выявил существенные различия по сравнению с аналогичными показателями у пациентов основной группы. Применение манинила снижало гликемию натощак только на 5% (до уровня 7,21 ±1,13 ммоль/л). Постпрандиальная гликемическая реакция существенно не менялась и не зависела от ИМТ. У больных СД типа 2 с нормальной массой тела, которые продолжали прием манинила в течение 3 мес, содержание глюкозы через 60 мин после пищевой нагрузки составляло 12,8 ± 0,62 ммоль/л, через 120 мин — 10,9 ± 0,24 ммоль/л, что не отличалось от аналогичных показателей при первичном обследовании. У больных СД типа 2 с избыточной массой тела характер гликемической реакции на прием пищи сохранялся: уровень глюкозы на 60-й минуте пробы составлял 12,9 ±1,11 ммоль/л, а на 120-й минуте — 12,0 ± 1,01 ммоль/л. Некоторое различие в характере гликемической реакции на 120-й минуте после пищевой нагрузки, по-видимому, обусловлено более выраженной гиперинсулинемией у больных СД типа 2 с ИМТ > 27 ед.
Применение манинила снижало гликемию натощак только на 5% (до уровня 7,21 ±1,13 ммоль/л). Постпрандиальная гликемическая реакция существенно не менялась и не зависела от ИМТ. У больных СД типа 2 с нормальной массой тела, которые продолжали прием манинила в течение 3 мес, содержание глюкозы через 60 мин после пищевой нагрузки составляло 12,8 ± 0,62 ммоль/л, через 120 мин — 10,9 ± 0,24 ммоль/л, что не отличалось от аналогичных показателей при первичном обследовании. У больных СД типа 2 с избыточной массой тела характер гликемической реакции на прием пищи сохранялся: уровень глюкозы на 60-й минуте пробы составлял 12,9 ±1,11 ммоль/л, а на 120-й минуте — 12,0 ± 1,01 ммоль/л. Некоторое различие в характере гликемической реакции на 120-й минуте после пищевой нагрузки, по-видимому, обусловлено более выраженной гиперинсулинемией у больных СД типа 2 с ИМТ > 27 ед.
Базальная секреция ИРИ у больных контрольной группы зависела от ИМТ (см. рисунок). Применение манинила в средних терапевтических дозах не сопровождалось изменениями содержания ИРИ натощак, не оказывало влияния на постпрандиальную инсулинемию, липидный профиль и концентрацию СТГ в плазме; не выявлено достоверного изменения содержания ОХС, ТГ, ХС ЛПВП. ХС ЛПНП, ХС ЛПОНП.
ХС ЛПНП, ХС ЛПОНП.
Таким образом, наши исследования показали, что имеются некоторые различия влияния бигуанидов и препаратов сульфонилмочевины на углеводный, липидный обмен и их гормональные регуляторы.
Несмотря на компенсацию диабета по гликемии, у большинства больных СД типа 2 при первичном обследовании отмечалась ДЛП, а у больных с избыточной массой тела — базальная и стимулированная гиперинсулинемия. Используя алгоритмы фенотипирования липидов, мы распределили больных СД типа 2 с ДЛП в зависимости от ее характера и степени выраженности. Выявлено, что среди больных диабетом с ИМТ < 26 ед. 30% обследованных имели признаки ДЛП классов 2А или 2Б, а 70% — ДЛП класса 4 (по классификации ВОЗ; 1985) [13], для которого характерно значительное повышение содержания ТГ и ХС ЛПОНП при нормальном или умеренно повышенном уровне ОХС. Большинство (89%) больных СД типа 2 с ИМТ > 27 ед. имели признаки ДЛП класса 2Б, для которого характерны значительное повышение уровня ОХС, ТГ, ХС ЛПНП, ХС ЛПОНП и высокий риск развития ИБС [2, 3].
При первичном обследовании нами было выявлено снижение содержания СТГ в плазме крови у больных СД типа 2 с избыточной массой тела. Описано, что дефицит СТГ способствует развитию гипертриглицеридемии [14], может приводить к повышению содержания ОХС, ХС ЛПОНП [10] и усиливать проявления тканевой гипоксии [10]. Снижение секреции СТГ может быть обусловлено как хронической гипергликемией [7], так и уменьшением интенсивности процессов окисления свободных жирных кислот при ожирении [9].
После курса лечения метформином мы наблюдали значительное снижение содержания липидов в плазме крови у больных диабетом с ДЛП. Выраженность гиполипидемического эффекта препарата зависела от исходной концентрации липидов. По-видимому, этот эффект обусловлен влиянием метформина на липогенез. Показано, что антиатерогенное действие свойственно непосредственно самому метформину и не связано с качеством гликемического контроля, характером компенсации углеводного обмена и снижением массы тела [6]. Экспериментально доказано, что метформин снижает синтез ТГ и ЛПОНП в печени [8].
Экспериментально доказано, что метформин снижает синтез ТГ и ЛПОНП в печени [8].
На фоне приема манинила гиполипидемического эффекта не наблюдалось. Незначительное повышение уровня ТГ у 18% больных СД типа 2, принимающих манинил на протяжении от 1 года до 3 лет, могло быть связано с тем, что, стимулируя эндогенную секрецию инсулина, этот препарат стимулировал липогенез и способствовал синтезу ТГ в печени [1].
Прием метформина сопровождался снижением базальной и стимулированной секреции инсулина одновременно со снижением уровня глюкозы в крови. Особенно выраженным этот эффект был у больных СД типа 2 с ИМТ > 27 ед. и гиперинсулинемией. В этих случаях мы отмечали снижение постпрандиальной инсулинемии на 44% на 60-й минуте и на 58% на 120-й минуте. Это подтверждает факт оптимального действия метформина при гиперинсулинемии [6]. После лечения метформином у больных СД типа 2 с избыточной массой тела на фоне снижения уровня липидов отмечалась нормализация содержания СТГ в плазме крови. Нами выявлена обратная корреляция средней силы между степенью снижения уровня ТГ и увеличением концентрации СТГ в плазме крови натощак (г = —0,538; р < 0,001).
Нами выявлена обратная корреляция средней силы между степенью снижения уровня ТГ и увеличением концентрации СТГ в плазме крови натощак (г = —0,538; р < 0,001).
У больных диабетом, которые продолжали получать лечение манинилом, мы не наблюдали достоверных изменений со стороны основных гормонально-метаболических показателей. Незначительное улучшение гликемического контроля не сопровождалось значимыми изменениями со стороны липидного спектра плазмы, не наблюдалось существенного изменения содержания ИРИ и СТГ.
Таким образом, проведенные исследования показали, что применение метформина у больных СД типа 2 на протяжении 3 мес существенно улучшало показатели углеводного, липидного обмена и приводило к нормализации содержания инсулина и СТГ в плазме крови. Полученные результаты по изучению влияния данного препарата на уровень ТГ и постпрандиальную гиперинсулинемию характеризуют направленность действия метформина на патогенетические механизмы инсулинорезистентности.
Выводы
- Применение метформина, помимо нормализации гликемии, приводило к выраженному снижению постпрандиальной инсулинемии, чего не отмечено при лечении манинилом.

- Курсовое лечение метформином в отличие от приема манинила снижало содержание атерогенных фракций липидов, особенно у больных СД типа 2 с избыточной массой тела и гипертриглицеридемией.
- Гиполипидемический эффект метформина у больных СД типа 2 с избыточной массой тела сопровождался нормализацией содержания СТГ в плазме крови, что не исключает возможности участия этого гормона в процессах регуляции липидного обмена.
Метформин и его преимущества при различных заболеваниях
1. Bailey CJ. Метформин: исторический обзор. Диабетология. (2017) 60:1566–76. 10.1007/s00125-017-4318-z [PubMed] [CrossRef] [Google Scholar]
2. Duncan LJ, Clarke BF. Фармакология и механизм действия гипогликемических сульфонилмочевины и дигуанидов. Анну Рев Фармакол. (1965) 5:151–62. 10.1146/annurev.pa.05.040165.001055 [PubMed] [CrossRef] [Google Scholar]
3. Виттерс Л.А. Цветение французской сирени. Джей Клин Инвест. (2001) 108:1105–7. 10.1172/JCI14178 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Папананьоу П., Стивару Т., Цирони М.
Неиспользованные противоопухолевые эффекты коммерчески доступных противодиабетических препаратов. Фармацевтика. (2016) 9:24
10.3390/ph
Папананьоу П., Стивару Т., Цирони М.
Неиспользованные противоопухолевые эффекты коммерчески доступных противодиабетических препаратов. Фармацевтика. (2016) 9:24
10.3390/ph
24 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Блондин Л., Дипп С., Кадена Д. Планы комбинированной сахароснижающей терапии при СД2: рассмотрение на основе клинических случаев. Adv Ther. (2018) 35:939–65. 10.1007/s12325-018-0694-0 [PubMed] [CrossRef] [Google Scholar]
6. Gandini S, Puntoni M, Heckman-Stoddard BM, Dunn BK, Ford L, Decensi A, et al. Метформин и рак риск и смертность: систематический обзор и метаанализ с учетом погрешностей и искажающих факторов. Рак Пред. Рез. (2014) 7:867–85. 10.1158/1940-6207.CAPR-13-0424 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Morales DR, Morris AD. Метформин в лечении и профилактике рака. Анну Рев Мед. (2015) 66:17–29. 10.1146/annurev-med-062613-093128 [PubMed] [CrossRef] [Google Scholar]
8. Lamanna C, Monami M, Marchionni N, Mannucci E. Влияние метформина на сердечно-сосудистые события и смертность: метаанализ рандомизированных клинические испытания. Сахарный диабет Ожирение Metab. (2011) 13:221–8. 10.1111/ж.1463-1326.2010.01349.x [PubMed] [CrossRef] [Google Scholar]
Влияние метформина на сердечно-сосудистые события и смертность: метаанализ рандомизированных клинические испытания. Сахарный диабет Ожирение Metab. (2011) 13:221–8. 10.1111/ж.1463-1326.2010.01349.x [PubMed] [CrossRef] [Google Scholar]
9. Бхат А., Себастьяни Г., Бхат М. Систематический обзор: профилактическое и терапевтическое применение метформина при заболеваниях печени. Мир J Гепатол. (2015) 7:1652–9. 10.4254/wjh.v7.i12.1652 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Breining P, Jensen JB, Sundelin EI, Gormsen LC, Jakobsen S, Busk M, et al.. Метформин воздействует на бурую жировую ткань in vivo и снижает потребление кислорода in vitro . Сахарный диабет Ожирение Metab. (2018) 20:2264–73. 10.1111/dom.13362 [PubMed] [CrossRef] [Google Scholar]
11. Patrone C, Eriksson O, Lindholm D. Лекарства от диабета и неврологические расстройства: новые взгляды и терапевтические возможности. Ланцет Диабет Эндокринол. (2014) 2: 256–62. 10.1016/S2213-8587(13)70125-6 [PubMed] [CrossRef] [Google Scholar]
10.1016/S2213-8587(13)70125-6 [PubMed] [CrossRef] [Google Scholar]
12. Neven E, Vervaet B, Brand K, Gottwald-Hostalek U, Opdebeeck B, De Mare A, et al.. Метформин предотвращает развитие тяжелой хронической болезни почек и связанных с ней минеральных и костных нарушений. почки инт. (2018) 94:102–13. 10.1016/j.kint.2018.01.027 [PubMed] [CrossRef] [Google Scholar]
13. Batandier C, Guigas B, Detaille D, El-Mir MY, Fontaine E, Rigoulet M, et al. Производство АФК, индуцированное обратным потоком электронов в комплексе 1 дыхательной цепи, подавляется метформином. J Биоэнергетическая биомембрана. (2006) 38:33–42. 10.1007/s10863-006-9003-8 [PubMed] [CrossRef] [Google Scholar]
14. Viollet B, Guigas B, Sanz Garcia N, Leclerc J, Foretz M, Andreelli F. Клеточные и молекулярные механизмы действия метформина: обзор. Клин наук =. (2012) 122: 253–70. 10.1042/CS20110386 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Zhou G, Myers R, Li Y, Chen Y, Shen X, Fenyk-Melody J и др. . Роль AMP-активируемой протеинкиназы в механизме действия метформина. Джей Клин Инвест. (2001) 108:1167–74. 10.1172/JCI13505 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
. Роль AMP-активируемой протеинкиназы в механизме действия метформина. Джей Клин Инвест. (2001) 108:1167–74. 10.1172/JCI13505 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Pryor R, Cabreiro F. Перепрофилирование метформина: старый препарат с новыми хитростями в карманах. Биохим Дж. (2015) 471:307–22. 10.1042/BJ20150497 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Zhang CS, Li M, Ma T, Zong Y, Cui J, Feng JW и др.. Метформин активирует AMPK через лизосомальный путь. Клеточный метаб. (2016) 24:521–2. 10.1016/j.cmet.2016.09.003 [PubMed] [CrossRef] [Google Scholar]
18. Hardie DG, Ross FA, Hawley SA. AMPK: датчик питательных веществ и энергии, поддерживающий энергетический гомеостаз. Nat Rev Mol Cell Biol. (2012) 13:251–62. 10.1038/nrm3311 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Lin SC, Hardie DG. AMPK: определение уровня глюкозы, а также энергетического статуса клеток. Клеточный метаб. (2018) 27: 299–313. 10.1016/j.cmet.2017.10.009 [PubMed] [CrossRef] [Google Scholar]
10.1016/j.cmet.2017.10.009 [PubMed] [CrossRef] [Google Scholar]
20. Martin M, Marais R. Метформин: лекарство от диабета для лечения рака или лекарство от рака для диабетиков? Дж. Клин Онкол. (2012) 30:2698–700. 10.1200/JCO.2012.42.1677 [PubMed] [CrossRef] [Google Scholar]
21. Stynen B, Abd-Rabbo D, Kowarzyk J, Miller-Fleming L, Aulakh SK, Garneau P, et al. Изменения клеток биохимические состояния выявляются в динамике белковых гомомерных комплексов. Клетка. (2018) 175:1418–29. 10.1016/j.cell.2018.09.050 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Defronzo RA, Goodman AM. Эффективность метформина у больных инсулиннезависимым сахарным диабетом. Многоцентровая исследовательская группа по метформину. N Engl J Med. (1995) 333:541–9. 10.1056/NEJM199508313330902 [PubMed] [CrossRef] [Google Scholar]
23. Garber AJ, Duncan TG, Goodman AM, Mills DJ, Rohlf JL. Эффективность метформина при диабете II типа: результаты двойного слепого плацебо-контролируемого исследования доза-ответ. Am J Med. (1997) 103:491–7. 10.1016/S0002-9343(97)00254-4 [PubMed] [CrossRef] [Google Scholar]
Am J Med. (1997) 103:491–7. 10.1016/S0002-9343(97)00254-4 [PubMed] [CrossRef] [Google Scholar]
24. Kahn SE, Haffner SM, Heise MA, Herman WH, Holman RR, Jones NP, et al. Гликемическая устойчивость при монотерапии розиглитазоном, метформином или глибуридом. N Engl J Med. (2006) 355:2427–43. 10.1056/NEJMoa066224 [PubMed] [CrossRef] [Google Scholar]
25. Charpentier G, Fleury F, Kabir M, Vaur L, Halimi S. Улучшение гликемического контроля путем добавления глимепирида к монотерапии метформином у пациентов с диабетом 2 типа. Диабет Мед. (2001) 18:828–34. 10.1046/j.1464-5491.2001.00582.x [PubMed] [CrossRef] [Google Scholar]
26. Fonseca V, Rosenstock J, Patwardhan R, Salzman A. Эффект комбинированной терапии метформином и розиглитазоном у пациентов с сахарным диабетом 2 типа mellitus: рандомизированное контролируемое исследование. ДЖАМА. (2000) 283:1695–702. 10.1001/jama.283.13.1695 [PubMed] [CrossRef] [Google Scholar]
27. Rosenstock J, Chuck L, Gonzalez-Ortiz M, Merton K, Craig J, Capuano G, et al. Начальная комбинированная терапия канаглифлозином плюс метформин по сравнению с каждым компонентом монотерапия нелекарственного диабета 2 типа. Уход за диабетом. (2016) 39:353–62. 10.2337/dc15-1736 [PubMed] [CrossRef] [Google Scholar]
Начальная комбинированная терапия канаглифлозином плюс метформин по сравнению с каждым компонентом монотерапия нелекарственного диабета 2 типа. Уход за диабетом. (2016) 39:353–62. 10.2337/dc15-1736 [PubMed] [CrossRef] [Google Scholar]
28. Softeland E, Meier JJ, Vangen B, Toorawa R, Maldonado-Lutomirsky M, Broedl UC. Эмпаглифлозин в качестве дополнительной терапии у пациентов с сахарным диабетом 2 типа, недостаточно контролируемым линаглиптином и метформином: 24-недельное рандомизированное двойное слепое исследование с параллельными группами. Уход за диабетом. (2017) 40: 201–9. 10.2337/dc16-1347 [PubMed] [CrossRef] [Google Scholar]
29. Yki-Jarvinen H, Ryysy L, Nikkila K, Tulokas T, Vanamo R, Heikkila M. Сравнение режимов инсулинотерапии перед сном у пациентов с диабетом 2 типа сахарный диабет Рандомизированное контролируемое исследование. Энн Интерн Мед. (1999) 130:389–96. 10.7326/0003-4819-130-5-1990-00002 [PubMed] [CrossRef] [Google Scholar]
30. Wulffele MG, Kooy A, Lehert P, Bets D, Ogterop JC, Borger Van Der Burg B, et al. .. Комбинация инсулина и метформина в лечении сахарного диабета 2 типа. Уход за диабетом. (2002) 25:2133–40. 10.2337/diacare.25.12.2133 [PubMed] [CrossRef] [Google Scholar]
.. Комбинация инсулина и метформина в лечении сахарного диабета 2 типа. Уход за диабетом. (2002) 25:2133–40. 10.2337/diacare.25.12.2133 [PubMed] [CrossRef] [Google Scholar]
31. Линь И., Ван К., Ма С., Ван Х., Гонг З., Чжан Р. и др. Оценка метформина в отношении улучшения когнитивных функций у пациентов с сосудистыми когнитивными нарушениями, не связанными с деменцией, и аномальным метаболизмом глюкозы. Front Aging Neurosci. (2018) 10:227 10.3389/fnagi.2018.00322 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Li Y, Tan J, Wang Q, Duan C, Hu Y, Huang W. Сравнение индивидуальных эффектов метформина и розиглитазона и их комбинация у женщин с ожирением и синдромом поликистозных яичников: рандомизированное контролируемое исследование. Фертил Стерил. (2019) 113:197–204. 10.1016/j.fertnstert.2019.09.011 [PubMed] [CrossRef] [Google Scholar]
33. Rowan JA, Hague WM, Gao W, Battin MR, Moore MP. Метформин в сравнении с инсулином для лечения гестационного диабета. N Engl J Med. (2008) 358:2003–15. 10.1056/NEJMoa0707193 [PubMed] [CrossRef] [Google Scholar]
N Engl J Med. (2008) 358:2003–15. 10.1056/NEJMoa0707193 [PubMed] [CrossRef] [Google Scholar]
34. Rowan JA, Rush EC, Plank LD, Lu J, Obolonkin V, Coat S, et al. Метформин при гестационном диабете: последующее наблюдение за потомством ( МиГ ТОФУ): состав тела и метаболические показатели в 7-9 летвозраст. BMJ Open Diabetes Res Care. (2018) 6:e000456. 10.1136/bmjdrc-2017-000456 [бесплатная статья ЧВК] [PubMed] [CrossRef] [Google Scholar]
35. Черный ДЗИ, Лам ТКТ. Внутреннее ощущение метформина. Клеточный метаб. (2018) 28:808–10. 10.1016/j.cmet.2018.11.012 [PubMed] [CrossRef] [Google Scholar]
36. Shaw RJ, Lamia KA, Vasquez D, Koo SH, Bardeesy N, Depinho RA, et al. Киназа LKB1 опосредует глюкозу гомеостаз в печени и терапевтические эффекты метформина. Наука. (2005) 310:1642–6. 10.1126/science.1120781 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Fullerton MD, Galic S, Marcinko K, Sikkema S, Pulinilkunnil T, Chen ZP, et al. Отдельные сайты фосфорилирования в Acc1 и Acc2 регулируют липидный гомеостаз и сенсибилизирующие инсулин эффекты метформина. Нат Мед. (2013) 19:1649–54. 10.1038/nm.3372 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нат Мед. (2013) 19:1649–54. 10.1038/nm.3372 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Foretz M, Hebrard S, Leclerc J, Zarrinpashneh E, Soty M, Mithieux G и др. Метформин ингибирует глюконеогенез в печени у мышей независимо от пути LKB1/AMPK посредством снижения энергетического состояния печени. Джей Клин Инвест. (2010) 120: 2355–69. 10.1172/JCI40671 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Madiraju AK, Erion DM, Rahimi Y, Zhang XM, Braddock DT, Albright RA, et al.. Метформин подавляет глюконеогенез путем ингибирования митохондриального глицерофосфатдегидрогеназы. Природа. (2014) 510:542–6. 10.1038/nature13270 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. He L, Sabet A, Djedjos S, Miller R, Sun X, Hussain MA, et al.. Метформин и инсулин подавляют глюконеогенез в печени. фосфорилированием CREB-связывающего белка. Клетка. (2009 г.) 137:635–46. 10.1016/j.cell.2009.03.016 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Herzig S, Long F, Jhala US, Hedrick S, Quinn R, Bauer A, et al.. CREB регулирует глюконеогенез в печени через коактиватор PGC-1. Природа. (2001) 413:179–83. 10.1038/35093131 [PubMed] [CrossRef] [Google Scholar]
Herzig S, Long F, Jhala US, Hedrick S, Quinn R, Bauer A, et al.. CREB регулирует глюконеогенез в печени через коактиватор PGC-1. Природа. (2001) 413:179–83. 10.1038/35093131 [PubMed] [CrossRef] [Google Scholar]
42. Howell JJ, Hellberg K, Turner M, Talbott G, Kolar MJ, Ross DS и др.. Метформин ингибирует передачу сигналов mTORC1 в печени через дозозависимые механизмы, включающие AMPK и комплекс TSC. Клеточный метаб. (2017) 25:463–71. 10.1016/j.cmet.2016.12.009[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Миллер Р.А., Chu Q, Xie J, Foretz M, Viollet B, Birnbaum MJ. Бигуаниды подавляют передачу сигналов глюкагона печенью, уменьшая продукцию циклического АМФ. Природа. (2013) 494: 256–60. 10.1038/nature11808 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Hunter RW, Hughey CC, Lantier L, Sundelin EI, Peggie M, Zeqiraj E и др.. Метформин снижает выработку глюкозы в печени за счет ингибирование фруктозо-1-6-бисфосфатазы. Нат Мед. (2018) 24:1395–406. 10.1038/s41591-018-0159-7 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10.1038/s41591-018-0159-7 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Gunton JE, Delhanty PJ, Takahashi S, Baxter RC. Метформин быстро увеличивает активацию рецепторов инсулина в печени человека и передает сигналы преимущественно через субстрат-2 рецепторов инсулина. J Clin Endocrinol Metab. (2003) 88:1323–32. 10.1210/jc.2002-021394 [PubMed] [CrossRef] [Google Scholar]
46. Kristensen JM, Treebak JT, Schjerling P, Goodyear L, Wojtaszewski JF. Две недели лечения метформином вызывают AMPK-зависимое усиление стимулированного инсулином поглощения глюкозы в камбаловидной мышце мыши. Am J Physiol Endocrinol Metab. (2014) 306:E1099–109. 10.1152/ajpendo.00417.2013 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Gu S, Shi J, Tang Z, Sawhney M, Hu H, Shi L, et al.. Сравнение снижения уровня глюкозы Эффект метформина и акарбозы при сахарном диабете 2 типа: метаанализ. ПЛОС ОДИН. (2015) 10:e0126704. 10.1371/journal.pone.0126704 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F и др.. Метагеном широкомасштабное ассоциативное исследование микробиоты кишечника при диабете 2 типа. Природа. (2012) 490:55–60. 10.1038/nature11450 [PubMed] [CrossRef] [Google Scholar]
Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F и др.. Метагеном широкомасштабное ассоциативное исследование микробиоты кишечника при диабете 2 типа. Природа. (2012) 490:55–60. 10.1038/nature11450 [PubMed] [CrossRef] [Google Scholar]
49. Karlsson FH, Tremaroli V, Nookaew I, Bergstrom G, Behre CJ, Fagerberg B, et al. Метагеном кишечника у европейских женщин с нормальным, нарушенным и диабетическим контроль глюкозы. Природа. (2013) 498:99–103. 10.1038/nature12198 [PubMed] [CrossRef] [Google Scholar]
50. Wu H, Esteve E, Tremaroli V, Khan MT, Caesar R, Manneras-Holm L и др.. Метформин изменяет микробиом кишечника у людей, получающих лечение. -наивный сахарный диабет 2 типа, что способствует терапевтическому действию препарата. Нат Мед. (2017) 23:850–8. 10.1038/nm.4345 [PubMed] [CrossRef] [Google Scholar]
51. Sun L, Xie C, Wang G, Wu Y, Wu Q, Wang X и др. Микробиота кишечника и FXR кишечника опосредуют клинические преимущества метформина. Нат Мед. (2018) 24:1919–29. 10.1038/s41591-018-0222-4 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Podhorecka M, Ibanez B, Dmoszynska A. Метформин – его потенциальное противораковое и омолаживающее действие. Postepy Hig Med Dosw. (2017) 71:170–5. 10.5604/01.3001.0010.3801 [PubMed] [CrossRef] [Google Scholar]
Podhorecka M, Ibanez B, Dmoszynska A. Метформин – его потенциальное противораковое и омолаживающее действие. Postepy Hig Med Dosw. (2017) 71:170–5. 10.5604/01.3001.0010.3801 [PubMed] [CrossRef] [Google Scholar]
53. Gwinn DM, Shackelford DB, Egan DF, Mihaylova MM, Mery A, Vasquez DS и др.. Фосфорилирование AMPK raptor опосредует метаболическую контрольную точку. Мол Ячейка. (2008) 30:214–26. 10.1016/j.molcel.2008.03.003 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Thompson MD, Cole DE, Jose PA, Chidiac P. G белок-связанные рецепторные белки и передача сигналов: фармакогеномные идеи. Методы Мол Биол. (2014) 1175:121–52. 10.1007/978-1-4939-0956-8_7 [PubMed] [CrossRef] [Google Scholar]
55. Kisfalvi K, Eibl G, Sinnett-Smith J, Rozengurt E. Метформин нарушает взаимодействие между рецептором, связанным с G-белком, и инсулином. сигнальные системы рецепторов и ингибирует рост рака поджелудочной железы. Рак Рез. (2009) 69:6539–45. 10.1158/0008-5472. КАН-09-0418 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
КАН-09-0418 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Холлштейн М., Сидрански Д., Фогельштейн Б., Харрис К.С. Мутации p53 при раке человека. Наука. (1991) 253:49–53. 10.1126/science.1905840 [PubMed] [CrossRef] [Google Scholar]
57. Cerezo M, Tichet M, Abbe P, Ohanna M, Lehraiki A, Rouaud F, et al.. Метформин блокирует инвазию меланомы и развитие метастазов при AMPK. /p53-зависимый способ. Мол Рак Тер. (2013) 12:1605–15. 10.1158/1535-7163.MCT-12-1226-T [PubMed] [CrossRef] [Google Scholar]
58. Сакстон Р.А., Сабатини Д.М. Передача сигналов mTOR в росте, метаболизме и заболеваниях. Клетка. (2017) 169: 361–71. 10.1016/j.cell.2017.03.035 [PubMed] [CrossRef] [Google Scholar]
59. Kalender A, Selvaraj A, Kim SY, Gulati P, Brule S, Viollet B и др.. Метформин, независимо от AMPK , ингибирует mTORC1 зависимым от rag GTPase образом. Клеточный метаб. (2010) 11:390–401. 10.1016/j.cmet.2010.03.014 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Algire C, Moiseeva O, Deschenes-Simard X, Amrein L, Petruccelli L, Birman E, et al. .. Метформин уменьшает количество эндогенных активных форм кислорода и связанное с этим повреждение ДНК. Рак Пред. Рез. (2012) 5:536–43. 10.1158/1940-6207.CAPR-11-0536 [PubMed] [CrossRef] [Google Scholar]
Algire C, Moiseeva O, Deschenes-Simard X, Amrein L, Petruccelli L, Birman E, et al. .. Метформин уменьшает количество эндогенных активных форм кислорода и связанное с этим повреждение ДНК. Рак Пред. Рез. (2012) 5:536–43. 10.1158/1940-6207.CAPR-11-0536 [PubMed] [CrossRef] [Google Scholar]
61. Курелак И., Умеш Ганеш Н., Иорио М., Порселли А.М., Гаспарре Г. Многогранное воздействие метформина на микроокружение опухоли. Semin Cell Dev Biol. (2019) 98:90–7. 10.1016/j.semcdb.2019.05.010 [PubMed] [CrossRef] [Google Scholar]
62. Sui X, Xu Y, Wang X, Han W, Pan H, Xiao M. Метформин: новое, но спорное лекарство от рака профилактика и лечение. Мол Фарм. (2015) 12:3783–91. 10.1021/acs.molpharmaceut.5b00577 [PubMed] [CrossRef] [Google Scholar]
63. Моисеева О., Дешен-Симар Х., Сен-Жермен Э., Игельманн С., Хуот Г., Кадар А.Е. и др.. Метформин ингибирует секреторный фенотип, связанный со старением, препятствуя активации IKK/NF-kappaB. Стареющая клетка. (2013) 12:489–98. 10.1111/acel. 12075 [PubMed] [CrossRef] [Google Scholar]
12075 [PubMed] [CrossRef] [Google Scholar]
64. Blandino G, Valerio M, Cioce M, Mori F, Casadei L, Pulito C, et al.. Метформин вызывает противораковые эффекты посредством последовательной модуляции DICER и c-MYC. Нац коммун. (2012) 3:865. 10.1038/ncomms1859[PubMed] [CrossRef] [Google Scholar]
65. Elgendy M, Ciro M, Hosseini A, Weiszmann J, Mazzarella L, Ferrari E, et al. Комбинация гипогликемии и метформина ухудшает метаболическую пластичность и рост опухоли, модулируя PP2A-GSK3beta-MCL-1 Ось. Раковая клетка. (2019) 35: 798–815 e795. 10.1016/j.ccell.2019.03.007 [PubMed] [CrossRef] [Google Scholar]
66. Raffaghello L, Lee C, Safdie FM, Wei M, Madia F, Bianchi G, et al. Дифференциальная стрессоустойчивость, зависящая от голодания, защищает нормальные, но не раковые клетки от химиотерапии высокими дозами. Proc Natl Acad Sci USA. (2008) 105:8215–20. 10.1073/pnas.0708100105 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Tao Z, Shi A, Lu C, Song T, Zhang Z, Zhao J. Рак молочной железы: эпидемиология и этиология. Клеточная биохимия Биофиз. (2015) 72:333–8. 10.1007/s12013-014-0459-6 [PubMed] [CrossRef] [Google Scholar]
Рак молочной железы: эпидемиология и этиология. Клеточная биохимия Биофиз. (2015) 72:333–8. 10.1007/s12013-014-0459-6 [PubMed] [CrossRef] [Google Scholar]
68. Kasznicki J, Sliwinska A, Jewoski J. Метформин в профилактике и терапии рака. Энн Трансл Мед. (2014) 2:57. 10.3978/j.issn.2305-5839.2014.06.01 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Bianchini G, Balko JM, Mayer IA, Sanders ME, Gianni L. Тройной негативный рак молочной железы : вызовы и возможности гетерогенного заболевания. Nat Rev Clin Oncol. (2016) 13: 674–90. 10.1038/nrclinonc.2016.66 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Zenke-Kawasaki Y, Dohi Y, Katoh Y, Ikura T, Ikura M, Asahara T, et al.. Гем индуцирует убиквитинирование и деградацию фактора транскрипции Bach2. Мол Селл Биол. (2007) 27:6962–71. 10.1128/MCB.02415-06 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Lee J, Yesilkanal AE, Wynne JP, Frankenberger C, Liu J, Yan J и др. Эффективная грудь комбинированная терапия рака, направленная на BACh2 и митохондриальный метаболизм. Природа. (2019) 568:254–8. 10.1038/s41586-019-1005-x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эффективная грудь комбинированная терапия рака, направленная на BACh2 и митохондриальный метаболизм. Природа. (2019) 568:254–8. 10.1038/s41586-019-1005-x [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Keane NA, Glavey SV, Krawczyk J, O’dwyer M. AKT как терапевтическая мишень при множественной миеломе . Экспертное мнение по этим целям. (2014) 18:897–915. 10.1517/14728222.2014.924507 [PubMed] [CrossRef] [Google Scholar]
73. Джаганнатан С., Абдель-Малек М.А., Малек Э., Вад Н., Латиф Т., Андерсон К.С. и др. Фармакологические скрининги выявили метформин, который подавляет GRP78. -зависимая аутофагия для усиления антимиеломного эффекта бортезомиба. Лейкемия. (2015) 29: 2184–91. 10.1038/leu.2015.157 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Polak R, Buitenhuis M. Сигнальный модуль PI3K/PKB как ключевой регулятор кроветворения: последствия для терапевтических стратегий при лейкемии. Кровь. (2012) 119:911–23. 10.1182/blood-2011-07-366203 [PubMed] [CrossRef] [Google Scholar]
75. Shi WY, Xiao D, Wang L, Dong LH, Yan ZX, Shen ZX и др. Терапевтическая активация метформином/AMPK блокировал рост клеток лимфомы посредством ингибирования пути mTOR и индукции аутофагии. Клеточная смерть Дис. (2012) 3:e275. 10.1038/cddis.2012.13 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Shi WY, Xiao D, Wang L, Dong LH, Yan ZX, Shen ZX и др. Терапевтическая активация метформином/AMPK блокировал рост клеток лимфомы посредством ингибирования пути mTOR и индукции аутофагии. Клеточная смерть Дис. (2012) 3:e275. 10.1038/cddis.2012.13 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. Yang YX, Hennessy S, Lewis JD. Инсулинотерапия и риск колоректального рака у больных сахарным диабетом 2 типа. Гастроэнтерология. (2004) 127:1044–50. 10.1053/j.gastro.2004.07.011 [PubMed] [CrossRef] [Google Scholar]
77. Zhang ZJ, Zheng ZJ, Kan H, Song Y, Cui W, Zhao G и др. Снижение риска колоректального рака с терапией метформином у пациентов с диабетом 2 типа: метаанализ. Уход за диабетом. (2011) 34:2323–8. 10.2337/dc11-0512 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Маккрейт Л.Дж., Бейли С.Дж., Пирсон Э.Р. Метформин и желудочно-кишечный тракт. Диабетология. (2016) 59:426–35. 10.1007/s00125-015-3844-9 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Fitzmaurice C, Allen C, Barber RM, Barregard L, Bhutta ZA, Brenner H, et al.. Глобальная, региональная и национальная заболеваемость раком, смертность, потерянные годы жизни, годы жизни с инвалидностью и годы жизни с поправкой на инвалидность для 32 групп рака, с 1990 по 2015 год: систематический анализ для исследования глобального бремени болезней. JAMA Онкол. (2017) 3: 524–48. 10.1001/jamaoncol.2016.5688 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Fitzmaurice C, Allen C, Barber RM, Barregard L, Bhutta ZA, Brenner H, et al.. Глобальная, региональная и национальная заболеваемость раком, смертность, потерянные годы жизни, годы жизни с инвалидностью и годы жизни с поправкой на инвалидность для 32 групп рака, с 1990 по 2015 год: систематический анализ для исследования глобального бремени болезней. JAMA Онкол. (2017) 3: 524–48. 10.1001/jamaoncol.2016.5688 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Ko EM, Walter P, Jackson A, Clark L, Franasiak J, Bolac C, et al. Метформин связан с улучшением выживаемости при раке эндометрия. Гинекол Онкол. (2014) 132:438–42. 10.1016/j.ygyno.2013.11.021 [PubMed] [CrossRef] [Google Scholar]
81. Демьер М.Ф. Эпидемиология и профилактика меланомы кожи. Варианты лечения Curr Oncol. (2006) 7:181–6. 10.1007/s11864-006-0011-z [PubMed] [CrossRef] [Google Scholar]
82. Эггермонт А.М., Спатц А., Роберт С. Меланома кожи. Ланцет. (2014) 383:816–27. 10.1016/S0140-6736(13)60802-8 [PubMed] [CrossRef] [Google Scholar]
83. Li K, Zhang TT, Wang F, Cui B, Zhao CX, Yu JJ и др.. Метформин подавляет прогрессирование меланомы путем ингибирования KAT5-опосредованного ацетилирования SMAD3, транскрипционной активности и экспрессии TRIB3. Онкоген. (2018) 37:2967–81. 10.1038/s41388-018-0172-9 [PubMed] [CrossRef] [Google Scholar]
Li K, Zhang TT, Wang F, Cui B, Zhao CX, Yu JJ и др.. Метформин подавляет прогрессирование меланомы путем ингибирования KAT5-опосредованного ацетилирования SMAD3, транскрипционной активности и экспрессии TRIB3. Онкоген. (2018) 37:2967–81. 10.1038/s41388-018-0172-9 [PubMed] [CrossRef] [Google Scholar]
84. Linnard-Palmer L. Использование моделирования для принципов безопасности сестринского дела в педиатрической онкологии: обеспечение компетентной практики за счет использования мнемоники, химиотерапии дорожные карты и обучение на основе конкретных случаев. J Педиатр Нурс. (2012) 27:283–6. 10.1016/j.pedn.2012.02.001 [PubMed] [CrossRef] [Google Scholar]
85. Манди Г.Р. Метастазирование в кости: причины, последствия и терапевтические возможности. Нат Рев Рак. (2002) 2:584–93. 10.1038/nrc867 [PubMed] [CrossRef] [Google Scholar]
86. Lee YS, Kim YS, Lee SY, Kim GH, Kim BJ, Lee SH и др.. Киназа AMP действует как негативный регулятор RANKL в дифференцировка остеокластов. Кость. (2010) 47:926–37. 10.1016/j.bone.2010.08.001 [PubMed] [CrossRef] [Google Scholar]
Кость. (2010) 47:926–37. 10.1016/j.bone.2010.08.001 [PubMed] [CrossRef] [Google Scholar]
87. Despres JP, Lemieux I. Абдоминальное ожирение и метаболический синдром. Природа. (2006) 444:881–7. 10.1038/nature05488 [PubMed] [CrossRef] [Google Scholar]
88. Kim EK, Lee SH, Jhun JY, Byun JK, Jeong JH, Lee SY и др.. Метформин предотвращает ожирение печени и улучшает баланс белого/коричневого жира в модели мышей с ожирением, индуцируя FGF21. Медиаторы воспаления. (2016) 2016: 5813030. 10.1155/2016/5813030 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Karise I, Bargut TC, Del Sol M, Aguila MB, Mandarim-De-Lacerda CA. Метформин усиливает митохондриальный биогенез и термогенез в бурых адипоцитах мышей. Биомед Фармаколог. (2019) 111:1156–65. 10.1016/j.biopha.2019.01.021 [PubMed] [CrossRef] [Google Scholar]
90. Zhang X, Zhao Y, Xu J, Xue Z, Zhang M, Pang X и др. Модуляция микробиоты кишечника с помощью берберин и метформин при лечении ожирения у крыс, вызванного диетой с высоким содержанием жиров. Научный доклад (2015) 5:14405. 10.1038/srep14405 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Научный доклад (2015) 5:14405. 10.1038/srep14405 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Singh S, Singh PP, Singh AG, Murad MH, Sanchez W. Противодиабетические препараты и риск гепатоцеллюлярного рака: систематический обзор и метаанализ. Am J Гастроэнтерол. (2013) 108: 881–91. 10.1038/ajg.2013.5 [PubMed] [CrossRef] [Google Scholar]
92. Lin HZ, Yang SQ, Chuckaree C, Kuhajda F, Ronnet G, Diehl AM. Метформин устраняет жировую болезнь печени у мышей с ожирением и дефицитом лептина. Нат Мед. (2000) 6:998–1003. 10.1038/79697 [PubMed] [CrossRef] [Google Scholar]
93. Lavine JE, Schwimmer JB, Van Natta ML, Molleston JP, Murray KF, Rosenthal P, et al. Влияние витамина Е или метформина на лечение неалкогольной жировая болезнь печени у детей и подростков: рандомизированное контролируемое исследование TONIC. ДЖАМА. (2011) 305:1659–68. 10.1001/jama.2011.520 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
содержание жира в печени, инсулинорезистентность печени, клиренс инсулина и экспрессия генов в жировой ткани у пациентов с диабетом 2 типа. Диабет. (2004) 53:2169–76. 10.2337/diabetes.53.8.2169 [PubMed] [CrossRef] [Google Scholar]
Диабет. (2004) 53:2169–76. 10.2337/diabetes.53.8.2169 [PubMed] [CrossRef] [Google Scholar]
95. Cone CJ, Bachyrycz AM, Murata GH. Гепатотоксичность, связанная с терапией метформином при лечении сахарного диабета 2 типа с неалкогольной жировой болезнью печени. Энн Фармакотер. (2010) 44:1655–9. 10.1345/aph.1P099 [PubMed] [CrossRef] [Google Scholar]
96. Musso G, Cassader M, Gambino R. Неалкогольный стеатогепатит: новые молекулярные мишени и терапевтические стратегии. Nat Rev Drug Discov. (2016) 15: 249–74. 10.1038/nrd.2015.3 [PubMed] [CrossRef] [Google Scholar]
97. Raber I, McCarthy CP, Vaduganathan M, Bhatt DL, Wood DA, Cleland JGF, et al. профилактика сердечно-сосудистых заболеваний. Ланцет. (2019) 393:2155–67. 10.1016/S0140-6736(19)30541-0 [PubMed] [CrossRef] [Google Scholar]
98. Хенисер К.Г., Кашьяп С.Р., Касумов Т. Систематический обзор: оценка влияния метформина на модификацию и функцию липопротеинов. Обес научная практика. (2019) 5:36–45. 10.1002/osp4. 309 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
309 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
99. Kinsara AJ, Ismail YM. Метформин у пациентов с сердечной недостаточностью. Indian Heart J. (2018) 70: 175–6. 10.1016/j.ihj.2017.05.009 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
100. Dziubak A, Wojcicka G, Wojtak A, Beltowski J. Метаболические эффекты метформина при сердечной недостаточности. Int J Mol Sci. (2018) 19:2869. 10.3390/ijms19102869 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
101. Mohan M, Al-Talabany S, Mckinnie A, Mordi IR, Singh JSS, Gandy SJ, et al.. Рандомизированное контролируемое исследование метформина на гипертрофию левого желудочка у пациентов с ишемической болезнью сердца без диабета: исследование MET-REMODEL. Европейское сердце Дж. (2019) 40: 3409–17. 10.1093/eurheartj/ehz203 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
102. Фонтана Л., Партридж Л., Лонго В.Д. Увеличение продолжительности здоровой жизни — от дрожжей до человека. Наука. (2010) 328:321–6. 10.1126/science.1172539 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Наука. (2010) 328:321–6. 10.1126/science.1172539 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
103. Losordo DW, Henry TD. Новое определение старения? Измерение регенеративных возможностей у пациентов. Цирк рез. (2016) 119: 774–5. 10.1161/CIRCRESAHA.116.309622 [PubMed] [CrossRef] [Google Scholar]
104. Хоймейкерс Дж.Х. Повреждение ДНК, старение и рак. N Engl J Med. (2009) 361:1475–85. 10.1056/NEJMra0804615 [PubMed] [CrossRef] [Google Scholar]
105. Рубинштейн Д.К., Марино Г., Кремер Г. Аутофагия и старение. Клетка. (2011) 146:682–95. 10.1016/j.cell.2011.07.030 [PubMed] [CrossRef] [Google Scholar]
106. Влияние интенсивного контроля уровня глюкозы в крови с помощью метформина на осложнения у пациентов с избыточным весом при диабете 2 типа (UKPDS 34) Британская группа проспективных исследований диабета (UKPDS). Ланцет. (1998) 352:854–65. 10.1016/S0140-6736(98)07037-8 [PubMed] [CrossRef] [Google Scholar]
107. Guo M, Mi J, Jiang QM, Xu JM, Tang YY, Tian G и др. Метформин может вызывать антидепрессивное действие за счет улучшения когнитивных функций у больных депрессией с сахарным диабетом. Clin Exp Pharmacol Physiol. (2014) 41:650–6. 10.1111/1440-1681.12265 [PubMed] [CrossRef] [Google Scholar]
Метформин может вызывать антидепрессивное действие за счет улучшения когнитивных функций у больных депрессией с сахарным диабетом. Clin Exp Pharmacol Physiol. (2014) 41:650–6. 10.1111/1440-1681.12265 [PubMed] [CrossRef] [Google Scholar]
108. Валенсия В.М., Паласио А., Тамарис Л., Флорес Х. Метформин и старение: улучшение результатов старения вне гликемического контроля. Диабетология. (2017) 60:1630–8. 10.1007/s00125-017-4349-5 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
109. Song YM, Lee YH, Kim JW, Ham DS, Kang ES, Cha BS и др.. Метформин облегчает гепатостеатоз, восстанавливая SIRT1- опосредованная индукция аутофагии через АМФ-активируемый протеинкиназонезависимый путь. Аутофагия. (2015) 11:46–59. 10.4161/15548627.2014.984271 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
110. Barzilai N, Crandall JP, Kritchevsky SB, Espeland MA. Метформин как средство борьбы со старением. Клеточный метаб. (2016) 23:1060–5. 10.1016/j.cmet.2016. 05.011 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
05.011 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
111. Чавла Л.С., Киммел П.Л. Острая почечная недостаточность и хроническая болезнь почек: интегрированный клинический синдром. почки инт. (2012) 82:516–24. 10.1038/ki.2012.208 [PubMed] [CrossRef] [Google Scholar]
112. Misbin RI, Green L, Stadel BV, Gueriguian JL, Gubbi A, Fleming GA. Лактацидоз у больных сахарным диабетом, получавших метформин. N Engl J Med. (1998) 338:265–6. 10.1056/NEJM199801223380415 [PubMed] [CrossRef] [Google Scholar]
113. Lee M, Katerelos M, Gleich K, Galic S, Kemp BE, Mount PF, et al.. Фосфорилирование ацетил-КоА-карбоксилазы с помощью AMPK уменьшает почечный фиброз и необходим для антифибротического эффекта метформина. J Am Soc Нефрол. (2018) 29: 2326–36. 10.1681/ASN.2018010050 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
114. Bell S, Farran B, Mcgurnaghan S, Mccrimmon RJ, Leese GP, Petrie JR, et al.. Риск острого заболевания почек травмы и выживаемость у пациентов, получавших метформин: обсервационное когортное исследование. БМК Нефрол. (2017) 18:163.
БМК Нефрол. (2017) 18:163.
Побочные эффекты метформина: распространенные и тяжелые0238
В мае 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) рекомендовало некоторым производителям метформина пролонгированного действия изъять некоторые из своих таблеток с рынка США. Это связано с тем, что в некоторых таблетках метформина с пролонгированным высвобождением был обнаружен неприемлемый уровень вероятного канцерогена (канцерогенного агента). Если вы в настоящее время принимаете этот препарат, позвоните своему поставщику медицинских услуг. Они посоветуют, следует ли вам продолжать принимать лекарства или вам нужен новый рецепт.
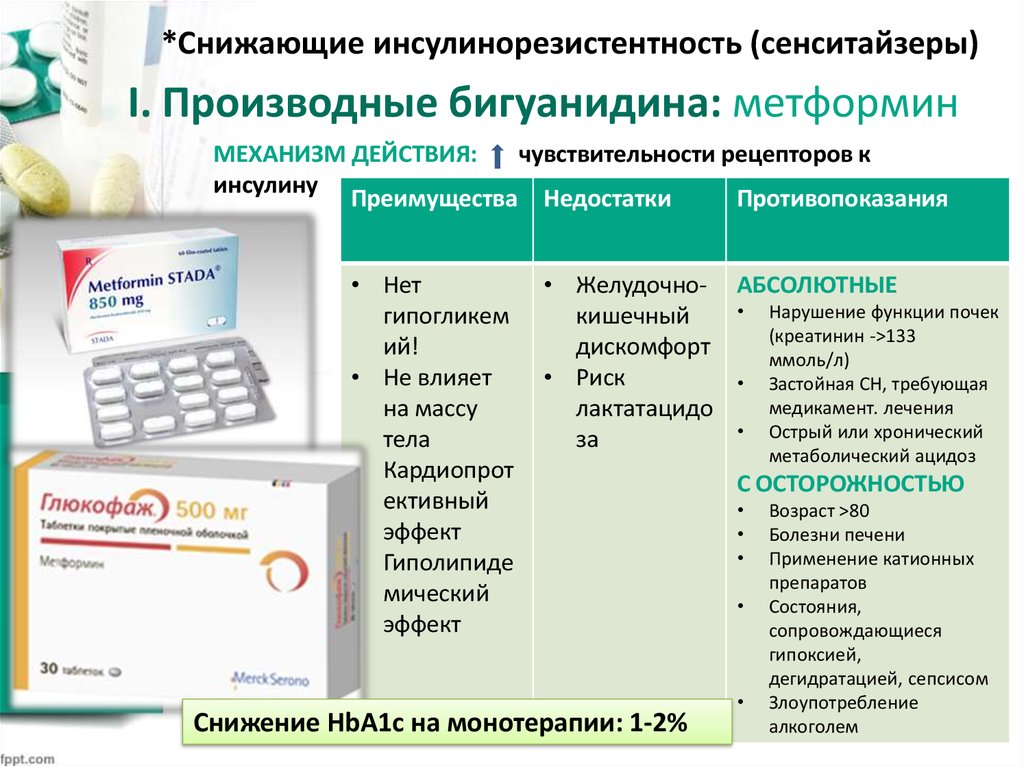
Метформин — это лекарство, отпускаемое по рецепту, используемое для лечения диабета 2 типа. Он принадлежит к классу лекарств, называемых бигуанидами.
У людей с диабетом 2 типа уровень сахара (глюкозы) в крови повышается выше нормы. Метформин не лечит диабет. Вместо этого он помогает снизить уровень сахара в крови до безопасного уровня.
Метформин также часто назначают не по прямому назначению для лечения синдрома поликистозных яичников (СПКЯ), но в настоящее время он не одобрен FDA для этого применения.
Метформин может вызывать легкие и серьезные побочные эффекты. Большинство побочных эффектов незначительны и в первую очередь влияют на пищеварительную систему. Тяжелые побочные эффекты, такие как лактоацидоз, встречаются реже, но требуют немедленной медицинской помощи.
Вот что вам нужно знать о побочных эффектах метформина и когда вам следует обратиться к врачу.
Метформин вызывает некоторые распространенные побочные эффекты. Они могут возникать, когда вы впервые начинаете принимать метформин, но обычно проходят со временем. Сообщите своему врачу, если какие-либо из этих симптомов являются серьезными или вызывают у вас проблемы.
Наиболее распространенные побочные эффекты метформина включают:
- изжогу
- боль в животе
- тошноту или рвоту
- вздутие живота
- газы
- понос
- запор
- потеря веса
- головная боль
- неприятный металлический привкус во рту Эти проблемы обычно со временем исчезают.

Вы можете уменьшить эти эффекты, принимая метформин во время еды. Кроме того, чтобы снизить риск тяжелой диареи, ваш врач, скорее всего, назначит вам низкую дозу метформина, а затем постепенно ее увеличит.
Метформин иногда используется для улучшения чувствительности к инсулину и помогает регулировать функцию яичников у людей с СПКЯ. Он используется не по прямому назначению для этой цели. Побочные эффекты для этого использования такие же, как и для других видов использования.
Лактоацидоз
Хотя очень редко, наиболее серьезным побочным эффектом метформина является лактоацидоз. На самом деле, метформин имеет «коробочную» — также называемую «черным ящиком» — предупреждение об этом риске. Предупреждение в рамке — это самое серьезное предупреждение, которое выдает Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).
Лактоацидоз — это редкая, но серьезная проблема, которая может возникнуть из-за накопления метформина в организме.
 Это накопление вызывает дисбаланс рН в вашем теле. Это неотложная медицинская помощь, которую необходимо лечить немедленно в больнице.
Это накопление вызывает дисбаланс рН в вашем теле. Это неотложная медицинская помощь, которую необходимо лечить немедленно в больнице.Смертность от лактоацидоза, связанного с метформином, составляет от 30 до 50 процентов, но о нем сообщается только 10 раз на каждые 100 000 пациенто-лет. Например, если 200 000 человек принимали метформин в течение одного года каждый, то ожидается около 20 случаев.
Дополнительную информацию о факторах, повышающих риск лактоацидоза, см. в разделе «Меры предосторожности».
Немедленно позвоните своему врачу, если у вас есть какие-либо из следующих симптомов лактоацидоза. Если у вас проблемы с дыханием, немедленно позвоните по номеру 911 или обратитесь в ближайшее отделение неотложной помощи.
- крайняя усталость
- слабость
- снижение аппетита
- тошнота
- рвота
- затрудненное дыхание
- головокружение
- головокружение
- учащенное или замедленное сердцебиение
- ощущение холода
- мышечная боль
- покраснение или внезапное покраснение и повышение температуры кожи
- боль в животе с любым из этих других симптомов витамина В12 в организме.
 В редких случаях это может вызвать анемию или низкий уровень эритроцитов. Если вы не получаете много витамина B12 или кальция с пищей, у вас может быть более высокий риск очень низкого уровня витамина B12.
В редких случаях это может вызвать анемию или низкий уровень эритроцитов. Если вы не получаете много витамина B12 или кальция с пищей, у вас может быть более высокий риск очень низкого уровня витамина B12.Ваш уровень витамина B12 может улучшиться, если вы прекратите принимать метформин или будете принимать добавки с витамином B12. Обязательно поговорите со своим врачом, прежде чем прекратить прием метформина.
Наиболее распространенные симптомы анемии включают:
- усталость
- головокружение
- дурноту
Если вы думаете, что у вас может быть анемия, запишитесь на прием к врачу, чтобы проверить уровень эритроцитов.
Гипогликемия
Метформин обычно не вызывает гипогликемию или низкий уровень сахара в крови. Однако в редких случаях у вас может развиться гипогликемия, если вы комбинируете метформин с:
- Плохое питание
- . рвота
- боль в животе
- головокружение
- предобморочное состояние
- аномально быстрое или медленное сердцебиение
Для предотвращения гипогликемии
- Принимайте лекарства по расписанию.

- Соблюдайте сбалансированную диету.
- Упражнения по назначению врача.
- Расскажите своему врачу обо всех других лекарствах, которые вы принимаете.
По данным Национальной службы здравоохранения, метформин обычно безопасно принимать отдельно или с инсулином во время беременности или кормления грудью.
Метформин проникает через плаценту, но не связан с повышением частоты проблем или осложнений развития плода.
Исследование, проведенное в 2018 году, не выявило существенной разницы между частотой серьезных нежелательных явлений у беременных женщин, принимавших плацебо или метформин. Легкие побочные эффекты, такие как тошнота, рвота и диарея, чаще отмечались у женщин, принимавших метформин.
В обзоре исследований 2016 года были обнаружены доказательства того, что метформин может снижать частоту выкидышей у женщин с СПКЯ.
Большинство распространенных побочных эффектов метформина связаны с пищеварительной системой. Вы можете свести к минимуму свои шансы на развитие побочных эффектов следующим образом:
- Начиная с низкой дозы.
 Лучше всего начинать с низкой дозы и постепенно увеличивать ее, чтобы снизить вероятность развития побочных эффектов. Типичная начальная доза составляет 500 миллиграммов.
Лучше всего начинать с низкой дозы и постепенно увеличивать ее, чтобы снизить вероятность развития побочных эффектов. Типичная начальная доза составляет 500 миллиграммов. - Прием метформина во время еды. Прием метформина во время еды может помочь снизить вероятность развития расстройства желудка или желудочного дискомфорта.
- Прием метформина пролонгированного действия. Вы можете поговорить с врачом, чтобы узнать, подходит ли вам метформин пролонгированного действия. Этот тип метформина медленно высвобождается с течением времени и обычно имеет более мягкие побочные эффекты. Обязательно обсудите отзыв FDA некоторых марок расширенного выпуска метформина, чтобы убедиться, что вы получаете безопасную версию.
- Принимать таблетки целиком. Таблетки не следует измельчать. Это может ускорить скорость их усвоения.
Если у вас появились неприятные побочные эффекты, рекомендуется обратиться к врачу.
 Они могут порекомендовать изменить дозировку типа метформина, который вы принимаете. Вы можете обнаружить, что вам нужно изменить дозировку, особенно в периоды стресса.
Они могут порекомендовать изменить дозировку типа метформина, который вы принимаете. Вы можете обнаружить, что вам нужно изменить дозировку, особенно в периоды стресса.Также рекомендуется избегать употребления большого количества алкоголя при приеме метформина, поскольку это может увеличить ваши шансы на развитие лактоацидоза.
Несколько факторов повышают риск лактоацидоза при приеме метформина. Если какой-либо из этих факторов влияет на вас, обязательно обсудите их со своим врачом, прежде чем принимать этот препарат.
Проблемы с почками
Почки выводят метформин из организма. Если ваши почки не работают должным образом, уровень метформина в вашей системе будет выше. Это повышает риск лактоацидоза.
Если у вас легкие или умеренные проблемы с почками, ваш врач может назначить вам более низкую дозу метформина.
Если у вас серьезные проблемы с почками или вам больше 80 лет, метформин может вам не подойти. Ваш врач, скорее всего, проверит функцию ваших почек, прежде чем вы начнете принимать метформин, а затем снова каждый год.

Проблемы с сердцем
Если у вас острая сердечная недостаточность или недавно перенесенный сердечный приступ, вам не следует принимать метформин.
Возможно, ваше сердце не посылает достаточное количество крови к почкам. Это помешает вашим почкам выводить метформин из вашего организма, как обычно, что повышает риск лактоацидоза.
Проблемы с печенью
Вы не должны принимать метформин, если у вас серьезные проблемы с печенью. Ваша печень очищает молочную кислоту от вашего тела.
Серьезные проблемы с печенью могут привести к накоплению молочной кислоты. Накопление молочной кислоты повышает риск лактоацидоза. Метформин также повышает риск, поэтому принимать его при проблемах с печенью опасно.
Употребление алкоголя
Употребление алкоголя во время приема метформина повышает риск гипогликемии. Это также повышает риск лактоацидоза, потому что увеличивает уровень молочной кислоты в организме.
Во время приема метформина не следует употреблять большое количество алкоголя.
 Это включает в себя длительное употребление алкоголя и пьянство. Если вы употребляете алкоголь, поговорите со своим врачом о том, сколько алкоголя безопасно для вас, пока вы принимаете метформин.
Это включает в себя длительное употребление алкоголя и пьянство. Если вы употребляете алкоголь, поговорите со своим врачом о том, сколько алкоголя безопасно для вас, пока вы принимаете метформин.Для получения дополнительной информации прочитайте об опасностях употребления алкоголя при использовании метформина и о том, как алкоголь влияет на диабет.
Хирургические или радиологические процедуры
Если вы планируете операцию или рентгенологическую процедуру с использованием йодного контраста, вам необходимо прекратить прием метформина перед процедурой. Эти процедуры могут замедлить выведение метформина из организма, повышая риск лактоацидоза. Поговорите со своим врачом о конкретных сроках прекращения приема метформина.
Ваш врач также может сообщить вам, когда безопасно возобновить прием метформина после процедуры. Как правило, вы получаете добро, когда ваши тесты функции почек возвращаются к норме.
Если ваш врач прописал метформин и вас беспокоят его побочные эффекты, поговорите со своим врачом.



 79 ±0,11
79 ±0,11