Белка в клетке – Биосинтез белка кратко и понятно, схема процесса в живой клетке, как называется первый этап биосинтеза, какие компоненты участвуют, где и как происходит механизм, значение
1. Синтез белков в клетке
Каждая клетка содержит тысячи белков. Свойства белков определяются их первичной структурой, т. е. последовательностью аминокислот в их молекулах.
В свою очередь наследственная информация о первичной структуре белка заключена в последовательности нуклеотидов в молекуле ДНК. Эта информация получила название генетической, а участок ДНК, в котором содержится информация о первичной структуре одного белка, называется ген.
Ген — это участок ДНК, в котором содержится информация о первичной структуре одного белка.
Ген — это единица наследственной информации организма.
Каждая молекула ДНК содержит множество генов. Совокупность всех генов организма составляет его генотип.
Биосинтез белка
Биосинтез белка — это один из видов пластического обмена, в ходе которого наследственная информация, закодированная в генах ДНК, реализуется в определённую последовательность аминокислот в белковых молекулах.
Процесс биосинтеза белка состоит из двух этапов: транскрипции и трансляции.

Каждый этап биосинтеза катализируется соответствующим ферментом и обеспечивается энергией АТФ.
Биосинтез происходит в клетках с огромной скоростью. В организме высших животных в одну минуту образуется до \(60\) тыс. пептидных связей.
Транскрипция
Транскрипция — это процесс снятия информации с молекулы ДНК синтезируемой на ней молекулой иРНК (мРНК).
Носителем генетической информации является ДНК, расположенная в клеточном ядре.
В ходе транскрипции участок двуцепочечной ДНК «разматывается», а затем на одной из цепочек синтезируется молекула иРНК.

Информационная (матричная) РНК состоит из одной цепи и синтезируется на ДНК в соответствии с правилом комплементарности.
Формируется цепочка иРНК, представляющая собой точную копию второй (нематричной) цепочки ДНК (только вместо тимина включён урацил). Так информация о последовательности аминокислот в белке переводится с «языка ДНК» на «язык РНК».
Как и в любой другой биохимической реакции, в этом синтезе участвует фермент — РНК-полимераза.
Так как в одной молекуле ДНК может находиться множество генов, очень важно, чтобы РНК-полимераза начала синтез иРНК со строго определённого места ДНК. Поэтому в начале каждого гена находится особая специфическая последовательность нуклеотидов, называемая промотором. РНК-полимераза «узнаёт» промотор, взаимодействует с ним и, таким образом, начинает синтез цепочки иРНК с нужного места.
Фермент продолжает синтезировать иРНК до тех пор, пока не дойдёт до очередного «знака препинания» в молекуле ДНК — терминатора (это последовательность нуклеотидов, указывающая на то, что синтез иРНК нужно прекратить).
У прокариот синтезированные молекулы иРНК сразу же могут взаимодействовать с рибосомами и участвовать в синтезе белков.
У эукариот иРНК синтезируется в ядре, поэтому сначала она взаимодействует со специальными ядерными белками и переносится через ядерную мембрану в цитоплазму.
Трансляция
Трансляция — это перевод последовательности нуклеотидов молекулы иРНК в последовательность аминокислот молекулы белка.
В цитоплазме клетки обязательно должен иметься полный набор аминокислот, необходимых для синтеза белков. Эти аминокислоты образуются в результате расщепления белков, получаемых организмом с пищей, а некоторые могут синтезироваться в самом организме.
Обрати внимание!
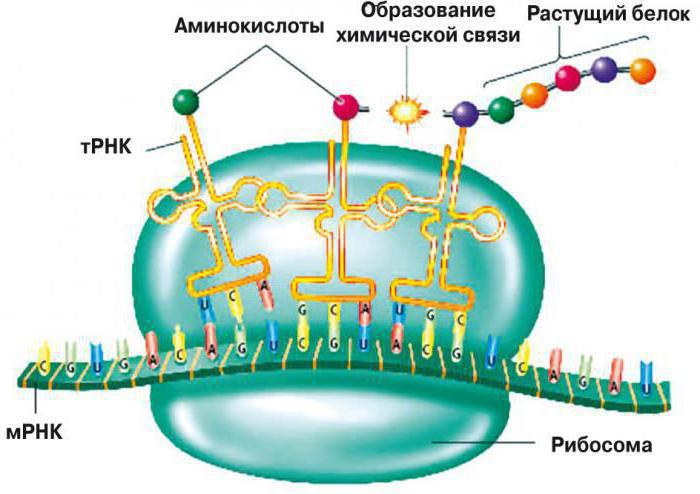
Аминокислоты доставляются к рибосомам транспортными РНК (тРНК). Любая аминокислота может попасть в рибосому, только прикрепившись к специальной тРНК.
На тот конец иРНК, с которого нужно начать синтез белка, нанизывается рибосома. Она движется вдоль иРНК прерывисто, «скачками», задерживаясь на каждом триплете приблизительно \(0,2\) секунды.
За это время молекула тРНК, антикодон которой комплементарен кодону, находящемуся в рибосоме, успевает распознать его. Аминокислота, которая была связана с этой тРНК, отделяется от «черешка» тРНК и присоединяется с образованием пептидной связи к растущей цепочке белка. В тот же самый момент к рибосоме подходит следующая тРНК (антикодон которой комплементарен следующему триплету в иРНК), и следующая аминокислота включается в растущую цепочку.
Аминокислоты, доставленные на рибосомы, ориентированы по отношению друг к другу так, что карбоксильная группа одной молекулы оказывается рядом с аминогруппой другой молекулы. В результате между ними образуется пептидная связь.
Рибосома постепенно сдвигается по иРНК, задерживаясь на следующих триплетах. Так постепенно формируется молекула полипептида (белка).
Синтез белка продолжается до тех пор, пока на рибосоме не окажется один из трёх стоп-кодонов (УАА, УАГ или УГА). После этого белковая цепочка отсоединяется от рибосомы, выходит в цитоплазму и формирует присущую этому белку вторичную, третичную и четвертичную структуры.
Так как клетке необходимо много молекул каждого белка, то как только рибосома, первой начавшая синтез белка на иРНК, продвинется вперёд, за ней на ту же иРНК нанизывается вторая рибосома. Затем на иРНК последовательно нанизываются следующие рибосомы.
Все рибосомы, синтезирующие один и тот же белок, закодированный в данной иРНК, образуют полисому. Именно на полисомах и происходит одновременный синтез нескольких одинаковых молекул белка.
Когда синтез данного белка окончен, рибосома может найти другую иРНК и начать синтезировать другой белок.
Общая схема синтеза белка представлена на рисунке.
Пример:
последовательность нуклеотидов матричной цепи ДНК: ЦГА ТТА ЦАА.
На информационной РНК (иРНК) по принципу комплементарности будет синтезирована цепь ГЦУ ААУ ГУУ, в результате чего выстроится цепочка аминокислот: аланин — аспарагин — валин.
При замене нуклеотидов в одном из триплетов или их перестановке этот триплет будет кодировать другую аминокислоту, а следовательно, изменится и белок, кодируемый данным геном.
Изменения в составе нуклеотидов или их последовательности называются мутациями.
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
http://distant-lessons.ru/molekula-rnk.html
http://900igr.net
http://tonpix.ru/biosintez_belka_translyaciya_47725/
Значение, роль и функции белков в клетке. Какую функцию в клетке выполняют белки?
Белки – это важнейшие органические вещества, количество которых преобладает над всеми другими макромолекулами, которые присутствуют в живой клетке. Они составляют больше половины веса сухого вещества как растительных, так и животных организмов. Функции белков в клетке разнообразные, некоторые из них до сих пор остаются неизвестными науке. Но все же основные направления их «работы» хорошо изучены. Одни нужны для того, чтобы стимулировать процессы, протекающие в клетках и тканях. Другие переносят важные минеральные соединения через клеточную мембрану и по кровеносным сосудам от одного органа к другому. Некоторые защищают организм от чужеродных часто патогенных агентов. Ясно одно – без белков не протекает ни один процесс в нашем организме.
Основные функции белков
Функции белков в организме многообразны. Каждая группа имеет определенное химическое строение, совершает одну специализированную «работу». В некоторых случаях несколько типов белков взаимосвязаны друг с другом. Они отвечают за разные этапы одного процесса. Или же влияют сразу на несколько. Например, регуляторная функция белков осуществляется ферментами и гормонами. Это явление можно представить, вспомнив о гормоне адреналине. Он вырабатывается мозговым слоем надпочечников. Поступая в кровеносные сосуды, он повышает количество кислорода в крови. Поднимается и артериальное давление, увеличивается содержание сахара. Это стимулирует обменные процессы. Также адреналин является медиатором нервной системы у рыб, амфибий и пресмыкающихся.
Ферментативная функция
Многочисленные протекающие в клетках живых организмов биохимические реакции осуществляются при высоких температурах и с нейтральным значением рН. В таких условиях скорость их прохождения слишком мала, поэтому нужны специализированные катализаторы, называемые ферментами. Все их разнообразие объединено в 6 классов, которые различаются по специфичности действия. Ферменты синтезируются на рибосомах в клетках. Их изучением занимается наука энзимология.
Несомненно, без ферментов невозможна регуляторная функция белков. Они обладают высокой избирательностью действия. Их активность может регулироваться ингибиторами и активаторами. Кроме того, ферменты обычно проявляют специфичность по отношению к субстратам. Также ферментативная активность зависит от условий в организме и в клетках в частности. На их протекание влияет давление, кислая рН, температура, ионная сила раствора, то есть концентрация солей в цитоплазме.
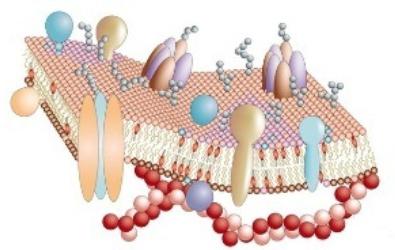
Транспортная функция белков
В клетку должны постоянно поступать необходимые организму минеральные и органические вещества. Они нужны как строительные материалы и источники энергии в клетках. Но механизм их поступления достаточно сложен. Клеточные оболочки состоят не только из белков. Биологические мембраны строятся по принципу двойного слоя липидов. Между ними встроены различные белки. Очень важно, что гидрофильные участки находятся на поверхности мембраны, а гидрофобные – в ее толще. Таким образом, такая структура делает оболочку непроницаемой. Через нее не могут самостоятельно, без «помощи», пройти такие важные компоненты, как сахара, ионы метолов и аминокислоты. Через цитоплазматическую мембрану в цитоплазму их транспортируют специализированные белки, которые вмонтированы в слои липидов.
Транспорт веществ от одних органов к другим
Но транспортная функция белков осуществляется не только между межклеточным веществом и клеткой. Некоторые важные для физиологических процессов вещества приходится доставлять из одних органов в другие. Например, транспортный белок крови – сывороточный альбумин. Он наделен уникальной способностью сформировывать соединения с жирными кислотами, которые появляются при переваривании жиров, с лекарственными препаратами, а также со стероидными гормонами. Важными белками-переносчиками являются и гемоглобин (доставляющий молекулы кислорода), трансферрин (соединяющийся с ионами железа) и церуплазмин (формирующий комплексы с медью).
Сигнальная функция белков
Огромное значение в протекании физиологических процессов в многоклеточных сложных организмах имеют белки-рецепторы. Они вмонтированы в плазматическую мембрану. Служат они для восприятия и расшифровки различного рода сигналов, которые непрерывным потоком поступают в клетки не только от соседних тканей, но и из внешней среды. В настоящее время, пожалуй, самым исследованным белком-рецептором является ацетилхолин. Он находится в ряде межнейронных контактов на мембране клетки.
Но сигнальная функция белков осуществляется не только внутри клеток. Многие гормоны связываются со специфическими рецепторами на их поверхности. Такое сформировавшееся соединение и является сигналом, который активирует физиологические процессы в клетках. Примером таких белков является инсулин, действующий в аденилатциклазной системе.
Защитная функция
Функции белков в клетке различны. Некоторые из них участвуют в иммунных ответах. Это защищает организм от инфекций. Иммунная система способна отвечать на выявленные чужеродные агенты синтезом огромного количества лимфоцитов. Эти вещества способны выборочно повреждать эти агенты, они могут быть чужеродными для организма, например бактерии, надмолекулярные частицы, или это могут быть раковые клетки.
Одна из групп – «бета»-лимфоциты – вырабатывает белки, которые попадают в русло крови. Они имеют очень интересную функцию. Эти белки должны распознавать чужеродные клетки и макромолекулы. Затем они соединяются с ними, формируя комплекс, который подлежит уничтожению. Белки эти называются иммуноглобулинами. Сами чужеродные компоненты – это антигены. А иммуноглобулины, которые им соответствуют – антитела.
Структурная функция
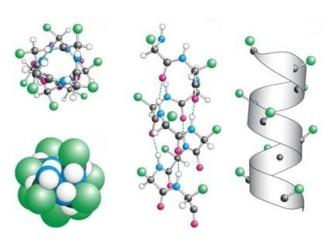
В организме, помимо высокоспециализированных, существуют еще и структурные белки. Они необходимы, чтобы обеспечивать механическую прочность. Эти функции белков в клетке важны для поддержания формы и сохранения молодости организма. Самым известным является коллаген. Это основной белок внеклеточного матрикса соединительных тканей. У высших млекопитающих он составляет до 1/4 общей массы белков. Синтезируется коллаген в фибробластах, которые являются основными клеточками соединительных тканей.
Такие функции белков в клетке имеют огромное значение. Помимо коллагена, известен еще один структурный белок – эластин. Он также является составляющей внеклеточного матрикса. Эластин способен наделять ткани возможностью растягиваться в определенных пределах и легко возвращаться в исходную форму. Еще один пример структурного белка – фиброин, который обнаружен у гусениц шелкопрядов. Это основной компонент шелковых нитей.
Двигательные белки
Роль белков в клетке переоценить невозможно. Они принимают участие и в работе мышц. Мышечное сокращение является важным физиологическим процессом. В результате происходит превращение запасенного в виде макромолекул АТФ в химическую энергию. Непосредственными участниками процесса являются два белка – актин и миозин.
Эти двигательные белки представляют собой нитевидные молекулы, которые функционируют в сократительной системе скелетных мышц. Также они обнаруживаются в немышечных тканях у эукариотических клеток. Еще один пример двигательных белков – тубулин. Из него построены микротрубочки, являющиеся важным элементом жгутиков и ресничек. Также микротрубочки, содержащие тубулин, обнаруживают в клетках нервной ткани животных.
Антибиотики
Огромна защитная роль белков в клетке. Частично ее возлагают на группу, которую принято называть антибиотиками. Это вещества природного происхождения, которые синтезируются, как правило, в бактериях, микроскопических грибах и прочих микроорганизмах. Они нацелены на подавление физиологических процессов других конкурирующих организмов. Открыты антибиотики белкового происхождения были в 40-х годах. Они произвели революцию в медицине, дав ей мощный толчок к развитию.
По своей химической природе антибиотики – весьма разнообразная группа. Они различаются и по механизму действия. Одни препятствуют синтезу белка внутри клеток, вторые блокируют выработку важных ферментов, третьи подавляют рост, четвертые – размножение. Например, хорошо известный стрептомицин взаимодействуют с рибосомами бактериальных клеток. Таким образом, в них резко замедляется синтез белков. При этом данные антибиотики не взаимодействуют с эукариотическими рибосомами организма человека. Это значит, что для высших млекопитающих данные вещества не токсичны.
Это далеко не все функции белков в клетке. Таблица антибиотических веществ позволяет определить и другие узкоспециализированные действия, которые эти специфические природные соединения способны оказывать на бактерии и не только. В настоящее время ведутся изучения антибиотиков белкового происхождения, которые при взаимодействии с ДНК нарушают процессы, связанные с воплощением наследственной информации. Но пока такие вещества используют только при химиотерапии онкологических заболеваний. Примером такого антибиотического вещества является дактиномицин, синтезируемый актиномицетами.
Токсины
Белки в клетке выполняют функцию весьма специфическую и даже неординарную. У ряда живых организмов вырабатываются ядовитые вещества – токсины. По своей природе это белки и сложные низкомолекулярные органические соединения. В качестве примера можно привести ядовитую мякоть гриба бледная поганка.
Запасные и пищевые белки
Некоторые белки выполняют функцию по обеспечению питанием зародышей животных и растений. Таких примеров много. Значение белка в клетке семян злаковых заключено именно в этом. Они будут питать формирующийся зачаток растения на первых стадиях его развития. У животных пищевыми белками являются яичный альбумин и молочный казеин.
Неизученные свойства белков

Приведенные выше примеры – лишь та часть, что уже достаточно изучена. Но в природе остается много загадок. Белки в клетке многих биологических видов уникальны, и в настоящее время даже классифицировать их затруднительно. Например, монеллин – белок, обнаруженный и выделенный из африканского растения. На вкус он сладкий, но при этом не вызывает ожирения и не токсичен. В будущем это может быть превосходная замена сахару. Еще один пример – белок, обнаруженный у некоторых арктических рыб, он препятствует замерзанию крови, действуя как антифриз в буквальном смысле этого сравнения. У ряда насекомых в соединениях крыльев выявлен белок резилин, обладающий уникальной, практически идеальной эластичностью. И это далеко не все примеры веществ, которые только предстоит изучить и классифицировать.
Биология для студентов – 25. Синтез белка в клетке
Биосинтез белков идет в каждой живой клетке. Наиболее активен он в молодых растущих клетках, где синтезируются белки на построение их органоидов, а также в секреторных клетках, где синтезируются белки-ферменты и белки-гормоны.
Основная роль в определении структуры белков принадлежит ДНК. Отрезок ДНК, содержащий информацию о структуре одного белка, называют геном. Молекула ДНК содержит несколько сотен генов. В молекуле ДНК записан код о последовательности аминокислот в белке в виде определенно сочетающихся нуклеотидов. Код ДНК удалось расшифровать почти полностью. Сущность его состоит в следующем. Каждой аминокислоте соответствует участок цепи ДНК из трех рядом стоящих нуклеотидов.
Например, участок Т—Т—Т соответствует аминокислоте лизину, отрезок А—Ц—А — цистину, Ц—А—А — валину н т. д. Разных аминокислот — 20, число возможных сочетаний из 4 нуклеотидов по 3 равно 64. Следовательно, триплетов с избытком хватает для кодирования всех аминокислот.
Синтез белка — сложный многоступенчатый процесс, представляющий цепь синтетических реакций, протекающих по принципу матричного синтеза.
Поскольку ДНК находится в ядре клетки, а синтез белка происходит в цитоплазме, существует посредник, передающий информацию с ДНК на рибосомы. Таким посредником является и-РНК.
В биосинтезе белка определяют следующие этапы, идущие в разных частях клетки:
- Первый этап — синтез и-РНК происходит в ядре, в процессе которого информация, содержащаяся в гене ДНК, переписывается на и-РНК. Этот процесс называется транскрипцией (от лат. «транскриптик» — переписывание).
- На втором этапе происходит соединение аминокислот с молекулами т-РНК, которые последовательно состоят из трех нуклеотидов — антикодонов, с помощью которых определяется свой триплет-кодон.
- Третий этап — это процесс непосредственного синтеза полипептидных связей, называемый трансляцией . Он происходит в рибосомах.
- На четвертом этапе происходит образование вторичной и третичной структуры белка, то есть формирование окончательной структуры белка.
Синтез информационной РНК (и-РНК) происходит в ядре. Он осуществляется по одной из нитей ДНК с помощью ферментов и с учетом принципа комплиментарности азотистых оснований. Процесс переписывания информации, содержащейся в генах ДНК на синтезируемую молекулу и-РНК называется транскрипцией. Очевидно, что информация переписывается в виде последовательности нуклеотидов РНК. Нить ДНК в этом случае выступает в качестве матрицы. В молекулу РНК в процессе ее образования вместо азотистого основания – тимина включается урация.
— Г — Ц — А — А — Ц — Т – фрагмент одной из цепочек молекулы ДНК— Ц — Г — У — У — Г — А – фрагмент молекулы информационной РНК.
Молекулы РНК индивидуальны, каждая из них несет информацию об одном гене. Далее молекулы и-РНК выходят из ядра клетки через поры оболочки ядра и направляются в цитоплазму к рибосомам. Сюда же с помощью транспортных РНК (т-РНК) доставляются аминокислоты. Молекула т-РНК состоит из 70–80 нуклеотидов. Общий вид молекулы напоминает лист клевера.

На «верхушке» листа расположен антикодон (кодовый триплет нуклеотидов), который соответствует определенной аминокислоте. Следовательно, для каждой аминокислоты существует своя, конкретная т-РНК. Процесс сборки молекулы белка идет в рибосомах и называется трансляцией. На одной молекуле и-РНК последовательно располагаются несколько рибосом. В функциональном центре каждой рибосомы способны поместиться два триплета и-РНК. Кодовый триплет нуклеотидов – молекулы т-РНК, подошедшей к месту синтеза белка, соответствует триплету нуклеотидов и-РНК, находящемуся в данный момент в функциональном центре рибосомы. Тогда рибосома по цепочке и-РНК делает шаг, равный трем нуклеотидам. Аминокислота отделяется от т-РНК и становится в цепочку мономеров белка. Освободившаяся т-РНК уходит в сторону и через некоторое время может снова соединиться с определенной кислотой, которую будет транспортировать к месту синтеза белка. Таким образом, последовательность нуклеотидов в триплете ДНК соответствует последовательности нуклеотидов в триплете и-РНК.
В сложнейшем процессе биосинтеза белка реализуются функции многих веществ и органоидов клетки.
Таким образом, в процессе биосинтеза белка образуются новые молекулы белка в соответствии с точной информацией, заложенной в ДНК. Этот процесс обеспечивает обновление белков, процессы обмена веществ, рост и развитие клеток, то есть все процессы жизнедеятельности клетки.
Синтез белков в клетке – описание, функции процесса :: SYL.ru
Белки играют очень важную роль в жизнедеятельности организмов, выполняют защитные, структурные, гормональные, энергетические функции. Обеспечивают рост мышечной и костной ткани. Белки информируют о строении клетки, о её функциях и биохимических свойствах, входят в состав ценных, полезных организму продуктов питания (яиц, молочных продуктов, рыбы, орехов, бобовых, ржи и пшеницы). Усвояемость такой пищи объясняется биологической ценностью. При равном показателе количества белка легче будет усваиваться тот продукт, чья ценность выше. Дефектные полимеры должны удаляться из организма и заменяться новыми. Этот процесс протекает при синтезе белков в клетках.

Какими бывают белки
Вещества, состоящие только из остатков аминокислот, называются простыми белками (протеинами). В случае необходимости используется их энергетическое свойство, поэтому людям, ведущим здоровый образ жизни, зачастую дополнительно нужен прием протеина. Сложные же белки, протеиды, имеют в своем составе простой белок и небелковую часть. Десять аминокислот в белке являются незаменимыми, это означает, что организм не может синтезировать их самостоятельно, они поступают из пищи, другой же десяток – заменимый, то есть их можно создать из других аминокислот. Так начинается жизненно необходимый для всех организмов процесс.

Основные этапы биосинтеза: откуда берутся белки
Новые молекулы берутся в результате биосинтеза – химической реакции соединения. Существует два основных этапа синтеза белков в клетке. Это транскрипция и трансляция. Транскрипция происходит в ядре. Это считывание с ДНК (дезоксирибонуклеиновой кислоты), которая несет информацию о будущем белке, на РНК (рибонуклеиновую кислоту), которая переносит эту информацию с ДНК в цитоплазму. Происходит это по причине того, что ДНК непосредственно в биосинтезе участия не принимает, она только несет сведения, не имея способности выходить в цитоплазму, где синтезируется белок, и выполняя только функцию носителя генетической информации. Транскрипция же позволяет считать данные с матрицы ДНК на РНК по принципу комплементарности.

Роль РНК и ДНК в процессе
Итак, запускает синтез белков в клетках цепочка ДНК, которая несет информацию о каком-либо конкретном белке и называется геном. Цепочка ДНК в процессе транскрипции расплетается, то есть её спираль начинает распадаться в линейную молекулу. С ДНК информация должна преобразоваться на РНК. Напротив тимина в данном процессе должен становиться аденин. Цитозин же имеет в качестве пары гуанин, точно так же, как ДНК. Напротив аденина РНК становится урацил, потому как в РНК такого нуклеотида, как тимин, не существует, он заменяется просто урациловым нуклеотидом. С гуанином соседствует цитозин. Напротив аденина становится урацил, а в паре с тимином располагается аденин. Эти молекулы РНК, которые становятся напротив, называются информационными РНК (иРНК). Они способны через поры выходить из ядра в цитоплазму и рибосомы, которые, собственно, и выполняют функцию синтеза белков в клетках.
О сложном простыми словами
Теперь же совершается сборка из аминокислотных последовательностей полипептидной цепочки белка. Транскрипцией можно назвать считывание информации о будущем белке с матрицы ДНК на РНК. Это можно определить как первый этап. После того как РНК выходит из ядра, она должна попасть к рибосомам, где происходит второй этап, который называется трансляцией.
Трансляция – это уже переход РНК, то есть перенос информации с нуклеотидов на молекулу белка, когда РНК говорит о том, какая последовательность аминокислот должна быть в веществе. В таком порядке информационная РНК попадает в цитоплазму к рибосомам, которые осуществляют синтез белков в клетке: А (аденин) – Г (гуанин) – У (урацил) – Ц (цитозин) – У (урацил) – А (аденин).
Зачем нужны рибосомы
Для того чтобы произошла трансляция и в результате образовался белок, нужны такие компоненты, как сама информационная РНК, транспортная РНК, а также рибосомы в качестве “фабрики”, на которой производится белок. В данном случае функционируют две разновидности РНК: информационная, которая образовалась в ядре с ДНК, и транспортная. Молекула второй кислоты имеет вид клевера. Этот “клевер” присоединяет к себе аминокислоту и несет её к рибосомам. То есть он выполняет транспортировку органических соединений непосредственно к “фабрике” по их образованию.
Как работает рРНК
Также существуют рибосомальные РНК, которые входят в состав самой рибосомы и выполняют синтез белка в клетке. Получается, что рибосомы являются немембранными структурами, они не имеют оболочек, как, например, ядро или эндоплазматическая сеть, а состоят просто из белков и рибосомальных РНК. Что же происходит, когда последовательность из нуклеотидов, то есть информационная РНК, попадает к рибосомам?
Транспортная РНК, которая находится в цитоплазме, подтягивает к себе аминокислоты. Откуда же взялись аминокислоты в клетке? А образуются они вследствие расщепления белков, которые поступают внутрь с пищей. Эти соединения переносятся током крови к клеткам, где происходит продуцирование необходимых для организма белков.
Конечный этап синтеза белков в клетках
Аминокислоты плавают в цитоплазме так же, как и транспортные РНК, и когда происходит непосредственно сборка полипептидной цепи, эти транспортные РНК начинают с ними соединяться. Однако не во всякой последовательности и далеко не любая транспортная РНК может соединиться со всеми видами аминокислот. Существует определенный участок, к которому присоединяется необходимая аминокислота. Второй же участок транспортной РНК называется антикодоном. Этот элемент состоит из трех нуклеотидов, которые комплементарны последовательности нуклеотидов в информационной РНК. Для одной аминокислоты необходимо три нуклеотида. Например, какой-либо условный белок состоит для упрощения из всего лишь двух аминокислот. Очевидно, что в основном белки имеют очень длинную структуру, состоят из многих аминокислот. Цепь А – Г – У называется триплетом, или кодоном, к нему будет присоединяться транспортная РНК в виде клевера, на конце которого будет находиться определенная аминокислота. К следующему триплету Ц – У – А будет присоединяться еще одна тРНК, которая будет содержать совершенно другую аминокислоту, комплементарную данной последовательности. В таком порядке будет происходить дальнейшая сборка полипептидной цепочки.
Биологическое значение синтеза
Между двумя аминокислотами, находящимися на концах “клеверов” каждого триплета, образуется пептидная связь. На этом этапе транспортная РНК уходит в цитоплазму. К триплетам присоединяется затем следующая транспортная РНК с другой аминокислотой, которая образует с предыдущими двумя полипептидную цепь. Этот процесс повторяется до момента, когда набирается необходимая последовательность аминокислот. Таким образом происходит синтез белка в клетке, и образуются ферменты, гормоны, кровяные вещества и т. д. Не во всякой клетке образуется любой белок. Каждая клетка может образовать определенный белок. Например, в эритроцитах будет образовываться гемоглобин, а клетками поджелудочной железы будут синтезироваться гормоны и разнообразные ферменты, расщепляющие пищу, которая попадает в организм.
В мышцах же будет образовываться белок актин и миозин. Как видно, процесс синтеза белка в клетках многоэтапен и сложен, что говорит о его значимости и необходимости для всего живого.
Транспортные белки — Википедия
Тра́нспортные белки́ — собирательное название большой группы белков, выполняющих функцию переноса различных лигандов как через клеточную мембрану или внутри клетки (у одноклеточных организмов), так и между различными клетками многоклеточного организма. Транспортные белки могут быть как интегрированными в мембрану, так и водорастворимыми белками, секретируемыми из клетки, находящимися в пери- или цитоплазматическом пространстве, в ядре или органеллах эукариот.
Основные группы транспортных белков:
Транспортная функция белков — участие белков в переносе веществ в клетки и из клеток, в их перемещениях внутри клеток, а также в их транспорте кровью и другими жидкостями по организму.
Есть разные виды транспорта, которые осуществляются при помощи белков.
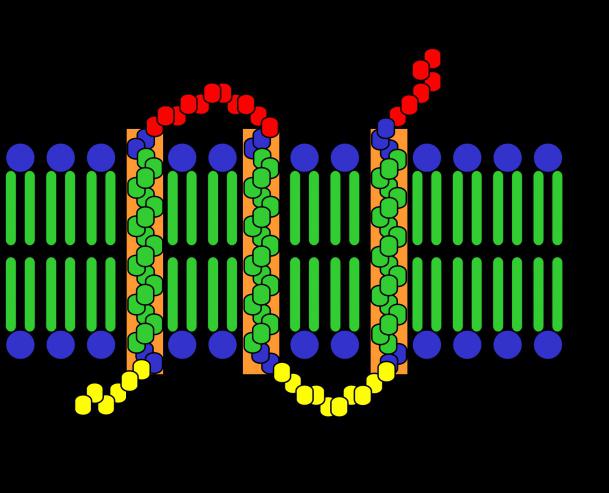
Перенос веществ через клеточную мембрану[править | править код]
У всех клеток есть мембрана, состоящая из двойного слоя липидов. В клетку должны поступать многие необходимые для жизни вещества (сахара, аминокислоты, ионы щелочных металлов), но липидный бислой для них практически непроницаем. Поэтому в состав мембраны входят транспортные белки, которые и осуществляют перенос полярных или заряженных соединений. Транспорт этих соединений в клетку делится на активный и пассивный. Пассивный транспорт — транспорт веществ из области с высокой концентрацией в область низкой без затрат энергии, то есть диффузия. Она делится на 2 варианта: простая и облегчённая.
В облегчённой диффузии участвуют белки-переносчики. Этот вариант может сопровождаться конформационными изменениями белка. Есть несколько путей переноса веществ в этом случае: когда участвует один белок и когда участвуют несколько. Если участвует один белок(транслоказа), то он связывает вещество, потом сближается с другой стороной мембраны, отдаёт связанное вещество и возвращается в исходное состояние. Если участвуют несколько белков, то один связывается с веществом, потом передаёт его другому и так далее, пока вещество не дойдёт по цепи до противоположной стороны мембраны.
Пассивный транспорт обеспечивают также белки-каналы. Каналообразующие белки образуют в мембране водные поры, через которые (когда они открыты) могут проходить вещества. особые семейства каналообразующих белков (коннексины и паннексины) формируют щелевые контакты, через которые низкомолекулярные вещества могут транспортироваться из одной клетки в другую (через паннексины и в клетки из внешней среды).
Активный транспорт происходит против градиента концентрации и протекает с затратой энергии. В активном транспорте участвуют белки-переносчики. Энергия, которая требуется для осуществления активного транспорта, обычно получается транспортными белками при расщеплении АТФ. Один из наиболее изученных белков, осуществляющих активный транспорт — Na+/K+-аденозинтрифосфатаза. За полный цикл работы этого насоса в клетку попадают из внешней среды 2 иона K+ и выбрасывается наружу 3 иона Na+.
Ещё один путь попадания веществ внутрь клетки — их поглощение путём эндоцитоза. В этом процессе также могут участвовать специальные транспортные белки. Например, гастромукопротеид (внутренний фактор Касла), который синтезируется в клетках слизистой оболочки желудка, обеспечивает поглощение путём эндоцитоза клетками подвздошной кишки витамина B12.
Этот перенос осуществляется между ядром и другими органоидами и цитоплазмой клетки. Например, перенос белков между ядром и цитоплазмой (ядерно-цитоплазматический транспорт) происходит благодаря ядерным порам, которые пронизывают двухслойную оболочку ядра. Они состоят примерно из тридцати белков — нуклеопоринов. Вещества переносятся из цитоплазмы в ядро клетки вместе с белками — транспортинами. Эти белки узнают вещества, предназначенные для транспорта в ядро, и связываются с ними. Затем этот комплекс белков заякоривается на белках ядерной поры и попадает в её канал, а затем в ядро. Там она связывается ещё с одним белком и распадается, а транспортины направляются обратно в цитоплазму.
Перенос белков из цитоплазмы к другим органоидам клетки происходит с помощью белков-переносчиков. В этом процессе участвуют также шапероны.
Также для транспортировки веществ внутри клеток используются микротрубочки — структуры, состоящие из белков тубулинов. По их поверхности могут передвигаться митохондрии и мембранные пузырьки с грузом (везикулы). Этот транспорт осуществляют моторные белки. Они делятся на два типа: цитоплазматические динеины и кинезины. Эти две группы белков различаются тем, от какого конца микротрубочки они перемещают груз: динеины от + -конца к — -концу, а кинезины в обратном направлении.
Транспорт веществ по организму в основном осуществляется кровью. Кровь переносит гормоны, пептиды, ионы от эндокринных желез к другим органам, переносит конечные продукты метаболизма к органам выделения, переносит питательные вещества и ферменты, кислород и углекислый газ.
Наиболее известный транспортный белок, осуществляющий транспорт веществ по организму — это гемоглобин. Он переносит кислород и диоксид углерода по кровеносной системе от лёгких к органам и тканям. У человека около 15 % углекислого газа транспортируется к лёгким с помощью гемоглобина. В скелетных и сердечной мышцах перенос кислорода выполняется белком, который называется миоглобин.
В плазме крови всегда находятся транспортные белки — сывороточные альбумины. Жирные кислоты, например, транспортируются альбуминами сыворотки крови. Кроме того, белки группы альбуминов, например, транстиретин, транспортируют гормоны щитовидной железы. Также важнейшей транспортной функцией альбуминов является перенос билирубина, желчных кислот, стероидных гормонов, лекарств (аспирин, пенициллины) и неорганических ионов.
Другие белки крови — глобулины переносят различные гормоны, липиды и витамины. Транспорт ионов меди в организме осуществляет глобулин — церулоплазмин, транспорт ионов железа — белок трансферрин, транспорт витамина B12 — транскобаламин.
Виды белков, их функции и структура
По теории Опарина-Холдейна жизнь на нашей планете зародилась из коацерватной капельки. Она же представляла собой молекулу белка. То есть следует вывод, что именно эти химические соединения – основа всего живого, что существует сегодня. Но что же собой представляют белковые структуры? Какую роль сегодня они играют в организме и жизни людей? Какие виды белков существуют? Попробуем разобраться.
Белки: общее понятие
С точки зрения химического строения, молекула рассматриваемого вещества представляет собой последовательность аминокислот, соединенных между собой пептидными связями.
Каждая аминокислота имеет две функциональные группы:
- карбоксильную -СООН;
- амино-группу -NH2.
Именно между ними и происходит формирование связи в разных молекулах. Таким образом, пептидная связь имеет вид -СО-NH. Молекула белка может содержать сотни и тысячи таких группировок, это будет зависеть от конкретного вещества. Виды белков очень разнообразны. Среди них есть и те, которые содержат незаменимые для организма аминокислоты, а значит должны поступать в организм с пищевыми продуктами. Существуют такие разновидности, которые выполняют важные функции в мембране клетки и ее цитоплазме. Также выделяют катализаторы биологической природы – ферменты, которые тоже являются белковыми молекулами. Они широко используются и в быту человека, а не только участвуют в биохимических процессах живых существ.
Молекулярная масса рассматриваемых соединений может колебаться от нескольких десятков до миллионов. Ведь количество мономерных звеньев в большой полипептидной цепи неограниченно и зависит от типа конкретного вещества. Белок в чистом виде, в его нативной конформации, можно увидеть при рассмотрении куриного яйца в сыром виде. Светло-желтая, прозрачная густая коллоидная масса, внутри которой располагается желток – это и есть искомое вещество. То же самое сказать об обезжиренном твороге, Данный продукт также является практически чистым белком в его натуральном виде.
Однако не все рассматриваемые соединения имеют одинаковое пространственное строение. Всего выделяют четыре организации молекулы. Виды структур белка определяют его свойства и говорят о сложности строения. Также известно, что более пространственно запутанные молекулы подвергаются тщательной переработке в организме человека и животных.
Виды структур белка
Всего их выделяют четыре. Рассмотрим, что собой представляет каждая из них.
- Первичная. Представляет собой обычную линейную последовательность аминокислот, соединенных пептидными связями. Никаких пространственных закручиваний, спирализации нет. Количество входящих в полипептид звеньев может доходить до нескольких тысяч. Виды белков с подобной структурой – глицилаланин, инсулин, гистоны, эластин и другие.
- Вторичная. Представляет собой две полипептидные цепи, которые скручиваются в виде спирали и ориентируются по направлению друг к другу образованными витками. При этом между ними возникают водородные связи, удерживающие их вместе. Так формируется единая белковая молекула. Виды белков такого типа следующие: лизоцим, пепсин и другие.
- Третичная конформация. Представляет собой плотно упакованную и компактно собранную в клубок вторичную структуру. Здесь появляются другие типы взаимодействия, помимо водородных связей – это и ван-дер-ваальсово взаимодействие и силы электростатического притяжения, гидрофильно-гидрофобный контакт. Примеры структур – альбумин, фиброин, белок шелка и прочие.
- Четвертичная. Самая сложная структура, представляющая собой несколько полипептидных цепей, скрученных в спираль, свернутых в клубок и объединенных все вместе в глобулу. Такие примеры, как инсулин, ферритин, гемоглобин, коллаген, иллюстрируют собой как раз такую конформацию белков.
Если рассматривать все приведенные структуры молекул детально с химической точки зрения, то анализ займет много времени. Ведь на самом деле чем выше конфигурация, тем сложнее и запутаннее ее строение, тем больше типов взаимодействий наблюдается в молекуле.

Денатурация белковых молекул
Одним из самых важных химических свойств полипептидов является их способность разрушаться под влиянием определенных условий или химических агентов. Так, например, широко распространены разные виды денатурации белков. Что это за процесс? Он заключается в разрушении нативной структуры белка. То есть если изначально молекула имела третичную структуру, то после действия специальными агентами она разрушится. Однако при этом последовательность аминокислотных остатков остается в молекуле неизменной. Денатурированные белки быстро теряют свои физические и химические свойства.
Какие реагенты способны привести к процессу разрушения конформации? Таких несколько.
- Температура. При нагревании происходит постепенное разрушение четвертичной, третичной, вторичной структуры молекулы. Зрительно это можно наблюдать, например, при жарке обычного куриного яйца. Образующийся “белок” – это первичная структура полипептида альбумина, который был в сыром продукте.
- Радиация.
- Действие сильными химическими агентами: кислотами, щелочами, солями тяжелых металлов, растворителями (например, спиртами, эфирами, бензолом и прочими).
Данный процесс иногда еще называют плавлением молекулы. Виды денатурации белков зависят от агента, при действии которого она наступила. При этом в некоторых случаях имеет место процесс, обратный рассмотренному. Это ренатурация. Не все белки способны восстанавливать обратно свою структуру, однако значительная их часть может это делать. Так, химики из Австралии и Америки осуществили ренатурацию вареного куриного яйца при помощи некоторых реагентов и способа центрифугирования.
Этот процесс имеет значение для живых организмов при синтезе полипептидных цепочек рибосомами и рРНК в клетках.

Гидролиз белковой молекулы
Наравне с денатурацией, для белков характерно еще одно химическое свойство – гидролиз. Это также разрушение нативной конформации, но не до первичной структуры, а полностью до отдельных аминокислот. Важная часть пищеварения – гидролиз белка. Виды гидролиза полипептидов следующие.
- Химический. Основан на действии кислот или щелочей.
- Биологический или ферментативный.
Однако суть процесса остается неизменной и не зависит от того, какие виды гидролиза белков имеют место быть. В результате образуются аминокислоты, которые транспортируются по всем клеткам, органам и тканям. Дальнейшее их преобразование заключается в участии синтеза новых полипептидов, уже тех, что необходимы конкретному организму.
В промышленности процесс гидролиза белковых молекул используют как раз для получения нужных аминокислот.
Функции белков в организме
Различные виды белков, углеводов, жиров являются жизненно необходимыми компонентами для нормальной жизнедеятельности любой клетки. А значит и всего организма в целом. Поэтому во многом их роль объясняется высокой степенью значимости и повсеместной распространенности внутри живых существ. Можно выделить несколько основных функций полипептидных молекул.
- Каталитическая. Ее осуществляют ферменты, которые имеют белковую природу строения. О них скажем позже.
- Структурная. Виды белков и их функции в организме прежде всего влияют на структуру самой клетки, ее форму. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
- Регуляторная. Данная функция проявляется в участии полипептидов в таких процессах, как: транскрипция, трансляция, клеточный цикл, сплайсинг, считывание мРНК и прочих. Во всех них они играют важную роль регулировщика.
- Сигнальная. Данную функцию выполняют белки, находящиеся на мембране клеток. Они передают различные сигналы от одной единицы к другой, и это приводит к сообщению тканей между собой. Примеры: цитокины, инсулин, факторы роста и прочие.
- Транспортная. Некоторые виды белков и их функции, которые они выполняют, являются просто жизненно необходимыми. Так происходит, например, с белком гемоглобином. Он осуществляет транспорт кислорода от клетки к клетке в составе крови. Для человека он незаменим.
- Запасная или резервная. Такие полипептиды накапливаются в растениях и яйцеклетках животных как источник дополнительного питания и энергии. Пример – глобулины.
- Двигательная. Очень важная функция, особенно для простейших организмов и бактерий. Ведь они способны передвигаться только при помощи жгутиков или ресничек. А эти органоиды по своей природе не что иное, как белки. Примеры таких полипептидов следующие: миозин, актин, кинезин и прочие.
Очевидно, что функции белков в организме человека и других живых существ очень многочисленны и немаловажны. Это еще раз подтверждает, что без рассматриваемых нами соединений невозможна жизнь на нашей планете.
Защитная функция белков
Полипептиды могут защищать от разных воздействий: химических, физических, биологических. Например, если организму угрожает опасность в виде вируса или бактерии, имеющих чужеродную природу, то иммуноглобулины (антитела) вступают с ними “в бой”, выполняя защитную роль.
Если говорить о физических воздействиях, то здесь большую роль играют, например, фибрин и фибриноген, которые участвуют в свертывании крови.
Белки пищевые
Виды пищевого белка следующие:
- полноценные – те, что содержат все необходимые для организма аминокислоты;
- неполноценные – те, в которых находится неполный аминокислотный состав.
Однако для организма человека важны и те и другие. Особенно первая группа. Каждый человек, особенно в периоды интенсивного развития (детский и юношеский возраст) и полового созревания должен поддерживать постоянный уровень протеинов в себе. Ведь мы уже рассмотрели функции, которые выполняют эти удивительные молекулы, и знаем, что практически ни один процесс, ни одна биохимическая реакция внутри нас не обходится без участия полипептидов.
Именно поэтому необходимо каждый день потреблять суточную норму протеинов, которые содержатся в следующих продуктах:
- яйцо;
- молоко;
- творог;
- мясо и рыба;
- бобы;
- соя;
- фасоль;
- арахис;
- пшеница;
- овес;
- чечевица и прочие.
Если потреблять в день 0,6 г полипептида на один кг веса, то у человека никогда не будет недостатка в этих соединениях. Если же длительное время организм недополучает необходимых белков, то наступает заболевание, имеющее название аминокислотного голодания. Это приводит к сильному нарушению обмена веществ и, как следствие, многим другим недугам.
Белки в клетке
Внутри самой маленькой структурной единицы всего живого – клетки – также находятся белки. Причем выполняют они там практически все вышеперечисленные свои функции. В первую очередь формируют цитоскелет клетки, состоящий из микротрубочек, микрофиламентов. Он служит для поддержания формы, а также для транспорта внутри между органоидами. По белковым молекулам, как по каналам или рельсам, движутся различные ионы, соединения.
Немаловажна роль белков, погруженных в мембрану и находящихся на ее поверхности. Здесь они и рецепторные, и сигнальные функции выполняют, принимают участие в строительстве самой мембраны. Стоят на страже, а значит играют защитную роль. Какие виды белков в клетке можно отнести к этой группе? Примеров множество, приведем несколько.
- Актин и миозин.
- Эластин.
- Кератин.
- Коллаген.
- Тубулин.
- Гемоглобин.
- Инсулин.
- Транскобаламин.
- Трансферрин.
- Альбумин.
Всего насчитывается несколько сотен различных видов протеинов, которые постоянно передвигаются внутри каждой клетки.
Виды белков в организме
Их, конечно же, огромное разнообразие. Если же попытаться как-то разделить все существующие протеины на группы, то может получиться примерно такая классификация.
- Глобулярные белки. Это такие, которые представлены третичной структурой, то есть плотно упакованной глобулой. Примеры таких структур следующие: иммуноглобулины, значительная часть ферментов, многие гормоны.
- Фибриллярные белки. Представляют собой строго упорядоченные нити, имеющие правильную пространственную симметрию. К данной группе относятся протеины с первичной и вторичной структурой. Например, кератин, коллаген, тропомиозин, фибриноген.

Вообще, можно взять за основу множество признаков для классификации белков, находящихся в организме. Единой пока не существует.
Ферменты
Биологические катализаторы белковой природы, которые значительно ускоряют все происходящие биохимические процессы. Нормальный обмен веществ просто невозможен без этих соединений. Все процессы синтеза и распада, сборка молекул и их репликация, трансляция и транскрипция и прочие осуществляются под воздействием специфического вида фермента. Примерами этих молекул могут служить:
- оксидоредуктазы;
- трансферазы;
- каталазы;
- гидролазы;
- изомеразы;
- лиазы и прочие.
Сегодня ферменты используются и в быту. Так, при производстве стиральных порошков часто используют так называемые энзимы – это и есть биологические катализаторы. Они улучшают качество стирки при соблюдении указанного температурного режима. Легко связываются с частицами грязи и выводят их с поверхности тканей.
Однако из-за белковой природы энзимы не переносят слишком горячую воду или соседство с щелочными или кислотными препаратами. Ведь в этом случае произойдет процесс денатурации.
Биосинтез белка в клетке — кратко и понятно

Как объяснить, кратко и понятно, что такое биосинтез белка, и какого его значение?
Если вам интересна эта тема, и вы хотели бы подтянуть школьные знания или же повторить пропуски, то эта статья создана для вас.
Что такое биосинтез белка
Сначала стоит ознакомиться с определением биосинтеза. Биосинтезом называется синтез живыми организмами природных органических соединений.

Если быть проще, то это получение различных веществ с помощью микроорганизмов. Этот процесс занимает важную роль во всех живых клетках. Не забываем и о сложном биохимическом составе.
Транскрипция и трансляция
Это два наиглавнейших шага биосинтеза.

Транскрипция с латинского означает «переписывание» – в качестве матрицы применяется ДНК, поэтому происходит синтезирование трёх видов РНК (матричной/информационной, транспортной, рибосомной рибонуклеиновых кислот). Реакция осуществляется с помощью полимеразы (РНК) и с использованием большого количества аденозинтрифосфата.
Выделают два основных действия:
- Обозначение конца и начала трансляции присоединением иРНК.
- Событие, осуществляемое благодаря сплайсингу, который в свою очередь удаляет неинформационные последовательности РНК, тем самым происходит уменьшение массы матричной рибонуклеиновой кислоты в 10 раз.
Трансляция с латинского означает «перевод» – используется иРНК в качестве матрицы, синтезируются полипептидные цепочки.
Трансляция включает в себя три этапа, которые можно было представить в виде таблицы:
- Первый этап. Инициация — формирование комплекса, который участвует в синтезе полипептидной цепочки.
- Второй этап. Элонгация — увеличение размеров этой цепи.
- Третий этап. Терминация — заключение выше упомянутого процесса.
Схема биосинтеза белка
По схеме видно, как протекает процесс.

Точкой стыковки этой схемы являются рибосомы, в которых синтезируется белок. В простой форме синтез осуществляется по схеме
ДНК > PHK > белок.
Первым начинается этап транскрипции, в котором молекула изменяется в одноцепочную информационную рибонуклеиновую кислоту (иРНК). В ней содержится информация аминокислотной последовательности белка.
Следующей остановкой иРНК будет рибосома, в которой происходит сам синтез. Происходит это путём трансляции, формирования полипептидной цепочки. После этой заурядной схемы, полученный белок транспортируется в разные места, выполняя определённые задачи.
Последовательность процессоров биосинтеза белка
Биосинтез белка – сложный механизм, который включает в себя два выше упомянутых этапа, а именно транскрипцию и трансляцию. Первым происходит транскрибируемый этап (он разделяется на два события).
После идёт трансляция, в которой участвуют все виды РНК, у каждой есть своя функция:
- Информационная – роль матрицы.
- Транспортная – добавление аминокислот, определение кодонов.
- Рибосомная – образование рибосом, которые поддерживают иРНК.
- Транспортная – синтез полипептидной цепи.
Какие компоненты клетки участвуют в биосинтезе белка
Как мы уже говорили, биосинтез разделяют на две стадии. В каждой стадии участвуют свои компоненты. На первой стадии это дезоксирибонуклеиновая кислота, информационная и транспортная РНК, нуклеотиды.
Во второй же стадии участвуют компоненты: иРНК, тРНК, рибосомы, нуклеотиды и пептиды.
Каковы особенности реакций биосинтеза белка в клетке
В список особенностей реакций биосинтеза стоит отнести:
- Использование энергии АТФ для химических реакций.
- Присутствуют ферменты, задача которых ускорять реакции.
- Реакция имеет матричный характер, так как белок синтезируется на иРНК.
Признаки биосинтеза белка в клетке
Для такого сложного процесса, конечно же, характерны различные признаки:
- Первый из них заключается в том, что присутствуют ферменты, без которых сам процесс был бы невозможен
- Задействованы все три вида РНК, из этого можно сделать вывод, что центральная роль принадлежит РНК.
- Образование молекул производится мономерами, а именно аминокислотами.
- Стоит обозначить так же, что специфичность того или иного белка ориентируется расположением аминокислот.
Заключение
Многоклеточный организм — аппарат, состоящий из разных клеточных типов, которые дифференцированы – отличаются структурой и функциями. Кроме белков, присутствуют клетки этих типов, которые синтезируют так же себе подобных, в этом заключается различие.