Аминокислоты характеристика: Урок №54. Аминокислоты, их строение, изомерия и свойства. – Подробная характеристика аминокислот | Академия здоровья Ольги Бутаковой
Персональный сайт – Общая характеристика белков и аминокислот
Химия белков: Общая характеристика белков и аминокислот.
Общая характеристика и биологическое значение белков.
Белки являются наиболее важными и сложными органическими соединениями, входящими в состав живых организмов. Не только каждый вид живого, но и каждый орган, каждый тип клеток обладает своим специфическим набором белков.
В количественном соотношении они занимают первое место среди всех содержащихся в живой клетке макромолекул. Так, в организме человека белки составляют 40-50% из расчета на сухую массу.
Каждый индивидуум отличается от подобных своего вида собственным набором белков (биохимическая индивидуальность). Эта индивидуальность поддерживается всеми живущими организмами. При внедрении в организм чужих белков образуются защитные вещества (антитела) и разрушают чужие белки. Однако имеется и общность между определенными белками одного и того же вида, которая позволяет проводить обмен белками (например, переливание крови).
Белки – это высокомолекулярные соединения, построенные из аминокислот. В создание белков участвует 20 аминокислот. Они связываются между собой в длинные цепи, которые образуют основу белковой молекулы большой молекулярной массы.
Белки выполняют важные функции в организме:
Ø Каталитическая – практически все химические реакции, протекающие в животной клетке, катализируются специфическими веществами, называемыми ферментами. По химической природе все ферменты являются белками.
Ø Структурная – белки составляют 1/5 част, или 20% массы тела. Коллаген – структурный белок соединительной ткани.
Ø Энергетическая – при полном распаде 1 г белка выделяется 17,15 кДж (4,1 ккал) энергии, что указывает на их способность участвовать в обеспечении организма энергией. Однако использование белков для этих целей происходит только в том случае, когда отмечается недостаток основных источников энергии – углеводов и жиров.
Ø Транспортная – определенная группа белков крови обладает способностью взаимодействовать с различными соединениями и переносить их. Так транспортируются в организме нерастворимые в воде вещества (ионы, металлы, газы) или токсические продукты (билирубин, жирные кислоты и др.). Примером транспортных белков могут служить гемоглобин (переносящий кислород и углекислый газ), трансферрин (белок транспортирующий железо), липопротеиды – сложные белки транспортирующие липиды.
Ø Защитная – в процессе эволюции выработались механизмы узнавания и связывания «чужих» молекул с помощью специфических белков (антител).
Ø Регуляторная – определенные белки являются гормонами, участвуют в регуляции разнообразных процессов, протекающих в организме. Белки участвуют в регуляции важных констант крови: создают онкотическое давление крови; входят в состав буферных систем, влияют на кислотно-основное равновесие крови.
Ø Участие белков в процессах наследственности, т.е. хранении и передачи генетической информации. Эта функции выполняется сложными белками – нуклеопротеидами.
Ø Сократительная – важным признаком живого является подвижность. В основе ее лежит сократительная функция белков.
Ø Гемостатическая функция – белки участвуют в образовании тромба и предотвращении кровотечения.
Химический состав белков.
Белки являются сложными соединениями, полимерами, которые состоят из простых, низкомолекулярных веществ – мономеров.
Химический анализ показал наличие во всех белках углерода, кислорода, водорода, азота и серы, содержание которых следующее: углерода – 50-55%, водорода – 6-7%, кислорода – 21-23%, азота – 15-17%, серы – 0,3-2,5%. В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы в различных, часто очень маленьких количествах.
Содержание основных химических элементов в отдельных белках может различаться, за исключением азота, концентрация которого характеризуется наибольшим постоянством и в среднем составляет 16%.
Исходными составными частями белков являются аминокислоты, которые определяют физико-химические и биологические свойства белков.
Аминокислоты – это аминопроизводные класса карбоновых кислот.
Аминокислоты живых организмов можно разделить на протеиногенные (кодируются генетическим кодом) и непротеиногенные (не кодируются генетическим кодом). Протеиногенных аминокислот 20; 19 из них являются α-аминокислотами, что означает, что атом водорода α-углеродного атома замещен на аминогруппу (NH2). Общая формула этих аминокислот выглядит следующим образом:
Только одна аминокислота –
α-углеродный атом аминокислот является асимметричным (исключение составляет аминопроизводное уксусной кислоты — глицин). У каждой аминокислоты имеются как минимум два оптически активных антипода. Природа выбрала для создания белков L-форму, поэтому природные белки построены из L-α-аминокислот.
Для классификации аминокислот пользуются физико-химическими свойствами их радикалов. Существуют разные подходы к такой классификации.
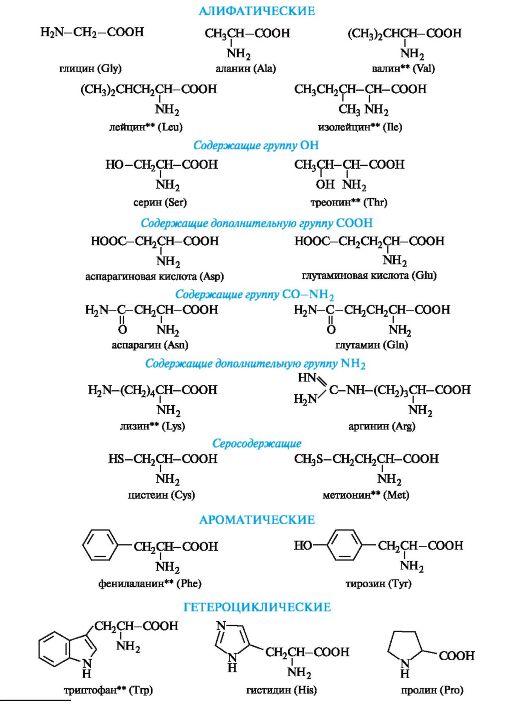
Большая часть аминокислот – это алифатические соединения, две аминокислоты принадлежат к ароматическому ряду и две – к гетероциклическому.
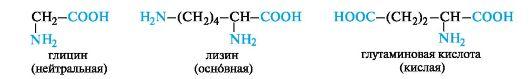
Аминокислоты можно разделить по их свойствами на основные, нейтральные и кислые.
Они отличаются числом амино- и карбоксильных групп в молекуле. Нейтральные содержат по одной амино- и одной карбоксильной группе. Кислые имеют две карбоксильные и одну аминогруппу, основные — две аминогруппы и одну карбоксильную.
Пользуясь таким свойством аминокислот, как полярность, можно разделить их на группу неполярных (гидрофобных) аминокислот (аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, триптофан), группу полярных (гидрофильных) незаряженных аминокислот (глицин, серии, треонин, цистеин, тирозин, аспарагин, глутамин), группу отрицательно заряженных (кислых) аминокислот (аспарагиновая и глутаминовая кислоты) и группу положительно заряженных (основных) аминокислот (аргинин и лизин).
По способности человека синтезировать их из предшественников
Незаменимые: Триптофан, Фенилаланин, Лизин, Треонин, Метионин, Лейцин, Изолейцин, Валин.
Заменимые: Тирозин, Цистеин, Гистидин, Аргинин, Глицин, Аланин, Серин, Глутамат, Глутамин, Аспартат, Аспарагин, Пролин.
Некоторые заменимые аминокислоты синтезируются в организме человека в недостаточных количествах и должны поступать с пищей.
Характеристика аминокислот
Собственно алифатическими можно назвать 5 аминокислот.
Глицин (Гли), или гликокол (аминоуксусная кислота), является единственной оптически неактивной аминокислотой из-за отсутствия ассиметрического углеродного атома. Глицин участвует в синтезе белка, образовании нуклеиновых и желчных кислот (его атомы входят в состав нуклеотидов, гема и в состав важного трипептида глутатиона), а также необходим для обезвреживания в печени токсических продуктов.
Аланин (Ала) (аминопропионовая кислота) нередко используется организмом для синтеза глюкозы.
Валин (Вал) — аминоизовалериановая кислота, лейцин (Лей)
— аминоизокапроновая кислота, изолейцин (Иле) — α-амино-β-этил-β-метилпропионовая кислота, обладая выраженными гидрофобными свойствами, играют важную роль в формировании пространственной структуры белковой молекулы. Активно участвуют в обмене веществ.Гидроксиаминокислоты:
Серин (Сер) — α-амино-β-гидроксипропионовая кислота и Треонин (Тре) — α-амино-β-гидроксимасляная кислота — играют важную роль в процессах ковалентной модификации структуры белков. Их гидроксильная группа легко взаимодействует с фосфорной кислотой, что бывает необходимым для изменения функциональной активности белков. Серин входит в состав различных ферментов, основного белка молока – казеина, обнаружен в составе липопротеидов и других белков. Треонин участвует в биосинтезе белка.
Серосодержащие аминокислоты.
Цистеин (Цис) — α-амино-β-тиопропионовая кислота, благодаря активной —SH-группе легко вступает в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в образовании дисульфидных мостиков, стабилизирующих структуру белков. Две молекулы цистеина, окисляясь, образуют цистин. При этом образуется дисульфидная связь.
Метионин (Мет) — α-амино-β-тиометилмасляная кислота — выполняет функцию донора подвижной метильной группы, необходимой для синтеза биологически активных соединений: холина, нуклеотидов и т. д.
Дикарбоновые аминокислоты:
Глутаминовая (Глу) — α-аминоглутаровая кислота и Аспарагиновая (Асп) — α-аминоянтарная кислота — наиболее распространенные аминокислоты белков животных организмов. Обладая дополнительной карбоксильной группой в радикале, эти аминокислоты способствуют ионному взаимодействию, придают заряд белковой молекуле. Они участвуют в биосинтезе белка, образовании важнейших соединений (тормозных медиаторов нервной системы, других аминокислот), энергетическом обмене. Эти аминокислоты могут образовывать амиды.
- Амиды дикарбоновых аминокислот: глутамин (Гли) и аспарагин (Асн) — выполняют важную функцию в обезвреживании и транспорте аммиака в организме.
Циклические аминокислоты имеют в своем радикале ароматическое или гетероциклическое ядро.
Фенилаланин (Фен) —α-амино-β-фенилпропионовая кислота и Тирозин (Тир) — α-амино-β-параоксифенилпропионовая кислота — эти две аминокислоты образуют взаимосвязанную пару, выполняющую важные функции в организме, например участие их в синтезе ряда биологически активных веществ (адреналин, тироксин). Фенилаланин служит основным источником синтеза тирозина, являющегося предшественником ряда биологически важных веществ: гормонов (тироксина, адреналина), некоторых пигментов.
Триптофан (Три) — α-амино-β-индолилпропионовая кислота используется для синтеза витамина РР, серотонина, гормонов эпифиза.
Гистидин (Гис) — α-амино-β-имидазолилпропионовая кислота может использоваться при образовании гистамина, регулирующего проницаемость капилляров и проявляющего свое действие при аллергии.
Диаминомонокарбоновые аминокислоты:
Лизин (Лиз) — диаминокапроновая кислота и Аргинин (Apг) — α-амино-β-гуанидинвалериановая кислота — имеют дополнительную аминогруппу, которая придает основные свойства белкам, содержащим много таких аминокислот. Лизин необходим для синтеза белков, в том числе гистонов, входящих в состав нуклеопротеидов; обнаружен в структуре некоторых ферментов. Образование аргинина является частью метаболического пути обезвреживания аммиака (синтез мочевины).
Иминокислота — Пролин (Про) отличается от других аминокислот по строению. Особое место отводится этой аминокислоте в структуре коллагена, где пролин в процессе синтеза коллагена может превращаться в гидроксипролин.
Общая характеристика аминокислот — Аминокислоты — Статьи
Аминокислоты — органические кислоты, молекулы которых содержат одну или несколько аминогрупп (NH2-группы). Представляют основные структурные элементы белков. Белки пищи в организме человека расщепляются до аминокислот. Определенная часть аминокислот, в свою очередь, расщепляется до органических кетокислот, из которых в организме вновь синтезируются новые аминокислоты, а затем белки. В природе обнаружено свыше 20 аминокислот.
Аминокислоты всасываются из желудочно-кишечного тракта и с кровью поступают во все органы и ткани, где используются для синтеза белков и подвергаются различным превращениям. В крови поддерживается постоянная концентрация аминокислот. Из организма выделяется около 1 г азота аминокислот в сутки. В мышцах, ткани головного мозга и печени содержание свободных аминокислот во много раз выше, чем в крови, и менее постоянно. Концентрация аминокислот в крови позволяет судить о функциональном состоянии печени и почек. Содержание аминокислот в крови может заметно нарастать при нарушениях функции почек, лихорадочных состояниях, заболеваниях, связанных с повышенным содержанием белка.
Аминокислоты подразделяются на незаменимые (валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин), частично заменимые (аргинин и гистидин) и заменимые (аланин, аспарагин, аспарагиновая кислота, глицин, глутамин, глутаминовая кислота, пролин, серин, тирозин, цистеин).
Незаменимые аминокислоты не синтезируются в организме человека, но необходимы для нормальной жизнедеятельности. Они должны поступать в организм с пищей. При недостатке незаменимых аминокислот задерживается рост и развитие организма. Оптимальное содержание незаменимых аминокислот в пищевом белке зависит от возраста, пола и профессии человека, а также от других причин. Заменимые аминокислоты синтезируются в организме человека.
Аминокислоты представляют собой структурные химические единицы, образующие белки.
Любой живой организм состоит из белков. Разнообразные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками.
Дефицит белков в организме может привести к нарушению водного баланса, что вызывает отеки. Каждый белок в организме уникален и существует для специальных целей. Белки не являются взаимозаменяемыми. Они синтезируются в организме из аминокислот, которые образуются в результате расщепления белков, находящихся в пищевых продуктах. Таким образом, именно аминокислоты, а не сами белки являются наиболее ценными элементами питания.
Какие еще функции выполняют аминокислоты?
Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма так некоторые из них:
- Выполняют роль нейромедиаторов или являются их предшественниками. Нейромедиаторы — это химические вещества, передающие нервный импульс с одной нервной клетки на другую. Таким образом, некоторые аминокислоты необходимы для нормальной работы головного мозга.
- Аминокислоты способствуют тому, что витамины и минералы адекватно выполняют свои функции.
- Некоторые аминокислоты непосредственно снабжают энергией мышечную ткань.
Что будет, если аминокислот не хватает?
В организме человека многие из аминокислот синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей. К таким незаменимым аминокислотам относятся:
- гистидин,
- изолейцин,
- лейцин,
- лизин,
- метионин,
- фенилаланин,
- треонин,
- триптофан,
- валин.
Аминокислоты, которые синтезируются в печени, включают:
- аланин,
- аргинин,
- аспарагин,
- аспарагиновую кислоту,
- цитруллин,
- цистеин,
- гамма-аминомасляную кислоту,
- глютамовую кислоту,
- глютамин,
- глицин,
- орнитин,
- пролин,
- серин,
- таурин,
- тирозин.
Процесс синтеза белков постоянно идет в организме. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным нарушениям — от расстройств пищеварения до депрессии и замедления роста.
Многие факторы приводят к этому, даже, если ваше питание сбалансировано, и вы потребляете достаточное количество белка. Нарушение всасывания в желудочно-кишечном тракте, инфекция, травма, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме — все это может привести к дефициту незаменимых аминокислот.
Какие аминокислоты следует принимать?
В настоящее время можно получать незаменимые и заменимые аминокислоты в виде биологически активных пищевых добавок. Это особенно важно при различных заболеваниях и при применении редукционных диет. Вегетарианцам необходимы такие добавки, содержащие незаменимые аминокислоты, чтобы организм получал все необходимое для нормального синтеза белков.
При выборе добавки, содержащей аминокислоты, предпочтение следует отдавать продуктам, содержащим L-кристаллические аминокислоты. Большинство аминокислот существует в виде двух форм, химическая структура одной является зеркальным отображением другой. Они называются D- и L-формами, например D-цистин и L-цистин. D означает dextra (правая на латыни), a L — levo (соответственно, левая). Эти термины обозначают пространственное строение данной молекулы. Белки животных и растительных организмов созданы L-формами аминокислот (за исключением фенилаланина, который представлен D,L- формами). Таким образом, только L-аминокислоты являются биологически активными участниками метаболизма.
Свободные, или несвязанные, аминокислоты представляют собой наиболее чистую форму. Они не нуждаются в переваривании и абсорбируются непосредственно в кровоток. После приема внутрь всасываются очень быстро и, как правило, не вызывают аллергических реакций.
Войдите на сайт, чтобы оставлять комментарии
Виды аминокислот и их характеристика – Блог Ивана Устинова


Всем привет! Так как вас интересуют аминокислоты — рад вас посвятить в эту тему. Статья не будет интересной, будет очень скучно. Даже картинок не будет! Да, вот так вот… Да и в общем не статья это, а техническая информация для тех кого это интересует. Итак…
Существует три группы аминокислот.
- Незаменимые аминокислоты — эти виды аминокислот не могут синтезироваться организмом, поэтому они должны поступать с пищей.
- Заменимые аминокислоты — эти виды аминокислот могут синтезироваться организмом из других составляющих.
- Условно заменимые аминокислоты — эти виды аминокислот обычно синтезируются организмом, но в условиях стресса (физические нагрузки, болезнь) вырабатываются в недостаточных количествах или же не синтезируются вообще.
Незаменимые
Валин — является одной из трёх аминокислот, которая имеет разветвлённые боковые цепочки. Очень активно используется мышцами. Входит в состав BCAA добавок. Содержится в зерновых, грибах, мясе, сое, арахисе, в молочных продуктах.
Изолейцин — является одной из трёх аминокислот, которая имеет разветвлённые боковые цепочки. Обеспечивает мышцы энергией. Эта аминокислота помогает избавится от чувства усталости в мышцах. Входит в состав BCAA добавок. Играет большую роль в производстве гемоглобина в организме. Содержится в миндале, кешью, курином мясе, яйцах, рыбе, чечевице, печени, мясе, ржи, большинстве семян, сое.
Гистидин — применяется в лечении аллергических заболеваний, язвы кишечника, артритов, язвы желудка, анемии. Необходим для производства в организме белых и красных кровяных телец. Может поглощать ультрафиолетовые лучи. Содержится в тунце, лососе, свиной вырезке, говяжьем филе, куриных грудках, соевых бобах, арахисе, чечевице.
Лейцин — используется как источник энергии. Входит в состав BCAA добавок. Помогает заживлению ран, улучшает сращивание костей, и замедляет распад мышечного белка. Содержится в мясе, рыбе, буром рисе, чечевице, орехах, большинстве семян.
Треонин — не даёт жиру накопиться в печени и очень активно способствует выводу токсинов. Содержится в молочных продуктах и яйцах, а также в бобах и орехах.
Лизин — нехватка лизина в организме замедляет синтез протеина в мышцах. Витамин С вместе с лизином образуют в печени новую аминокислоту L-карнитин. Во время тренировки карнитин способствует сжиганию жира в организме, потому что использует его как топливо для работы мышц. Лизин способствует уменьшению жировой прослойки, укреплению суставов и росту костей. Лизин помогает вырабатывать коллаген, который входит в состав сухожилий и суставов. Содержится в рыбе, молочных продуктах, мясе, пшенице, орехах.
Метионин — является предшественником креатина и цистина в организме. Снижает уровень холестерина в крови. В то же время увеличивает уровень глютамина, который выступает в роли антиоксиданта в организме. Улучшает заживление тканей и выводит токсины из печени и почек. Содержится в молоке, мясе, рыбе, яйцах, бобах, фасоли, сое и чечевице.
Фенилаланин — стимулирует деятельность мозга, улучшает память и концентрацию внимания. Является одним из основных элементов в производстве коллагена. Увеличивает настроение и подавляет аппетит. Содержится в говядине, соевых бобах, рыбе, курином мясе, яйцах, молоке, твороге.
Триптофан — успокаивает и стимулирует выработку гормона роста. Содержится в мясе, бананах, овсе, сушёных финиках, арахисе, индейке, кунжуте, кедровых орехах, молоке, йогурте, твороге, рыбе, курятине.
Заменимые
Аланин — является главным компонентом всех соединительных тканей в нашем организме. Позволяет снабжать мышцы энергией из аминокислот, повышает иммунитет.
Глутаминовая кислота — необходимая кислота для деятельности мозга и для всевозможных обменных процессов. Считается потенциальным энергетиком.
Глицин — участвует в формировании организмом новых заменимых аминокислот, является компонентом структуры гемоглобина и ферментов, которые участвуют в вырабатывании энергии. Стимулирует выработку глюкагона, который активизирует гликоген. Очень успокаивает и подавляет желание есть сладкое.
О нём есть отельная статья на блоге — читайте здесь!
Аспаргиновая кислота — участвует в преобразовании углеводов в энергию для работы мышц. Снижает уровень аммиака в организме после длительных тренировок. Является стройматериалом для иммуноглобулинов и антител.
Глутамин — очень важная кислота для иммунитета. Служит источником энергии для почек, кишечника и мозга. Серьезно стимулирует деятельность мозга, улучшает память и концентрацию внимания. Есть отдельная статья про глютамин и глютаминовую кислоту.
Серин — способствует укреплению иммунной системы нашего организма. Участвует в производстве клеточной энергии. Стимулирует функции нервной системы.
Орнитин — если его принимать в больших дозах, то он увеличивает выработку гормона роста. Выводит токсины и яды из печени, стимулирует иммунитет.
Таурин — стимулирует поглощение и сжигание подкожных слоёв жира. В некоторых случаях действует как нейропередатчик в определённых участках головного мозга.
Пролин — является основным элементом, который способствует образованию всех соединительных тканей в организме.
Цистин — очень активно участвует в заживлении ранений. Укрепляет соединительные ткани. Крайне важная аминокислота для здоровья наших волос и кожи. Стимулирует антиокислительные процессы. Улучшает работоспособность белых и красных кровяных телец.
Условно заменимые
Аргинин — стимулирует гормон роста. Служит основным источником окиси азота в организме. Повышает высвобождение глюкагона и инсулина. Положительно влияет на выработку мужских гормонов, помогает образовывать коллаген и стимулировать иммунную систему. Так же имеет ярко выраженное заживляющие действие. Содержится в медикаментозных препаратах и пищевых добавках для спортсменов и добавках, применяемых для стимулирования иммунитета.
Цистеин — понижает негативное действие табака и алкоголя. Стимулирует работу красных и белых кровяных телец. Содержится во многих белках, из которых получается путем гидролиза.
Тирозин — улучшает настроение. Его недостатка обычно не возникает, потому что она в достаточном количестве поступает в организм с белками пищи.
Это все основные виды аминокислот, которые используются в спортивном питании. Возможно эта информация была для вас полезной. Удачи, друзья!
comments powered by HyperCommentsP.S. Подписывайтесь на обновление блога, чтобы ничего не упустить! Приглашаю также в свой Instagram


1. Понятие об аминокислотах, классификация аминокислот
Лекция №11
Тема «Аминокислоты. Белки»
План:
Понятие об аминокислотах, классификация аминокислот
Физические и химические свойства аминокислот. Способы их получения
Белки – как биополимеры. Строение белковых молекул
Физические и химические свойства белков. Цветные реакции белков
Превращения и функции белков в организме.
Конспект лекции
Аминокислоты – гетерофункциональные соединения, содержащие две функциональные группы: аминогруппу ─NH2 и карбоксильную группу ─ COOH, связанные с углеводородным радикалом.
Общая формула аминокислот:
(H2N)m─ R─ (COOH)n, где m и n – чаще всего равны 1 или 2
Классификация
1. По числу функциональных групп
– моноаминомонокарбоновые m=1, n=1
– диаминомонокарбоновые m=2, n=1
– моноаминодикарбоновые m=1, n =2
2. По положению аминогруппы
γ β α
СН3─СН2─СН─СООН α-аминомасляная (2-аминобутановая) кислота
│
NH2
γ β α
СН3─СН ─СН2─СООН β-аминомасляная (3-аминобутановая) кислота
│
NH2
γ β α
NH2─СН2─СН2 ─СН2─СООН γ-аминомасляная кислота (4-аминобутановая) кислота
3. аминокислоты организма Остатки около 20 различных α-аминокислот входят в состав белков
глицин (аминоуксусная кислота)
NH2─СН2─СООН
аланин (α-аминопропионовая кислота, 2-аминопропановая кислота)
СН3 ─СН─СООН
│
NH2
серин (α-амино-β-гидроксипропионовая кислота, 2-амино-3-гидроксипропановая кислота)
НО─СН2 ─СН─СООН
│
NH2
цистеин (α-амино-β-меркаптопропионовая кислота, 2-амино-3-меркаптопропановая кислота)
НS─СН2 ─СН─СООН
│
NH2
аспарагиновая кислота (аминоянтарная кислота, аминобутандиовая кислота)
НООС─СН2 ─СН─СООН
│
NH2
фенилаланин (α-амино-β-фенилпропионовая кислота, 2-амино-3-фенилпропановая кислота)
СН2─СН─СООН
│ │
С6Н4 NH2
│
ОН
Лизин (α, ε- диаминокапроновая кислота, 2,6-диаминогексановая кислота)
NH2─СН2─ (СН2)3─СН─СООН
│
NH2
2. Физические и химические свойства аминокислот. Способы их получения
Физические свойства аминокислот
Аминокислоты – бесцветные кристаллические вещества, хорошо растворимые в воде, температура плавления 230-3000, многие аминокислоты имеют сладкий вкус
Химические свойства аминокислот
(H2N)m─ R─ (COOH)n
1. Аминогруппа ─NH2 определяет основные свойства аминокислот, т.к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия неподеленной электронной пары у атома азота.
H2N─CH─COOH + HCl → [H3N+─CH─COOH]+ Cl–
│ │
R R
2. Карбоксильная группа ─ COOH определяет кислотные свойства.
H2N─CH─COOH + NaOH → H2N─СН─СОО– Na+ + Н2О
│ │
R R
Следовательно, аминокислоты – это амфотерные соединения.
3. Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в её состав карбоксильной группой, образуя внутреннюю соль:
H2N─CH─COOH ↔ H3N+─СН─СОО– (биполярный ион, цвиттер-ион)
│ │
R R
Водные растворы моноаминомонокарбоновых кислот нейтральны, рН=7; водные растворы монодиаминокарбоновых кислот имеют рН<7, кислая среда; диаминомонокарбоновые кислоты имеют щелочную среду, рН>7.
4. Взаимодействие аминокислот друг с другом – образование пептидов
R─CH─CO[OH + R1─CH─COOH → R─CH─[CO─NH]─CH─COOH +H2O
│ │ │ пептидная │
NH2 H]─N─H NH2 связь R1
Любой дипептид имеет свободные амино- и карбоксильную группу и поэтому может взаимодействовать с ещё одной молекулой аминокислоты, образуя трипептид и т.д.
Общая формула пептидов:
R─CH─ (CO─NH─CH)n─COOH
│ │
NH2 R1
Пептиды, содержащие до 10 аминокислотных остатков, называются олигопептиды; полипептиды содержат боле десяти аминокислотных остатков.
Реакция образования пептидов относится к реакциям поликонденсации.
Поликонденсация – реакция образования высокомолекулярных соединений, сопровождающаяся выделением побочных низкомолекулярных продуктов (H2O NH3 и др.)
Получение аминокислот
1. через галогенпроизводные карбоновых кислот
СН3─СООН +Cl2→ ClCH2─COOH + HCl
монохлоруксусная кислота
ClCH2─COOH + NH3 → NH2─СН2─СООН + HCl
аминоуксусная кислота
2. гидролиз белков
алифатические, ароматические, гетероциклические. Заменимые и незаменимые α-Аминокислоты. Привести примеры.
α-Аминокислоты – гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
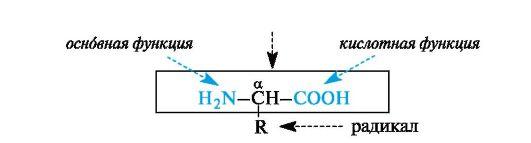
Многие α-аминокислоты синтезируются в организме. Некоторые аминокислоты, необходимые для синтеза белков, в организме не образуются и должны поступать извне. Такие аминокислоты называют незаменимыми
К незаменимым α-аминокислотам относятся:
валин изолейцин метионин триптофан
лейцин лизин треонин фенилаланин
Алифатические α-аминокислоты. Это наиболее многочисленная группа. Внутри нее аминокислоты подразделяют с привлечением дополнительных классификационных признаков.
В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют:
• нейтральные аминокислоты – по одной группе Nh3 и СООН;
• основные аминокислоты – две группы Nh3 и одна группа
СООН;
• кислые аминокислоты – одна группа Nh3 и две группы СООН.
Можно отметить, что в группе алифатических нейтральных аминокислот число атомов углерода в цепи не бывает больше шести. При этом не существует аминокислоты с четырьмя атомами углерода в цепи, а аминокисоты с пятью и шестью атомами углерода имеют только разветвленное строение (валин, лейцин, изолейцин).
В алифатическом радикале могут содержаться «дополнительные» функциональные группы:
• гидроксильная – серин, треонин;
• карбоксильная – аспарагиновая и глутаминовая кислоты;
• тиольная – цистеин;
• амидная – аспарагин, глутамин.
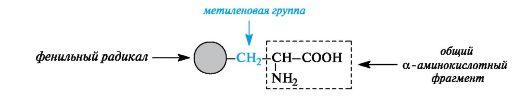
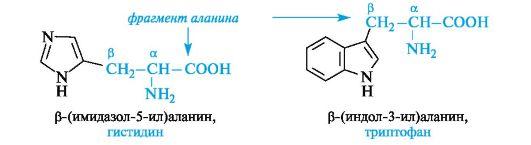
Ароматические α-аминокислоты. К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН2-.
Гетероциклические α-аминокислоты. Относящиеся к этой группе гистидин и триптофан содержат гетероциклы – имидазол и индол соответственно. Строение и свойства этих гетероциклов рассмотрены ниже (см. 13.3.1; 13.3.2). Общий принцип построения гетероциклических аминокислот такой же, как и ароматических.
Гетероциклические и ароматические α-аминокислоты можно рассматривать как β-замещенные производные аланина.
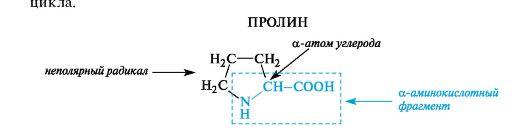
К героциклическим относится также аминокислота пролин, в которой вторичная аминогруппа включена в состав пирролидинового
18. Свойства α-Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
Пояснить на конкретном примере.
Амфотерность аминокислот обусловлена кислотными (СООН) и основными (Nh3) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.

В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы h4N+ – CHR-COO- (обычно используемая запись
строения аминокислоты в неионизированной форме служит лишь для удобства).
В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.

Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН 1-2) и анион- ные – в сильнощелочных (рН >11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200 ?С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т. п.
Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
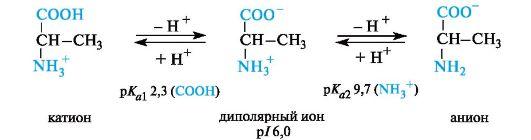
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой (p/).
Нейтральные α-аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -/-эффекта группы Nh3. Например, у аланина изоэлектрическая точка находится при рН 6,0.
Кислые α-аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рКа, как это видно на примере аспарагиновой кислоты (р/ 3,0).
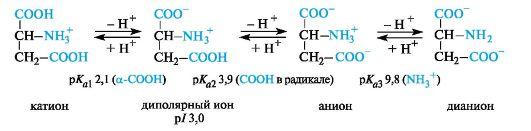
У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 12.1). В организме при физиологических значениях рН (например, рН крови 7,3-7,5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основные α-аминокислоты. В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7. В сильно- кислой среде эти соединения также представляют собой трехосновные кислоты, этапы ионизации которых показаны на примере лизина (р/ 9,8).
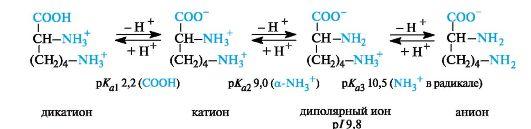
В организме основные аминокислоты находятся в виде катионов, т. е. у них протонированы обе аминогруппы.
В целом ни одна α-аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
19. Биологически важные реакции α-Аминокислот: а) трансаминирование; б) декарбоксилирование; в) дезаминирование: окислительное, восстановительное, внутримолекулярное, гидролитическое; г) образование пептидов.
В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким пре- вращениям относятся трансаминирование, декарбоксилирование, элиминирование, альдольное расщепление, окислительное дезаминирование, окисление тиольных групп.
Трансаминирование является основным путем биосинтеза α-ами- нокислот из α-оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором – α-оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота – в аминокислоту с соответствующим строением радикалов. В итоге трансаминирование представляет обратимый процесс взаимообмена амино- и оксо- групп. Пример такой реакции – получение l-глутаминовой кислоты из 2-оксоглутаровой кислоты. Донорной аминокислотой может служить, например, l-аспарагиновая кислота.
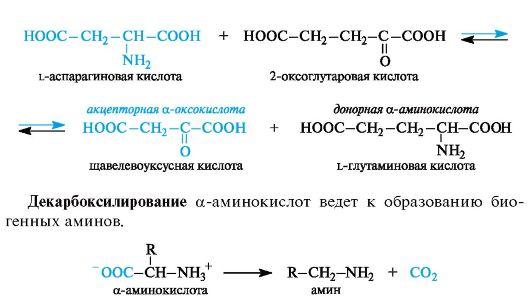
α-Аминокислоты содержат в α-положении к карбоксильной группе электроноакцепторную аминогруппу (точнее, протонированную аминогруппу Nh4+), в связи с чем способны к декарбоксилированию.
Окислительное дезаминирование может осуществляться с участием ферментов и кофермента НАД+ или НАДФ+. α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из l-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегид- рирование (окисление) глутаминовой кислоты до α-иминоглутаровой
кислоты. На второй стадии происходит гидролиз, в результате которого получаются α-оксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента.
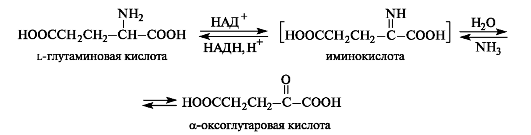
В обратном направлении протекает реакция восстановительного аминирования α-оксокислот. Всегда содержащаяся в клетках α-оксоглутаровая кислота (как продукт метаболизма углеводов) превращается этим путем в L-глутаминовую кислоту.
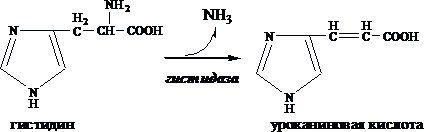
Внутримолекулярное дезаминирование
Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза (гистидин-аммиаклиаза). Эта реакция происходит только в печени и коже.
Гидролитиическое дезаминирование происходит при помощи фермента аденозин дезаминаза и выглядит следующим образом:
R-CH(NH2)-COOH + H2O—-> R-CH(OH)-COOH +NH3
В результате образуются, как мы уже поняли, гидроксикислоты…
Пептидную и белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с обра- зованием пептидной (амидной) связи между мономерными звеньями
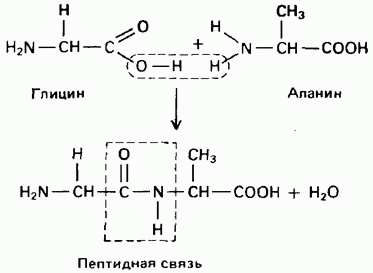
20. Аминоспирты: коламин (2-аминоэтанол), холин. Бетаин как продукт окисления холина. Строение, биологическая роль. Аминофенолы. Катехоламины: дофамин, норадреналин, адреналин. Строение, биологическая роль.
Аминоспиртами называют соединения, содержащие в молекуле одновременно амино- и гидроксигруппы.
Эти две функциональные группы непрочно удерживаются у одного атома углерода, в результате чего происходит отщепление аммиака или воды. Простейшим представителем аминоспиртов является 2-аминоэтанол – соединение, в котором обе группы расположены у соседних атомов углерода. 2-Аминоэтанол (тривиальное название коламин) является структурным компонентом сложных липидов – фосфатидилэтаноламинов (см. 10.4.1).
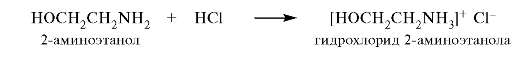
С сильными кислотами 2-аминоэтанол образует устойчивые соли.
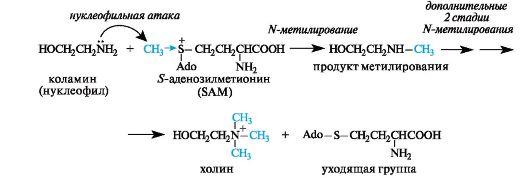
Четвертичное аммониевое основание – гидроксид (2-гидрокси- этил)триметиламмония [HOCh3Ch3N+(Ch4)3]OH- – имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. Его катион называют холином
В организме холин образуется с участием кофермента S-аде- нозилметионина (SAM), являющегося переносчиком метильных групп. В молекуле этого кофермента метильная группа «активирована» вследствие того, что находится в составе сульфониевой группировки.
При метилировании коламина в реакции участвует атом азота, более нуклеофильный, чем атом кислорода
В результате окисления холина in vivo образуется диполярный ион бетаин, который также может служить источником метильных групп, входящих в состав аммониевой группировки.
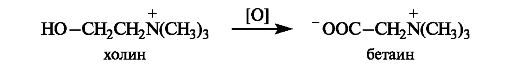
Сложноэфирные производные холина выполняют в организме различные биологические функции. Замещенные фосфаты холина являются структурной основой фосфолипидов – фосфатидилхолинов – важнейшего строительного материала клеточных мембран (см. 10.4.1). Сложный эфир холина и уксусной кислоты – ацетилхолин – наиболее распространенный посредник при передаче нервного возбуждения в нервных тканях (нейромедиатор). Он образуется в организме при ацетилировании холина с помощью ацетилкофермента А
Важная роль в организме принадлежит аминоспиртам, содержащим в качестве структурного фрагмента остаток пирокатехина. Они носят общее название катехоламинов. К этой группе относятся представители образующихся в организме биогенных аминов. К катехоламинам принадлежат дофамин, норадреналин и адреналин, выполняющие, как и ацетилхолин, роль нейромедиаторов. Адреналин участвует в регуляции сердечной деятельности, при физиологических стрессах он выделяется в кровь («гормон страха»).
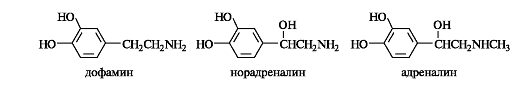
В ароматическом ряду основу важных природных биологически активных соединений и синтетических лекарственных средств составляют и-аминофенол, и-аминобензойная, салициловая и сульфаниловая кислоты.
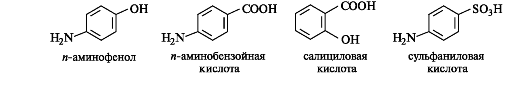
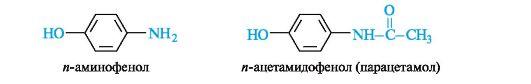
и-Аминофенол и его производные. Как гетерофункциональное соединение п-аминофенол может образовывать производные по каждой функциональной группе в отдельности и одновременно по двум функциональным группам. Сам п-аминофенол ядовит; интерес для медицины представляет его производное – парацетамол, оказывающий анальгетическое (обезболивающее) и жаропонижающее действие.
аминокислоты

СТРОЕНИЕ И СВОЙСТВА АМИНОКИСЛОТ, ВХОДЯЩИХ В СОСТАВ БЕЛКОВ. ПЕПТИДНЫЕ СВЯЗИ, СОЕДИНЯЮЩИЕ АМИНОКИСЛОТЫ В ЦЕПИ
Белки – полимерные молекулы, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 α-аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке. Аминокислоты можно рассматривать как буквы алфавита, при помощи которых, как в слове, записывается информация. Слово несёт информацию, например о предмете или действии, а последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка.
А. Строение и свойства аминокислот
1. Общие структурные особенности аминокислот, входящих в состав белков
Общая структурная особенность аминокислот – наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродным атомом. R – радикал аминокислот – в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
Вводных растворах при нейтральном значении рН α-аминокислоты существуют в виде биполярных ионов.
Вотличие от 19 остальных α-аминокислот, пролин – иминокислота, радикал которой связан как с α -углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
19 из 20 аминокислот содержат в α-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах – L и D. Исключение составляет глицин, который не имеет асимметричного α-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L- изомеры аминокислот.
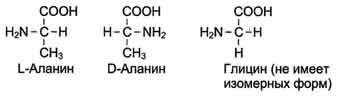
Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментатив-но превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L- изомер, поэтому по содержанию D-аспартата можно рассчитать возраст обследуемого.
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к α-углеродному атому.
2. Классификация аминокислот по химическому строению радикалов
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические (табл. 1-1).
В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-Nh3), тиольная
(-SH), амидная (-CO-Nh3), гидроксильная (-ОН) и гуанидиновая  группы.
группы.
Названия аминокислот можно построить по заместительной номенклатуре, но обычно используют тривиальные названия (табл. 1-2).
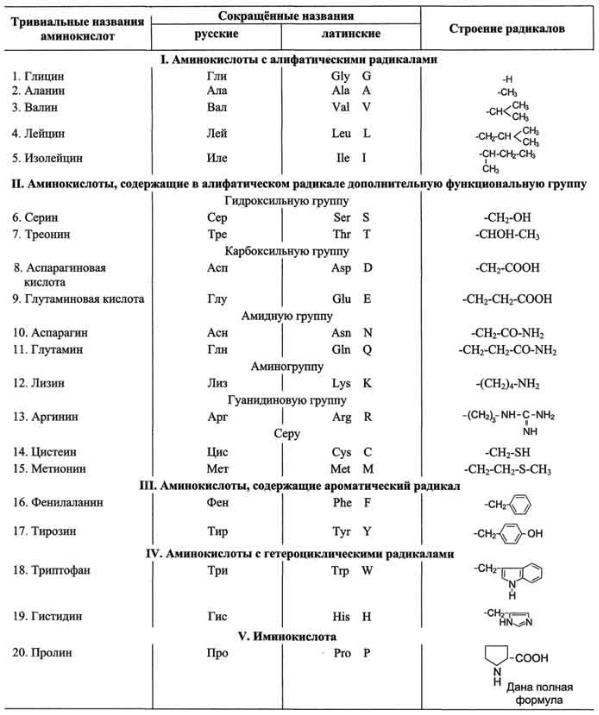
Таблица 1-1. Классификация основных аминокислот белков по их химическому строению
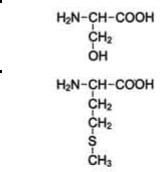
Таблица 1-2. Примеры названий аминокислот по заместительной номенклатуре и соответствующие тривиальные названия
Название аминокислоты | Формула аминокислоты | Тривиальное название |
по заместительной |
|
|
номенклатуре |
|
|
|
|
|
2-амино-З- |
| Серии |
гидроксипропановая кислота |
|
|
|
|
|
2-амино-4- |
| Метионин |
метилтиомасляная кислота |
|
|
|
|
|
Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы (см. табл. 1-1).
Тривиальные названия часто происходят от названия источника, из которого они впервые были выделены, или от свойств данной аминокислоты. Так, серии впервые был выделен из фиброина шёлка (от лат. serieum – шелковистый), а глицин получил свое название из-за сладкого вкуса (от греч. glykos – сладкий).
3. Классификация аминокислот по растворимости их радикалов в воде
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными.
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают).
Аминокислоты с неполярными радикалами
К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
Аминокислоты с полярными незаряженными радикалами
Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серии, треонин и тирозин, имеющие
гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой.
Цистеин и тирозин содержат соответственно тиольную и гидроксильную группы, способные к диссоциации с образованием Н+, но при рН около 7,0, поддерживаемого в клетках, эти группы практически не диссоциируют.
Аминокислоты с полярными отрицательно заряженными радикалами
К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО- и Н+. Следовательно, радикалы данных аминокислот – анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
Аминокислоты с полярными положительно заряженными радикалами
Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У лизина вторая аминогруппа, способная присоединять Н+, располагается в ?- положении алифатической цепи, а у аргинина положительный заряд приобретает, хуанидиновая группа, Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп – отдавать протон, теряя положительный заряд радикала. Положительно заряженные радикалы – катионы (см. схему ниже).
Наибольшей растворимостью в воде обладают полярные заряженные радикалы аминокислот.
4. Изменение суммарного заряда аминокислот в зависимости от рН среды
При нейтральных значениях рН все кислотные (способные отдавать Н+) и все основные (способные присоединять Н+) функциональные группы находятся в диссоциированном состоянии.
Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, – положительный заряд (табл. 1-3).
Изменение рН в кислую сторону (т.е. повышение в среде концентрации Н+) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд.
Напротив, увеличение концентрации ОН- групп вызывает отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд.

5. Модифицированные аминокислоты, присутствующие в белках
Непосредственно в синтезе белков организма человека принимают участие только 20 перечисленных аминокислот. Однако в некоторых белках имеются нестандартные модифицированные аминокислоты – производные одной из этих 20 аминокислот. Например, в молекуле коллагена (фибриллярного белка межклеточного матрикса) присутствуют гидроксипроизводные лизина и пролина – 5-гидроксилизин и 4- гидроксипролин.
Модификации аминокислотных остатков осуществляются уже в составе белков, т.е. только
Модифицированные аминокислоты, найденные в составе белков
после окончания их синтеза. Введение дополнительных функциональных групп в структуру аминокислот придаёт белкам свойства,
Схема. Структура полярных заряженных аминокислот в диссоциированной форме
Таблица 1-3. Изменение суммарного заряда аминокислот в зависимости от рН среды

необходимые для выполнения ими специфических функций. Так, α-карбоксиглутаминовая кислота входит в состав белков, участвующих в свёртывании крови, и две близко лежащие карбоксильные группы в их структуре необходимы для связывания белковых факторов с ионами Са2+. Нарушение карбоксилирования глутамата приводит к снижению свёртываемости крови.
6. Химические реакции, используемые для обнаружения аминокислот
Способность аминокислот вступать в те или иные химические реакции определяется наличием в их составе функциональных групп. Так как все аминокислоты, входящие в состав белков, содержат у α-углеродного атома амино- и карбоксильную группы, они могут вступать в характерные для всех аминокислот химические реакции. Наличие какихлибо функциональных групп в радикалах индивидуальных аминокислот определяет их способность вступать в специфичные для данных аминокислот реакции.
Нингидриновая реакция на α-аминокислоты
Для обнаружения и количественного определения аминокислот, находящихся в растворе, можно использовать нингидриновую реакцию.
Эта реакция основана на том, что бесцветный нингидрин, реагируя с аминокислотой, конденсируется в виде димера через атом азота, отщепляемый от α-аминогруппы аминокислоты. В результате образуется пигмент красно-фиолетового цвета. Одновременно происходит декарбоксилирование аминокислоты, что приводит к образованию СО2 и соответствующего альдегида. Нингидриновую реакцию широко используют при изучении первичной структуры белков (см. схему ниже).
Так как интенсивность окраски пропорциональна количеству аминокислот в растворе, её используют для измерения концентрации α аминокислот.
Нингидриновая реакция, используемая для определения αаминокислот
Специфические реакции на отдельные аминокислоты
Качественное и количественное определение отдельных аминокислот возможно благодаря наличию в их радикалах особенных функциональных групп.
Аргинин определяют с помощью качественной реакции на гуанидиновую группу (реакция Сакагучи), а цистеин выявляют реакцией Фоля, специфичной на SH-группу данной аминокислоты. Наличие ароматических аминокислот в растворе определяют ксантопротеиновой реакцией (реакция нитрования), а наличие гидроксильной группы в ароматическом кольце тирозина – с помощью реакции Миллона.
Б. Пептидная связь. Строение и биологические свойства пептидов
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между а-карбоксильной группой одной аминокислоты и α-аминогруппой другой, т.е. является амидной связью. При этом происходит отщепление молекулы воды (см. схему А).
1. Строение пептида
Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, окгапептид и т.д.
Пептиды, содержащие более 10 аминокислот, называют “полипептиды”, а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин “белок” часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном.
Мономеры аминокислот, входящих в состав белков, называют “аминокислотные остатки”. Аминокислотный остаток, имеющий свободную аминогруппу, называется N- концевым и пишется слева, а имеющий свободную ?-карбоксильную группу – С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название “пептидный остов” (см. схему Б).
При названии полипептида к сокращённому названию аминокислотных остатков добавляют суффикс -ил, за исключением С-концевой аминокислоты. Например, тетрапептид Сер-Гли-Про-Ала читается как серилглицилпролилаланин.
Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот.
Серилглицилпролилаланин

Схема А. Образование дипептида
Схема Б. Строение пептидов
Сер-Гис-Про-Ала и Ала-Про-Гис-Сер – два разных пептида, несмотря на то, что они имеют одинаковые количественный и качественный составы аминокислот.
2.Характеристика пептидной связи
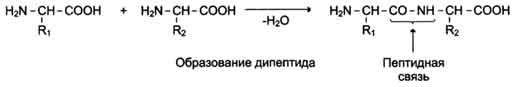
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу (рис. 1-1).
Связь между α углеродным атомом и α-аминогруппой или α-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве (рис. 1-2).
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки.
В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein – белок, lysis – разрушение), называемых также протеазами, или пептидгидролазами.
Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей).
3.Биологическая роль пептидов
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью.
Рис. 1-1. Плоскости расположения пептидных групп и α-углеродных атомов в пространстве.
Рис. 1-2. Транс-конфигурация пептидных связей. Функциональные группы -СО- и -NH-,
образующие пептидные связи, не ионизированы, но полярны, и могут участвовать в образовании водородных связей.
Количество аминокислотных остатков в структуре биологически активных пептидов может варьировать от 3 до 50. К одним из самых “маленьких” пептидов можно отнести ти- реотропин-рилизинг-гормон и глутатион (трипептиды), а также энкефалины, имеющие в своём составе 5 аминокислот. Однако большинство биологически активных пептидов имеет в своём составе более 10 аминокислот, например нейропептид Y (регулятор аппетита) содержит 36 аминокислот, а кортиколиберин – 41 аминокислоту.
Некоторые из пептидов, в частности большинство пептидных гормонов, содержат пептидные связи, образованные а-аминогруппой и а-карбоксильной группой соседних аминокислот. Как правило, они синтезируются из неактивных белковых предшественников, в которых специфические протеолитические ферменты разрушают определённые пептидные связи.
Ангиотензин II – октапептид, образующийся из крупного белка плазмы крови ангиотензиногена в результате последовательного действия двух протеолитических ферментов.
Первый протеолитический фермент ренин отщепляет от ангиотензиногена с N-конца пептид, содержащий 10 аминокислот, называемый ангиотензином I. Второй протеолитический фермент карбоксидипептидилпептидаза отщепляет от С-конца
Свойства аминокислот: химические и физические
Cвойства аминокислот можно разделить на две группы: химические и физические.
Химические свойства аминокислот
В зависимости от соединений, аминокислоты могут проявлять различные свойства.
Взаимодействие аминокислот:
Аминокислоты как амфотерные соединения образуют соли и с кислотами, и со щелочами.
Как карбоновые кислоты аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
Взаимодействие и свойства аминокислот с основаниями:
Образуются соли:
NH2-CH2-COOH + NaOH NH2-CH2-COONa + h3O
Натриевая соль + 2-аминоуксусной кислоты Натриевая соль аминоуксусной кислоты (глицина) + вода
Взаимодействие со спиртами:
Аминокислоты могут реагировать со спиртами при наличии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
NH2-CH2-COOH + CH3OH NH2-CH2-COOCH3 + H2O.
Метиловый эфир / 2-аминоуксусной кислоты /
Взаимодействие с аммиаком:
Образуются амиды:
NH2-CH(R)-COOH + H-NH2 = NH2-CH(R)-CONH2 + H2O
Амид
Взаимодействие аминокислот с сильными кислотами:
Получаем соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl (или HOOC-CH2-NH2*HCl↑)
Таковы основные химические свойства аминокислот.
Физические свойства аминокислот
Перечислим физические свойства аминокислот:
- Бесцветные
- Имеют кристаллическую форму
- Большинство аминокислот со сладким привкусом, но в зависимости от радикала (R) могут быть горькими или безвкусными
- Хорошо растворяются в воде, но плохо растворяются во многих органических растворителях
- Аминокислоты имеют свойство оптической активности
- Плавятся с разложением при температуре выше 200°C
- Нелетучие
- Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток
Добавить интересную новость
